2. 三峡医药高等专科学校, 重庆 402120 ;
3. 重庆医科大学护理学院, 重庆 400016 ;
4. 重庆医科大学公共卫生与管理学院, 重庆 400016
2. Chongqing Three Gorges Medical College, Chongqing 404120, China ;
3. College of Nursing, Chongqing Medical University, Chongqing 400016, China ;
4. School of Public Health and Management, Chongqing Medical University, Chongqing 400016, China
白血病是一种常见的血液系统恶性肿瘤,据统计,白血病已经占据我国肿瘤性疾病的第6位[1]。目前,白血病的治疗以化疗为主,然而,化疗是一种不可避免的损伤性治疗方法,竭力探索损伤较小的治疗白血病的新方法,是临床研究的热点。近年来研究表明,中药不仅可以减轻化疗的副作用,还可以延长甚至阻止白血病的复发;研究还表明,中药可以逆转包括白血病在内的多种肿瘤的多药耐药和预防相关并发症[2-4]。
吴茱萸碱(evodiamine,Evo)是从吴茱萸中提取出来的活性生物碱之一,具有降血压、降血糖、镇痛、减肥、抗肿瘤等多种生物学效应[5]。已有文献报道[6],吴茱萸碱可以明显抑制人宫颈癌HeLa,人前列腺癌PC-3,人黑色素瘤A375-S2、LNCaP,人急性白血病CCRF-CEM和人胃癌MGC803等细胞系的增殖和诱导细胞凋亡,但吴茱萸碱抗肿瘤的具体作用机制尚不清楚。
组蛋白乙酰化调控基因的转录和表达,涉及细胞内多种生理病理过程。组蛋白去乙酰化酶(histone deacetylases,HDACs)是组蛋白乙酰化平衡的关键酶之一,其催化组蛋白的去乙酰化作用,从而抑制体内包括抑癌基因在内的多种基因的转录[7]。大量研究表明,抑制HDACs可以导致多种肿瘤细胞的增殖抑制,也能促进细胞凋亡,HDACs已经成为潜在肿瘤治疗的靶点[8-9]。本研究以白血病K562细胞株为研究对象,探讨吴茱萸碱对K562细胞HDACs活性的影响和诱导白血病细胞凋亡的可能机制,为吴茱萸碱的临床应用以及白血病的治疗提供新的思路和实验依据。
1 材料 1.1 细胞株人白血病K562细胞株受赠于重庆医科大学检验系,由本实验室保存。
1.2 药品与试剂吴茱萸碱购自南京泽朗药物科技有限公司(质量分数98%,批号ZL20131015)。细胞胞浆胞核蛋白提取试剂盒、HDAC检测试剂盒购自美国BioVision公司;PVDF膜和ECL发光液购自美国Millpore公司;RPMI 1640培养基购自美国Gibco公司;胎牛血清购自以色列Bioind公司;甘氨酸、Trisbase、SDS购自美国Genview公司;Histone Deacetylase Antibody Sampler Kit购自美国Cell Signaling Technology公司;Cleaved Caspase-3、β-actin单克隆抗体、辣根过氧化物酶标记山羊抗小鼠和山羊抗兔IgG二抗购于碧云天生物技术研究所。
1.3 仪器MCV-B161S(T)超净工作台(Sanyo);CKX41倒置显微镜(Olympus);BS124S型电子天平(Sartorius);3K15低温离心机(Sigma);1510酶标仪(Thermo),043BR42402垂直电泳仪(Bio-RAD),ChemiDocXRS化学发光成像系统(Bio-RAD);3111二氧化碳培养箱(Thermo)。
2 方法 2.1 细胞培养取对数生长期K562细胞以6×108个/L的细胞数接种于含10%胎牛血清的RPMI 1640培养液,在37 ℃、5% CO2饱和湿度下常规培养,每2~3 d换液传代。
2.2 吴茱萸碱的配制取DMSO将吴茱萸碱充分溶解,配制成100 μmol/L的储备液。实验前用RPMI 1640完全培养液(含10%胎牛血清)稀释成所需浓度(DMSO终体积分数<0.1%)。
2.3 CCK-8法检测K562细胞的增殖取对数生长期的K562细胞,调整浓度为1×108个/L,接种于96孔板,每孔200 μL。设对照组:加入终体积分数0.1%的DMSO;药物组:加入终浓度为1、2、4、8、16 μmol/L的吴茱萸碱;本底对照组:加入等量培养基;每组分别设5个复孔。吴茱萸碱分别诱导24、48、72 h后,每孔加入10 μL CCK-8工作液,轻轻震荡使之混匀,于37 ℃、5% CO2饱和湿度下继续培养2 h。在450 nm波长处检测各孔吸光度(A)值,并计算细胞增殖抑制率和各时间点的半数抑制浓度(IC50),根据IC50确定药物最适作用浓度和时间,实验重复3次。
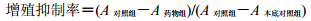
|
取对数生长期的K562细胞种植于6孔板,每孔总体积为3 mL,细胞密度为1×108/L。实验分组:对照组加入终体积分数为0.1%的DMSO;药物组分别加入终浓度为2、4、8 μmol/L的吴茱萸碱。作用K562细胞48 h后,收集各组细胞,用预冷0.01 mol/L PBS(pH 7.2)漂洗2次,75%冷乙醇4 ℃固定过夜。检测前去除固定液,加入碘化丙啶(PI)和Annexin V-FITC,于4 ℃染色处理30 min,每组样本取3×104个细胞上流式细胞仪检测。采用Cell Quest软件分析得出细胞周期各时相比例和细胞早期凋亡率。实验重复3次。
2.5 化学比色法检测K562细胞HDACs活性细胞接种及分组方法同“2.4”项,吴茱萸碱诱导6 h(作用6 h,HDACs活性已经有明显变化。)后收集细胞。预冷0.01 mol/L PBS(pH 7.2)漂洗2次,按照细胞胞浆胞核蛋白提取试剂盒说明书提取核蛋白;按照HDAC检测试剂盒说明书测定A值。实验重复3次。
2.6 Western bloting法检测K562细胞HDAC6、Cyclin D1、CDK4、Bcl-2、Bax、Cleaved Caspase-3、ERK、p-ERK、p38、p-p38蛋白表达细胞接种及分组方法同“2.4”项,吴茱萸碱诱导48 h后,收集各组细胞,预冷0.01 mol/L PBS(pH 7.2)漂洗细胞2次,RIPA全细胞蛋白液提取全细胞蛋白,BCA法检测蛋白浓度。取50 μg待测蛋白样品,进行SDS-PAGE,电转移至PVDF膜,50 g/L脱脂奶粉室温封闭2 h,分别加入1:2 000稀释的兔抗人HDAC6 mAb和1:1 000稀释的兔抗人Cyclin D1抗体、兔抗人CDK4抗体、兔抗人ERK抗体、兔抗人p-p38抗体、兔抗人Bax抗体、兔抗人Bcl-2抗体、兔抗人Cleaved Caspase-3抗体、小鼠抗人p-ERK mAb、小鼠抗人p38 mAb、小鼠抗人β-actin mAb,4 ℃孵育过夜;用TBST漂洗后,分别加入稀释度为1:1 000的辣根过氧化物酶标记的山羊抗兔IgG(H+L)和辣根过氧化物酶标记山羊抗小鼠IgG(H+L),室温孵育2 h,经TBST漂洗,最后用显色剂ECL化学发光,图像分析软件Quantity One定量分析特定条带的A值,并以目的条带与β-actin的A值的比值作为目的蛋白的相对表达水平。实验重复3次。
2.7 统计学处理使用SPSS 22.0软件进行统计分析,所有数据用表示,多组均数间比较用两因素和单因素方差分析。
3 结果 3.1 对K562细胞增殖的影响CCK-8法结果显示,给予吴茱萸碱(1~16 μmol/L)后K562细胞的增殖受到抑制,且呈剂量和时间依赖性,与对照组比较,差异显著(P<0.01)。结果见图 1,吴茱萸碱作用K562细胞24、48和72 h的IC50分别为(12.03±0.85)、(7.09±0.11)、(6.47±0.05)μmol/L。作用48 h时的IC50为(7.09±0.11)μmol/L,故选取与之接近的8 μmol/L作为后续实验浓度的阈值。
|
与对照组比较:**P<0.01,下同 **P < 0.01 vs control group, same as below 图 1 吴茱萸碱对K562细胞的增殖抑制作用(x±s, n=5) Fig.1 Effect of Evo on proliferation of K562 cells (x±s, n=5) |
3.2 对K562细胞周期及相关蛋白表达的影响
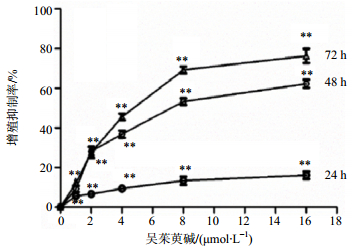
不同浓度(2、4、8 μmol/L)吴茱萸碱作用K562细胞48 h后,流式细胞仪检测结果显示,随着吴茱萸碱浓度的增加,G0/G1期细胞比例逐渐增加,分别为(39.37±1.15)%、(54.25±1.62)%、(67.77±1.43)%,与对照组(19.80±1.52)%相比,差异显著(P<0.01),见图 2。Western bloting结果显示,随着吴茱萸碱浓度的升高,与细胞周期相关的CDK4和Cyclin D1蛋白表达下调,与对照组比较,差异显著(P<0.05),见图 3。

|
图 2 吴茱萸碱对K562细胞周期的影响(xx±s, n=3) Fig.2 Effect of Evo on cell cycle of K562 cells cells(xx±s, n=3) |
|
与对照组比较:P<0.05,下同 P < 0.05 vs control group, same as below 图 3 吴茱萸碱对K562细胞CDK4和Cyclin D1蛋白表达的影响(x±s, n=3) Fig.3 Effect of Evo on CDK4 and Cyclin D1 protein expression in K562 cells (x±s, n=3) |
3.3 对K562细胞凋亡及凋亡相关蛋白表达的影响
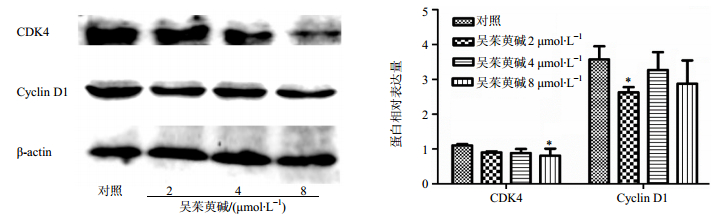
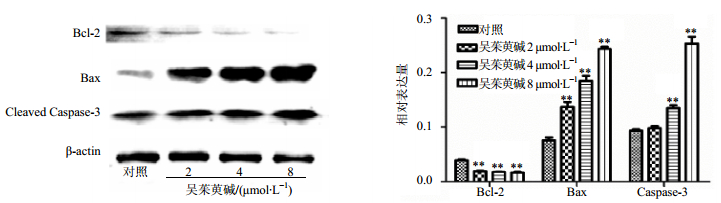
不同浓度(2、4、8 μmol/L)吴茱萸碱作用K562细胞48 h后,流式细胞仪检测结果显示,随着吴茱碱浓度的增加,K562细胞的早期凋亡率逐渐升高,其凋亡率分别为(11.47±1.05)%、(12.77±0.79)%、(18.58±1.37)%,与对照组(2.79±1.01)%相比,差异显著(P<0.01),见图 4。Western bloting结果显示,促凋亡蛋白Bax和Cleaved Caspase-3蛋白表达上调;凋亡抑制蛋白Bcl-2的表达下调,与对照组相比,差异显著(P<0.01),见图 5。
|
图 4 吴茱萸碱对K562细胞早期凋亡的影响(x±s, n=3) Fig.4 Effect of Evo on early apoptosis of K562 cells (x±s, n=3) |
|
图 5 吴茱萸碱对K562细胞Bcl-2、Bax和Cleaved Caspase-3蛋白表达的影响(x±s, n=3) Fig.5 Effect of Evo on expression of Bcl-2, Bax, and Cleaved Caspase-3 protein in K562 cells (x±s, n=3) |
3.4 对K562细胞的HDACs活性及HDAC6蛋白表达的影响
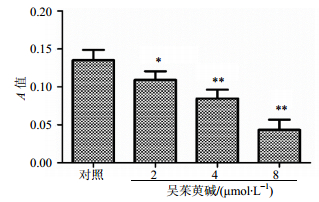
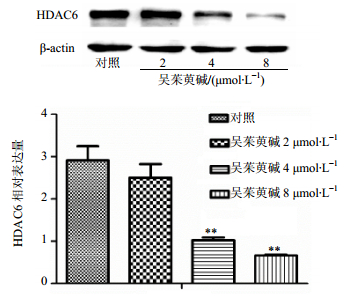
图 6结果表明,不同浓度(2、4、8 μmol/L)吴茱萸碱作用K562细胞6 h,随着吴茱萸碱浓度的增加,HDACs活性降低,与对照组相比,差异显著(P<0.05、0.01)。Western bloting结果显示,随着吴茱萸碱浓度的增加,HDAC6蛋白表达逐渐降低,与对照组相比,4、8 μmol/L吴茱萸碱组差异显著(P<0.01),2 μmol/L组没有统计学意义,见图 7。
|
图 6 吴茱萸碱对K562细胞HDACs活性的影响(x±s, n=3) Fig.6 Effect of Evo on activity of HDACs in K562 cells (x±s, n=3) |
|
图 7 吴茱萸碱对K562细胞HDAC6蛋白表达的影响(x±s, n=3) Fig.7 Effect of Evo on expression of HDAC6 protein in K562 cells (x±s, n=3) |
3.5 对K562细胞ERK、p-ERK、p38、p-p38蛋白表达的影响
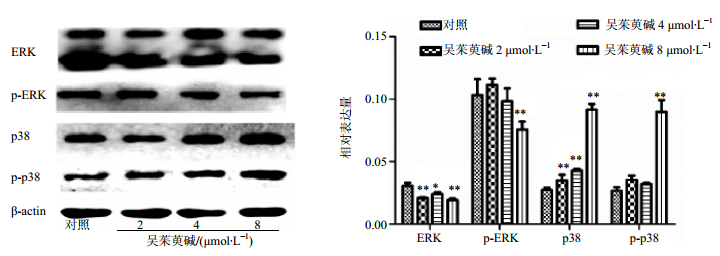
不同浓度(2、4、8 μmol/L)吴茱萸碱作用K562细胞48 h,Western bloting结果显示,随着吴茱萸碱浓度的增加,p38和p-p38表达升高,ERK和p-ERK的表达下调,与对照组相比,差异显著(P<0.05、0.01),见图 8。
|
图 8 吴茱萸碱对ERK、p-ERK、p38和p-p38蛋白表达的影响(x±s, n=3) Fig.8 Effect of Evo on expression of ERK, p-ERK, p38, and p-p38 protein in K562 cells (x±s, n=3) |
4 讨论
吴茱萸作为一种传统中药广泛应用于中医临床,其味辛、苦,性热;具有散寒止痛、降逆止呕、助阳止泻之功。吴茱萸碱是吴茱萸的主要成分,近年来众多细胞实验和动物实验均证实其有较强的抗肿瘤活性[10]。本研究采用CCK-8法检测吴茱萸碱对人白血病K562细胞增殖的影响,结果表明吴茱萸碱对人白血病K562细胞有较强的杀伤作用,能有效抑制K562细胞的增殖,且药物起效浓度低,呈时间和浓度依赖性。
细胞周期中有2个重要的调控点:G1/S和G2/M,当G1期中的正调节因子达到一定程度时,周期才能越过G1/S交界点以继续细胞周期进程,否则,细胞周期阻滞在G0/G1期[11]。Cyclin D1与CDK4在G1期互相结合成复合物,有利于细胞周期越过G1/S点,促进细胞周期进程。本研究实验结果显示,吴茱萸碱阻滞K562细胞周期于G0/G1期,同时,Cyclin D1和CDK4蛋白的表达均下调。细胞外信号调节激酶(ERK)是丝裂原激活蛋白激酶(MAPK)信号转导通路的关键分子之一,涉及细胞生长、发育及分化等多种生物学效应[12]。研究报道,ERK对细胞周期的进程具有正调节作用,用ERK阻滞剂抑制ERK的活化,可以抑制细胞周期的调控[13-14]。本研究证明,吴茱萸碱诱导K562后,ERK蛋白的表达下调,p-ERK的表达也下调,变化有统计学意义(P<0.05、0.01)。推测,吴茱萸碱是通过抑制ERK的活性阻滞K562细胞周期。
Bcl-2和Bax分别具有抑制和促进凋亡的作用,两者在细胞内以同源二聚体存在,也可以形成异源二聚体,当Bcl-2不足,Bax过量时,Bax/Bax的同源二聚体占优势,促进细胞凋亡[15]。Caspases家族是哺乳动物细胞凋亡的启动者和执行者,其中Caspase-3是Caspases级联“瀑布”下游最关键的凋亡蛋白酶。Bax蛋白作为线粒体膜上离子通道的组成成分,使细胞色素C得以穿过线粒体膜,激活Caspase-9,并进一步激活Caspase-3,导致细胞凋亡[16]。Western blotting结果显示,吴茱萸碱能抑制K562细胞Bcl-2蛋白的表达,上调促凋亡蛋白Bax的表达,同时Caspase-3被激活,说明吴茱萸碱能调控K562细胞凋亡相关蛋白,并激活Caspases家族,促进细胞凋亡。
p38 MAPK信号通路是MAPK蛋白激酶家族的主要成员之一,定位于细胞质,当受到外界刺激激活后,转位到细胞核。细胞外多种应激原都可引起细胞内蛋白激酶的连锁反应,从而影响细胞的基因转录、蛋白合成和促进细胞凋亡等生物效应[17]。目前普遍认为,p38 MAPK通过多种途径调控细胞凋亡,比如增强c-myc基因的转录水平、磷酸化p53、参与Fas/FasL介导的凋亡、激活c-jun和c-fos以及刺激Bax流入线粒体而导致细胞凋亡等。本实验研究证实,在K562中,吴茱萸碱可以激活p38,导致p38磷酸化,p38的磷酸化进一步导致细胞发生凋亡。
组蛋白乙酰化修饰是由组蛋白乙酰化酶(histone acetyltransferases,HATs)和HDACs共同调节[18]。HATs调节组蛋白乙酰化,使核小体结构松弛,增强翻译活性;HDACs调节组蛋白去乙酰化,使染色体聚集,抑制翻译[19]。组蛋白乙酰化和去乙酰化的共同作用是基因表达调控的重要推动力[20]。研究证实,HDACs的过表达可以导致肿瘤的发生发展,并且在许多肿瘤中已经发现存在HDACs的过表达[21-22]。因此,HDACs是一个潜在的肿瘤治疗靶点[2]。本研究证明,吴茱萸碱能有效抑制HDACs的活性,并下调HDAC6蛋白的表达。推测,吴茱萸碱可能是抑制白血病K562细胞中HDAC6的表达,从而发挥其抗肿瘤作用。研究发现HDAC6可参与肿瘤的一些信号通路的调控,比如Ras/MAPK信号通路,实验中发现,随着吴茱萸碱浓度的增加,p38和p-p38的表达升高,ERK和p-ERK的表达则下调,与对照组相比,其改变具有统计学意义。因此,吴茱萸碱诱导K562细胞周期阻滞和凋亡,可能通过抑制HDAC6的活性,激活MAPK信号通路,进而上调促凋亡蛋白的表达,抑制周期蛋白的表达来实现的。
综上所述,吴茱萸碱能有效抑制K562细胞的增殖,阻滞细胞周期,诱导细胞凋亡。其可能的机制是吴茱萸碱通过抑制HDAC6的表达,上调p38,最终活化Caspase-3,引起K562细胞凋亡;HDAC6表达的抑制,还可能下调ERK表达,引起细胞周期的阻滞。
| [1] | 陈敏, 孙雪梅. 中医药治疗白血病的研究进展[J]. 实用中医内科杂志 , 2011, 25 (5) :32–35. |
| [2] | 张国祥, 黄淑清, 苏标, 等. 组蛋白去乙酰化酶抑制剂抗肿瘤机制研究进展[J]. 中国现代药物应用 , 2014, 8 (13) :238–240. |
| [3] | 李晓朋, 冯子强, 石雪萍, 等. 吴茱萸碱逆转K562/Adr细胞多药耐药的实验研究[J]. 中草药 , 2016, 47 (12) :2123–2129. |
| [4] | 蔡恩照, 陈玉, 李琳洁. 中医药治疗白血病研究概况[J]. 浙江中西医结合杂志 , 2014, 24 (12) :1132–1134. |
| [5] | 张志仙, 蒋美玲, 王欣慧, 等. 吴茱萸碱的药理学研究进展[J]. 现代生物医学进展 , 2014, 21 (21) :4189–4191. |
| [6] | 刘利琼, 任伟, 谢丽, 等. 吴茱萸碱诱导肿瘤细胞凋亡的分子机制研究进展[J]. 现代肿瘤医学 , 2015, 23 (10) :1471–1474. |
| [7] | Florean C, Schnekenburger M, Grandjenette C, et al. Epigenomics of leukemia:from mechanisms to therapeutic applications[J]. Epigenomics , 2011, 3 (5) :581–609. DOI:10.2217/epi.11.73 |
| [8] | Carew J S, Giles F J, Nawrocki S T. Histone deacetylase inhibitors:Mechanisms of cell death and promise in combination cancer therapy[J]. Cancer Lett , 2008, 269 (1) :7–17. DOI:10.1016/j.canlet.2008.03.037 |
| [9] | Barneda-Zahonero B, Parra M. Histone deacetylases and cancer[J]. Mol Oncol , 2012, 6 (6) :579–589. DOI:10.1016/j.molonc.2012.07.003 |
| [10] | 张醇, 梁华平. 吴茱萸碱抗肿瘤活性研究进展[J]. 中国新药杂志 , 2010, 19 (17) :1558–1562. |
| [11] | 张丽志, 瞿全新, 温克. ERK信号转导通路对肿瘤细胞生物学行为的调控[J]. 医学综述 , 2011, 17 (6) :836–838. |
| [12] | McCubrey J A, Steelman L S, Chappell W H, et al. Mutations and deregulation of Ras/Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR cascades which alter therapy response[J]. Oncotarget , 2012, 3 (9) :954–987. DOI:10.18632/oncotarget |
| [13] | Hoshino R, Tanimura S, Watanabe K, et al. Blockade of the extracellular signal-regulated kinase pathway induces marked G1 cell cycle arrest and apoptosis in tumor cells in which the pathway is constitutively activated:up-regulation of p27(Kip1)[J]. J Biol Chem , 2001, 276 (4) :2686–2692. DOI:10.1074/jbc.M006132200 |
| [14] | Kortylewski M, Heinrich P C, Kauffmann M E, et al. Mitogen-activated protein kinases control p27/Kip1 expression and growth of human melanoma cells[J]. Biochem J , 2001, 357 (1) :297–303. DOI:10.1042/bj3570297 |
| [15] | Cory S, Huang D C, Adams J M. The Bcl-2 family:roles in cell survival and oncogenesis[J]. Oncogene , 2003, 22 (53) :8590–8607. DOI:10.1038/sj.onc.1207102 |
| [16] | Schon E A, Manfredi G. Neuronal degeneration and mitochondrial dysfunction[J]. J Clin Invest , 2003, 111 (3) :303–312. DOI:10.1172/JCI200317741 |
| [17] | 邱建武, 郭薇, 申丽娟. p38MAPK在肝细胞癌中的研究进展[J]. 世界华人消化杂志 , 2008, 16 (5) :503–509. |
| [18] | Schoofs T, Berdel W E, Müller-Tidow C. Origins of aberrant DNA methylation in acute myeloid leukemia[J]. Leukemia , 2014, 28 (1) :1–14. DOI:10.1038/leu.2013.242 |
| [19] | Angibaud P, van Emelen K, Decrane L, et al. Identification of a series of substituted 2-piperazinyl-5-pyrimidylhydroxamic acids as potent histone deacetylase inhibitors[J]. Bioorg Med Chem Lett , 2010, 20 (1) :294–298. DOI:10.1016/j.bmcl.2009.10.118 |
| [20] | Minucci S, Pelicci P G. Histone deacetylase inhibitors and the promise of epigenetic (and more) treatments for cancer[J]. Nat Rev Cancer , 2006, 6 (1) :38–51. DOI:10.1038/nrc1779 |
| [21] | Sapountzi V, Côté J. MYST-family histone acetyltransferases:beyond chromatin[J]. Cell Mol Life Sci , 2011, 68 (7) :1147–1156. DOI:10.1007/s00018-010-0599-9 |
| [22] | Witt O, Deubzer H E, Milde T, et al. HDAC family:What are the cancer relevant targets?[J]. Cancer Lett , 2009, 277 (1) :8–21. DOI:10.1016/j.canlet.2008.08.016 |
 2016, Vol. 47
2016, Vol. 47


