2. 中日友好医院 中西医结合肿瘤内科, 北京 100029
2. Oncology of Integrative Medicine, China-Japan Friendship Hospital, Beijing 100029, China
中药新药的成药性研究中,提取工艺路线是保证制剂的有效性、安全性、稳定性、经济性和GMP实施的关键,故是现代制剂工艺设计的重要内容。《中药、天然药物提取纯化研究技术指导原则》中指出,优选提取工艺路线需要参考各药味所含成分的理化性质和药理作用,并结合制剂工艺、大生产的实际和环境保护的要求[1]。而不同评价体系多个指标的权重赋予,像无形的杠杆决定结果的科学合理性。模糊层次分析法(fuzzy analysis hierarchy process,FAHP)是基于模糊数学新的研究成果提出的有效算法,通过将层次分析法(analysis hierarchy process,AHP)扩展到模糊环境中,将评价指标和评价对象划分成不同层次,对同一层次上的元素通过两两重要程度比较,组成模糊矩阵,通过计算处理得到各评价指标的权重系数[2-3],弥补了AHP[4]存在的判断一致性与矩阵一致性的差异、一致性检验困难等问题。
本研究以红花通络方(Honghua Tongluo Prescription,HTP)为模型药,探索FAHP在中药提取工艺路线优选中的应用。HTP由红花(君药)、淫羊藿(臣药)、桂枝等组成,是治疗奥沙利铂致周围神经病变(CIPN)的临床有效方[5]。该方在前期开展的中医外治CIPN的多中心、随机、对照临床研究中得到验证,其优势与特色明显,具备开发成创新中成药的条件[6]。本研究选择有效成分、出膏率、行为学、组织病理学、免疫监测作为准则层指标,两两比较重要程度,建立并转化为模糊一致矩阵,经过数学处理得到准则层权重。指标层选择羟基红花黄色素A(hydroxysafflor yellow A,HSYA)提取率、淫羊藿苷提取率,出膏率,机械性刺激痛觉超敏反应、机械性刺激痛觉过敏反应的缩足百分率,背根神经节细胞偏心核比率,足底P物质量作为评价指标,结合准则层权重,得到对于总目标的综合权重,进而通过计算加权总分优选HTP最佳提取工艺路线。
1 仪器与材料LC-10AD型高效液相色谱仪、SPD-1020A检测器,日本岛津国际贸易有限公司;Von Frey纤维丝,North Coast Medical;BZF50型真空干燥箱,上海BOXUN公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;循环水式多用真空泵,上海知信实验仪器技术有限公司;BS 110S型电子分析天平,北京赛多利斯公司;电热套,天津泰斯特仪器有限公司;自制大鼠四肢浸泡给药装置,手术剪,冻存管等。
红花、淫羊藿、桂枝等药材,北京本草方源药业有限公司,经北京中医药大学中药学院刘春生教授鉴定为合格品,其中,君药红花系菊科植物红花Carthamus tinctorius L.的干燥花,臣药淫羊藿为小檗科植物淫羊藿Epimedium brevicornu Maxim.的干燥叶,桂枝为樟科植物肉桂Cinnamomum cassia Presl的干燥嫩枝,定量测定均符合《中国药典》2015年版一部各药项下要求。
对照品淫羊藿苷(批号110737-200415,质量分数≥98%)、HSYA(批号111637-201308,质量分数96.5%),中国食品药品检定研究院;奥沙利铂,注射用,批号15080815,江苏恒瑞医药股份有限公司;乌拉坦,批号20140312,国药集团化学试剂有限公司。流动相所用甲醇、乙腈均为色谱级,赛默飞世尔(中国)科技公司;其余试剂为分析纯。SPF级Wistar大鼠,60只,雌性,体质量(210±10)g,购自北京维通利华动物公司,动物合格证号SCXK(京)2012-0001,饲养于北京中医药大学动物实验中心,饲养室保持良好通风,饲养环境温度为(25±2)℃,湿度(50±10)%,12 h循环光照。
2 方法和结果 2.1 工艺路线组设计在前期实验基础上设计各提取路线组如下:
2.1.1 工艺路线一全方水提醇沉。取全方药味,加15倍量水煎煮2次,每次1.5 h,滤过,合并滤液,浓缩至相对密度1.05~1.10(60 ℃)。加入乙醇使含醇量达60%,搅匀,冷藏24 h,滤过,回收乙醇,浓缩备用。
2.1.2 工艺路线二红花加15倍量水,60 ℃水温浸提取2 h,滤过,浓缩至适当体积。淫羊藿等其余药味水提醇沉,工艺参数同“2.1.1”项。合并红花浓缩液和淫羊藿等药味水提醇沉后的浓缩液,继续浓缩备用。
2.1.3 工艺路线三红花水温浸提取,淫羊藿等水提醇沉,工艺参数同“2.1.2”项,得到的浓缩液混合均匀,继续浓缩备用。桂枝最粗粉,加8倍量水,浸泡2 h,水蒸气蒸馏法提取5 h,收集挥发油,用时加入。挥发油收率为7 mL/kg。
2.1.4 工艺路线四红花60 ℃水温浸提取,淫羊藿等水提醇沉,工艺参数同“2.1.2”项。桂枝最粗粉,加10倍量80%乙醇回流提取,每次2 h,滤过,合并滤液,回收乙醇,浓缩至适当体积。合并以上3种浓缩液,继续浓缩备用。
2.2 药效学实验提取液制备药效学实验所用提取液按“2.1”项下各工艺路线组制法制备,浓缩至质量浓度为生药量1 g/mL,4 ℃储存,用时稀释至生药量0.105 g/mL(与临床给药质量浓度相同)。
2.3 实验动物分组雌性Wistar大鼠适应性饲养1周后,按照体质量分层,通过随机数字表随机分为空白对照组、模型组和工艺路线一、二、三、四组共6组,每组10只。
2.4 奥沙利铂致大鼠周围神经病变模型参照Homles等[7]建立的奥沙利铂致周围神经毒性大鼠标准模型,模型组和各工艺路线组大鼠腹腔注射奥沙利铂4 mg/kg,每周2次,共注射9次(分别于第1、4、8、11、15、18、22、25、29天注射)。空白对照组注射等体积5%葡萄糖溶液。
2.5 外用给药方法从第1次造模开始,各工艺路线组大鼠给予HTP提取液。取“2.2”项下药效学实验提取液,加热至35~40 ℃。用自制给药装置固定大鼠,加入药液使之刚好能浸没大鼠四肢和尾部,并浸泡30 min。给药装置底部垫有泡沫板隔热保温。每日给药2次,共计给药31 d。模型组用同样装置仅给予同样温度的去离子水。自制大鼠四肢及尾部浸泡给药装置见图 1。
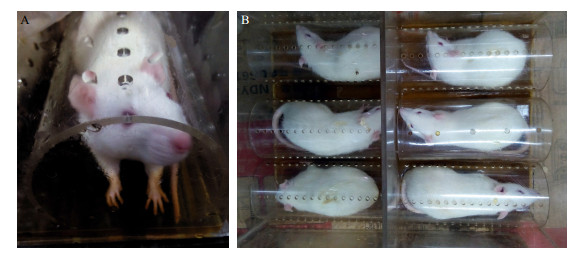
|
图 1 自制大鼠四肢(A)及尾部(B)浸泡给药装置 Fig.1 Homemade drug delivery device for immersing limbs (A) and tails (B) of rats |
2.6 各指标层评价指标 2.6.1 有效成分提取率
取一定量处方生药,按“2.1”项工艺路线组方案提取,并浓缩至200 mL。
提取率=提取液中指标成分总量/药材中指标成分总量
(1)HPLC测定HSYA提取率(记为指标A1)
HPLC色谱条件[8]:色谱柱为Merck C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-乙腈-水(26:2:72);体积流量1 mL/min;检测波长403 nm;柱温25 ℃;进样量10 μL,理论塔板数按HSYA峰计算应不低于5 000。
对照品溶液制备:取HSYA对照品适量,精密称定,加25%甲醇制成质量浓度为0.13 mg/mL的HSYA对照品溶液,摇匀,滤过,取续滤液,即得。
供试品溶液制备:分别取2 mL浓缩液于10 mL量瓶中,加25%乙醇定容至刻度,摇匀,滤过,取续滤液,即得。
各工艺路线组的HSYA提取率见表 1。
|
|
表 1 有效成分提取率和出膏率结果 Table 1 Extraction rate of active ingredients and yield of extract |
(2)HPLC测定淫羊藿苷提取率(记为指标A2)
HPLC色谱条件[9]:色谱柱为Merck C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水(24.5:75.5);体积流量1 mL/min;检测波长270 nm;柱温25 ℃,进样量10 μL;理论塔板数按淫羊藿苷峰计算应不低于5 000。
对照品溶液制备:取淫羊藿苷对照品适量,精密称定,加甲醇制成浓度为0.105 mg/mL的淫羊藿苷溶液,摇匀,滤过,取续滤液,即得。
供试品溶液制备:分别取2.5 mL浓缩液于10 mL量瓶中,无水乙醇定容至刻度,摇匀,滤过,取续滤液,即得。
各工艺路线组的淫羊藿苷提取率见表 1。
2.6.2 出膏率(记为指标B)取20 mL浓缩液于干燥至恒定质量的蒸发皿中,水浴蒸干后转到真空干燥箱中,105 ℃,常压干燥3 h。干燥器中放置0.5 h,精密称定。
各工艺路线组的出膏率见表 1。
2.6.3 行为学测试[10](记为指标C)以Von Frey纤维丝4 g模拟机械刺激痛觉超敏反应,大鼠的缩足百分率记为指标C1;以Von Frey纤维丝15 g模拟机械刺激痛觉过敏反应,大鼠的缩足百分率记为指标C2。实验于第9次注射奥沙利铂1 h后测1次行为学。将大鼠置于有透明有机玻璃罩的金属网上,15 min后,待梳理探究活动基本消失后,分别采用4、15 g Von-Frey纤维丝刺激大鼠后肢足底约1.5 s,间隔6 s再进行下1次刺激。每侧足底测5次。若大鼠被刺激时出现快速的抬足反应记为阳性反应。统计并计算缩足百分率(缩足百分率=阳性反应次数/10)。各工艺路线组的机械性刺激超敏反应和机械性过敏性反应的缩足百分率见表 2。
|
|
表 2 药效学指标结果 Table 2 Results of pharmacodynamic indexes |
2.6.4 组织病理学观察(记为指标D)
第31天大鼠给药结束后,腹腔给予20%乌拉坦麻醉,给药量为0.02 mL/g。腹主动脉取血后,取其L4~L6段背根神经节。经固定、脱水、石蜡包埋后沿纵轴连续3 μm厚进行切片。HE染色后,倒置显微镜下观察背根神经节形态,每张切片随机取2个视野,统计细胞偏心核的比率。各工艺路线组的背根神经节细胞偏心核比率见表 2。背根神经节细胞HE染色观察如图 2。黑色箭头示例为偏心核细胞。由图 2可见,对照组神经元细胞核及核仁位于细胞中央,少见多核仁、偏心核细胞。模型组可见神经元胞体缩小,核膜轮廓模糊甚至消失,偏心核比例增高。各工艺路线组神经元细胞的改变程度介于模型组与对照组之间。
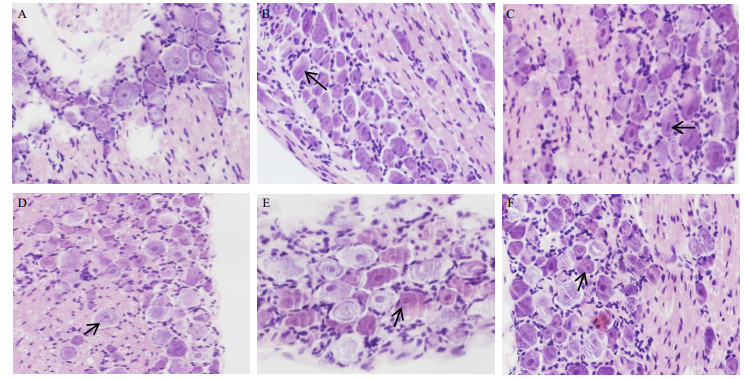
|
A-空白对照组B-模型组C-工艺路线一D-工艺路线二E-工艺路线三F-工艺路线四→-偏心核细胞 A-blank control group B-model group C-extraction routing 1 D-extraction routing 2 E-extraction routing 3 F-extraction routing 4 →-eccentric nucleus cell 图 2 背根神经节HE染色观察 Fig.2 HE staining of dorsal root ganglion of rats |
2.6.5 足底P物质测定(记为指标E)
ELISA法定量测定大鼠足底P物质(SP)的量。取材时剪下足底皮肤,加生理盐水研磨制成10%组织匀浆液。1 000×g离心20 min,取上清作为待测样品。按试剂盒中操作步骤进行:往包被抗SP抗体的微孔中依次加入SP对照品、待测样品;生物素化的抗SP抗体、HRP标记的亲和素;经过彻底洗涤后用底物TMB显色。TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的SP呈正相关。用酶标仪在450 nm波长下测定吸光度(A)值,计算样品质量浓度。各工艺路线组的大鼠足底P物质质量浓度见表 2。
2.7 数据标准化处理采用最小-最大标准化(min-max标准化)法对数据进行标准化处理,以解决数据同趋化和量纲问题。对于指标A,值越大,表明目标值越优。故新数据=(原数据-极小值)/(极大值-极小值),对于指标B、C、D、E,值越小,表明目标值越优。故新数据=1-(原数据-极小值)/(极大值-极小值)。对于药效学数据,极大值为模型组数据,极小值为空白对照组数据。标准化处理过的数据见表 3。
|
|
表 3 标准化数据 Table 3 Standard data |
2.8 FAHP为各准则层指标赋权 2.8.1 构造评价指标层次模型
根据最佳提取工艺路线筛选指标体系,将其条理化、层次化,构建目标层(一级指标,即HTP最佳提取工艺路线筛选)、准则层(二级指标,包括有效成分、杂质控制、行为学、组织病理学和免疫监测/应答)和方案层(三级指标,包括各准则层的具体检测指标:HSYA提取率、淫羊藿苷提取率、出膏率、机械性刺激痛觉超敏反应、机械性刺激痛觉过敏反应、背根神经节细胞偏心核比率和足底P物质)。
2.8.2 构造模糊互补判断矩阵采用表 4中所示0.1~0.9标度法,建立两两比较模糊互补判断矩阵,见表 5。
|
|
表 4 数量标度 Table 4 Criterion of calibrator |
|
|
表 5 模糊判断矩阵 Table 5 Fuzzy judgement matrix |
2.8.3 构造模糊一致矩阵
根据公式1、2转变为模糊一致矩阵R’=(γij)n×n,根据得到的模糊一致矩阵及公式3,计算各二级指标权重。二级指标的模糊一致矩阵和权重见表 6。
|
|
表 6 模糊一致矩阵 Table 6 Fuzzy consistent matrix |
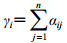
|
(1) |
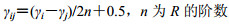
|
(2) |
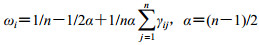
|
(3) |
由表 6可知,权重由高到低依次为免疫监测、组织病理学、有效成分和行为学、杂质控制。
2.8.4 一致性检验由模糊互补矩阵R=(rij)n×n是模糊一致矩阵的充要条件是任意指定2行的对应元素之差为常数[2],检验矩阵是否满足该条件。结果表明,对任意指定的第i行和第j行,它们对应元素之差为常数,故该矩阵为模糊一致矩阵。
2.9 三级指标权重HTP中,红花为君药,淫羊藿为臣药,故其相应有效成分HSYA占权重0.6,淫羊藿苷占权重0.4。对于指标C行为学测试,机械刺激痛觉过敏反应更有代表性,故权重为0.7,机械刺激痛觉超敏反应权重为0.3。将指标层与准测层权重相乘,得到各因素相对于总评价目标的总权重。合成权重及层次总排序见表 7。
|
|
表 7 合成权重及层次总排序 Table 7 Synthetic weight and order to levels of whole system |
2.10 各工艺路线加权总分及排序
结果见表 8。结果表明,工艺路线四为综合评价优选的最佳工艺路线,即红花60 ℃水温浸提取,淫羊藿等药味水回流提取,桂枝80%乙醇回流提取。
|
|
表 8 各工艺路线加权总分及排序 Table 8 Scores and rankings to each routing |
3 讨论 3.1 提取工艺路线设计依据
有效成分指标从已掌握的有效成分群的量入手,保证制剂的安全、有效和稳定;杂质控制保证制剂要求;而药效学评价指标更能说明物质基础的改变能否保留复方有效合理的本质。三者相结合,才能保证中医药理论指导的特色和现代制剂的要求。前期实验基础表明,淫羊藿用一定体积分数的乙醇提取,不仅淫羊藿苷的提取率低于水提,且会提取出大量的叶绿素杂质,故选择水提取。红花中水溶性有效成分HSYA对温度不稳定,在60 ℃以上提取率降低,故提取工艺路线二、三、四用水温浸(60 ℃)提取。结果表明,红花单提无论是HSYA提取率,还是药效学指标结果,都明显优于合提,从而证明提取温度对红花提取的影响,也说明君药的提取对全方作用的重要影响。文献报道桂枝的挥发油和醇提液均有镇痛作用[11],故设置2种提取路线比较不同提取方法导致的物质基础的改变对综合评价结果的影响。结果表明,桂枝醇提的综合作用最优,从而避免了水蒸气蒸馏法提取桂枝挥发油存在的提取率低,工业化困难,多只能得到芳香水,需要利用乙醚、石油醚等有机溶剂萃取等问题。
3.2 各评价指标选择依据奥沙利铂为第3代金属铂类化疗药物,目前广泛应用于大肠癌、转移性大肠癌、肺癌、胰腺癌、胃癌等肿瘤治疗,其用药后导致的CIPN的发病率可达38%~85%[12]。HTP中有效成分HSYA、淫羊藿苷具有抗氧化、减少Aβ产生、抗炎、神经营养、促进神经再生及维持突触稳定性等作用[13-14],故选取二者作为有效成分评价指标。由于CIPN的机制不明确,故没有评价药物作用效果通用、权威的指标。研究表明,痛觉超敏与痛觉过敏是神经病理性疼痛患者的两项突出症状,影响15%~50%的神经病理性疼痛患者[15],故选择机械性刺激痛觉超敏反应和过敏反应的缩足百分率作为行为学评价指标。奥沙利铂作用靶点之一为背根神经节,其致慢性周围神经毒性的重要机制之一可能是抑制了背根神经节内感觉神经元胞体核仁中rRNA合成,导致细胞出现偏心核等改变[16],故选择背根神经节细胞偏心核比率作为组织病理学评价指标。文献报道P物质与慢性神经病理学疼痛的持续状态高度相关[17],故选择足底P物质量作为免疫监测的评价指标。
3.3 FAHP相对于AHP法的改进与优势在多目标决策、多指标评价以及预测方面,权重具有引导意图和价值观念的作用。确定指标权重的方法主要分为主观定权和客观定权2类,前者包括专家评分法、成对比较法等,后者包括秩和比法、熵权法、相关系数法等[18]。AHP法是美国科学家Saaty在1970年代提出的一种定性与定量相结合的决策分析方法,通过把人的主观判断客观化、思维过程数学化,具有易操作性、实用性和系统性等优点[19],逐渐被尝试引入到医药各领域的研究中[20-22]。判断矩阵的质量高低决定着决策的科学性、合理性、可靠性。由于人的认识程度是有限的,AHP的运用中常发生逻辑判断不一致性的问题,且阶数n较大时,计算最大特征根λmax的工作量非常大,导致一致性检验困难。而FAHP法模糊判断矩阵只要满足① rii=0.5,i=1,2…,n;② rij=1-rji,i,j=1,2,…,n;③ rij=rik-rjk,i,j,k=1,2,…,n,即为模糊一致判断矩阵。在中药制剂领域内一些多层次、多指标问题的研究中,FAHP应用还较少,需要进一步探索和优化。
| [1] | 中药、天然药物提取纯化研究技术指导原则[S].2005. |
| [2] | 张吉军. 模糊层次分析法(FAHP)[J]. 模糊系统与数学 , 2000, 14 (2) :80–88. |
| [3] | 蔡宇, 余绍蕾. 基于熵权的模糊层次分析法在中药创新技术项目管理中的应用[J]. 中草药 , 2005, 36 (10) :1578–1580. |
| [4] | 贾成友, 李微, 张传辉, 等. 基于多指标权重分析和正交设计法优选白黄泄热止痢片复方提取工艺[J]. 中草药 , 2016, 47 (6) :917–922. |
| [5] | 贾立群.治疗化疗药物引起的周围神经毒性的外用中药:中国, ZL200710143569.3[P].2010-10-06. |
| [6] | 娄燕妮.中医外治化疗性周围神经病变的多中心、随机、双盲、对照临床研究[D].北京:北京中医药大学, 2013. |
| [7] | Homles J, Stanko J, Varchenko M, et al. Comparative neurotoxicity of oxaliplatin, cisplatin, and ormaplatin in a Wistar rat model[J]. Toxicol Sci , 1998, 46 (2) :342–351. |
| [8] | 中国药典[S].一部.2015. |
| [9] | 龙国友, 李开斌, 刘兴鹏, 等. HPLC法测定芪胶升白胶囊中朝藿定C和淫羊藿苷的含量[J]. 药物分析杂志 , 2015 (4) :719–722. |
| [10] | Kawashiri T, Egashira N, Watanabe H, et al. Prevention of oxaliplatin-induced mechanical allodynia and neurodegeneration by neurorotropin in the rat model[J]. Eur J Pain , 2011, 15 (4) :344–350. DOI:10.1016/j.ejpain.2010.08.006 |
| [11] | 许源, 宿树兰, 王团结, 等. 桂枝的化学成分与药理活性研究进展[J]. 中药材 , 2013, 36 (4) :674–678. |
| [12] | A Grothey. Oxali platin-safety profile:Neurotoxieity[J]. Semin Oneol , 2003, 30 :5–13. |
| [13] | 逯素梅. 羟基红花黄色素A抗谷氨酸氧化性神经损伤的保护作用[J]. 山东大学学报:医学版 , 2008, 46 (3) :232–236. |
| [14] | 南敏伦, 李世财, 赵昱玮, 等. 淫羊藿苷元制备方法及药理活性研究进展[J]. 中国实验方剂学杂志 , 2015, 21 (7) :227–231. |
| [15] | Jensen T S, Finnerup N B. Allodynia and hyperalgesia in neuropathic pain:clinical manifestations and mechanisms[J]. Lancet Neurol , 2014, 13 (9) :924–935. DOI:10.1016/S1474-4422(14)70102-4 |
| [16] | 马艺, 王娟, 王鑫, 等. 奥沙利铂对大鼠后根神经节及神经生长因子表达的影响[J]. 实用肿瘤杂志 , 2005, 20 (4) :293–296. |
| [17] | 杨敏, 祝高春, 刘曾旭. P物质及P物质受体在神经病理性疼痛中的作用研究进展[J]. 南昌大学学报(医学版) , 2013, 53 (7) :80–82. |
| [18] | 孙振球, 徐勇勇. 医学统计学[M]. 北京: 人民卫生出版社, 2014 . |
| [19] | Saaty T L. The Analytic Hierarchy Process[M]. New York: McGraw Hill, Inc, 1980 . |
| [20] | 韦余东, 张人杰, 张新卫, 等. 层次分析法在疾控机构应急能力评价指标权重确定中的应用[J]. 中国预防医学杂志 , 2015 (10) :770–773. |
| [21] | 任爱农, 卢爱玲, 田耀洲, 等. 层次分析法用于中药复方提取工艺的多指标权重研究[J]. 中国中药杂志 , 2008, 33 (4) :372–374. |
| [22] | 袁继勇, 李炜, 葛斌, 等. 基于层次分析法的中药注射剂安全性评价[J]. 兰州大学学报:医学版 , 2012, 38 (4) :23–26. |
 2016, Vol. 47
2016, Vol. 47


