翅荚决明Cassia alata L.别名翅荚黄槐、翅荚槐、蜡烛花,为豆科(Leguminosae)决明属Cassia Linn.多年生常绿灌木。其原产于美洲热带地区,广布于全世界热带地区,在我国分布于广东和云南南部[1]。该植物枝叶秀丽繁茂,花冠鲜黄色,花姿优雅美观,有较高的观赏价值,常用作园林绿化树种[2]。同时,其也是重要的药用植物,以根、叶、种子或全株入药,味淡,性寒,具有清火解毒、消肿止痛、杀虫止痒等功效[2]。人们常采其鲜叶适量捣汁来治疗神经性皮炎、牛皮癣、湿疹、皮肤瘙痒、疮疖肿疡等症,全株入药可作缓泻剂[3]。
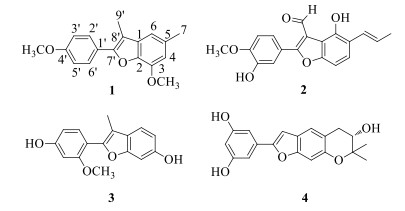
目前国内外学者对翅荚决明进行了一些研究,主要报道的化学成分有黄酮、萜、甾体、蒽醌等类化合物[4-6]。为充分利用我国丰富的资源,进一步寻找新的活性天然产物,本实验对产于西双版纳的翅荚决明细枝化学成分进行了研究,并从中分离到4个2-芳基苯并呋喃类化合物(图 1),分别鉴定为7-甲氧-2-(4-甲氧基苯基)-3, 5-二甲基苯并呋喃[7-methoxy-2-(4-methoxyphenyl)-3, 5-dimethylbenzofuran,1],桑辛素N(moracin N,2),2-(2′-甲氧基-4′-羟基苯基)-3-甲基-6-羟基苯并呋喃[2-(2′-methoxy-4′-hydroxy-aryl)-3-methy-6-hydroxybenzofuran,3],桑辛素P(moracin P,4),其中化合物1为新化合物,命名为翅荚决明素A,并且该化合物具有一定的细胞毒活性。
|
图 1 翅荚决明细枝中的2-芳基苯并呋喃类化合物 Fig.1 2-Arylbenzofuran compounds from twigs of C. alata |
1 材料与方法 1.1 仪器
UV-2401A紫外光谱仪(日本岛津公司);Bio-Rad FTS-185傅里叶变换红外光谱仪(美国伯乐BIO-RAD公司);DRX-500型核磁共振仪(瑞士布鲁克公司);岛津LC-8A型高效液相色谱仪,色谱柱为安捷伦公司Zorbax PrepHT GF(250 mm×21.2 mm,7 μm)制备柱和Zorbax C18(250 mm×9.4 mm,5 μm)半制备柱。
1.2 材料与试剂拌样时使用硅胶(80~100目)、柱色谱硅胶(200~300目)、薄层色谱硅胶板GF254(100 mm×100 mm)均为青岛海洋化工厂生产;MCI填充材料为MCI-GEL CHP-20P(75~150 μm);Sephadex LH-20(上海仁凯生物技术有限公司);薄层色谱显色剂为5% H2SO4乙醇溶液;工业用三氯甲烷、丙酮、甲醇、醋酸乙酯;色谱纯乙腈、四氢呋喃;超纯水。
翅荚决明于2013年8月购自云南西双版纳傣医院,产地为云南西双版纳洲勐腊县,经西双版纳傣医院林艳芳医师鉴定为豆科决明属植物翅荚决明Cassia alata L.。
2 提取与分离取翅荚决明的细枝4.5 kg晒干,粉碎到30目,然后用95%的乙醇-水溶液提取4次,每次用量为5.0 L,室温浸泡、超声4次(每次30 min),滤过浓缩除去乙醇,合并提取液用醋酸乙酯萃取,醋酸乙酯相减压浓缩得浸膏82.5 g。浸膏用30 g粗硅胶(80~100目)拌样,烘干,用120 g硅胶(150~200目)柱色谱分离,三氯甲烷-丙酮(9∶1、8∶2、7∶3、6∶4、5∶5、1∶2)梯度洗脱,分成6个部分。选取8∶2洗脱部分进行HPLC进一步分离:通过Zorbax PrepHT GF反相柱,以58%甲醇-水溶液为流动相洗脱,体积流量为15 mL/min,分别收集35.2、28.7、18.7、12.6 min的色谱峰可得化合物1、4、3、2粗品。所得的4个化合物粗品再次用甲醇溶解,以甲醇为流动相,用葡聚糖凝胶柱纯化,得化合物1(12.4 mg)、2(10.5 mg)、3(18.6 mg)和4(14.3 mg)。
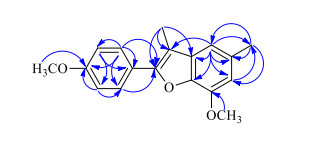
3 结构鉴定化合物1:黄色胶状物,UV λmaxMeOH(nm): 210(4.05)、270 (3.08)、312 (3.38);IR vmaxKBr(cm-1): 3 028、2 984、1618、1 476、1 428、1 380、1 158、1 061、895、784;ESI-MS m/z: 305[M+Na]+;HR-ESI-MS m/z:305.116 2 [M+Na]+(计算值305.115 4,C18H18NaO3)。HR-ESI-MS显示其准分子离子峰为305.116 2 [M+Na]+,结合1H-和13C-NMR谱确定分子式为C18H18O3,不饱和度为10。紫外光谱在210、270、312 nm有最大吸收,证实化合物中存在芳环结构。化合物的1H-、13C-NMR和DEPT数据(表 1)显示化合物中存在18个碳和18个氢,包含1个1, 2, 3, 5-四取代的苯环(C-1~6, H-4和H-6),1个1, 4-取代的苯环(C-1′~6′, H2-2′, 6′和H2-3′, 5′),2个甲基(C-7和C-9′, H3-7和H3-9′),1组双键(C-7′和C-8′)和2个甲氧基(δC 56.1和55.9 q, δH3.85和3.81 s)。根据化合物中核磁共振数据(2个苯环, C-7′~9′和H3-9′)和已知化合物3相似,可初步推测化合物1可能为3-甲基-2-芳基苯并呋喃[7]。此外,可进一步通过H3-9′和C-1、C-7′、C-8′,H2-2′,6′和C-7′,以及H-6和C-8′的HMBC相关(图 2)确认化合物1为3-甲基-2-芳基苯并呋喃。化合物的骨架得到确认后,其余的取代基团,甲基(C-7)取代在C-5位可通过H3-7和C-4、C-5、C-6,H-4和C-7,以及H-6和C-7的HMBC相关确定;2个甲基取代在C-3和C-4′位可通2个甲氧基氢(δH3.85和3.81)和C-3(δC 151.7)和C-4′ (δC160.6)的HMBC相关确认。至此化合物1的结构得到确认,并命名为翅荚决明素A。
|
|
表 1 化合物1的核磁共振数据(500/125 MHz, C5D5N) Table 1 1H-NMR and 13C-NMR data of compound 1 (500/125 MHz, C5D5N) |
|
图 2 化合物1的主要HMBC相关 Fig.2 Key HMBC (H→C) correlations of compound 1 |
化合物2:黄色粉末。1H-NMR (500MHz, DMSO-d6) δ: 6.97 (1H, s, H-3), 7.21 (1H, s, H-4), 7.04 (1H, s, H-7), 6.68 (2H, brs, H-2′, 6′), 6.22(1H, brs, H-4′), 3.27 (2H, d, J=7.0 Hz, H-1′′), 5.33 (1H, d, J=7.0 Hz, H-2′′), 1.71 (3H, s, H-4′′), 1.68 (3H, s, H-5′′);13C-NMR (125MHz, DMSO-d6) δ: 153.7 (C-2), 101.6 (C-3), 120.6 (C-3a), 120.3 (C-4), 124.6 (C-5), 153.4 (C-6), 97.0 (C-7), 153.6 (C-7a), 131.9 (C-1′), 102.2 (C-2′, 6′), 158.8 (C-3′, 5′), 102.5 (C-4′), 28.3(C-1′′), 123.2 (C-2′′), 131.3 (C-3′′), 17.7 (C-4′′), 25.6 (C-5′′)。以上数据与文献报道一致[8],故鉴定化合物2为桑辛素N。
化合物3:黄色非晶体粉末,1H-NMR (500 MHz, DMSO-d6) δ: 7.38 (1H, d, J =8.0 Hz, H-4), 6.85(1H, dd, J =2.0, 8.0 Hz, H-5), 7.11 (1H, d, J =2.0 Hz, H-7), 6.43(1H, d, J =2.0 Hz, H-3′), 6.33 (1H, dd, J =2.0, 8.0 Hz, H-5′), 7.14(1H, d, J =8.0 Hz, H-6′); 13C-NMR (125 MHz, DMSO-d6) δ:
化合物4:浅黄色无定形粉末,1H-NMR (500 MHz, CD3COCD3) δ: 7.24 (1H, brs, H-4), 6.98 (1H, brs, H-3), 6.86 (1H, s, H-7), 6.85 (2H, d, J =2.0Hz, H-2′, 6′), 6.36 (1H, t, J=2.0 Hz, H-4′), 3.82 (1H, t, J=5.6 Hz, H-9), 3.10 (1H, dd, J=16.0, 5.6 Hz, H-8), 2.80 (1H, dd, J=16.0, 5.6 Hz, H-8), 1.37 (3H, s, H-11), 1.25 (3H, s, H-12);13C-NMR (125 MHz, CD3COCD3) δ: 20.5 (C-12), 26.2 (C-11), 32.4 (C-8), 69.9 (C-9), 78.0 (C-10), 99.3 (C-7), 101.8 (C-3), 103.5 (C-4′), 103.8 (C-2′, 6′), 117.9 (C-5), 121.7 (C-4), 123.4 (C-3a), 133.3 (C-1′), 152.4 (C-6), 155.3 (C-2), 155.8 (C-7a), 159.7 (C-3′, 5′)。以上数据与文献报道一致[9],故鉴定化合物4为桑辛素P。
4 细胞毒活性对化合物1进行了细胞毒活性筛选。细胞毒活性检测参照文献方法[10],采用改良的MTT法,以紫杉醇为阳性对照药,采用5种人源肿瘤细胞株(NB4、A549、SHSY5Y、PC3和MCF7),紫杉醇的IC50值分别为0.03、0.02、0.05、0.05、0.03 μmol/L,化合物1的IC50值分别为3.6、1.5、1.2、2.9、2.2 μmol/L,结果表明化合物1对所测试的人源肿瘤细胞具有一定的细胞毒活性。
| [1] | 陈祥, 王红娟. 优良的观赏灌木——翅荚决明[J]. 南方农业 , 2010, 4 (6) :18. |
| [2] | 马洁, 张丽霞, 管艳红. 决明属5种傣药植物介绍[J]. 中国民族民间医药杂志 , 2004, 68 (3) :178–180. |
| [3] | 张丽霞, 马洁, 管艳红. 传统傣药对叶豆的栽培技术[J]. 时珍国医国药 , 2004, 15 (5) :320. |
| [4] | 李婷, 冯占民, 杨巡纭, 等. 决明属植物的化学成分及药理作用研究进展[J]. 林产化学与工业 , 2012, 32 (6) :107–118. |
| [5] | Hazni H, Ahmad N, Hitotsuyanagi Y, et al. Phytochemical constituents from Cassia alata with inhibition against methicillin-resistant Staphylococcus aureus (MRSA)[J]. Planta Med , 2008, 74 (15) :1802–1805. DOI:10.1055/s-0028-1088340 |
| [6] | Fernand V E, Dinh D T, Washington S J, et al. Determination of pharmacologically active compounds in root extracts of Cassia alata L.by use of high performance liquid chromatography[J]. Talanta , 2008, 74 (4) :896–902. DOI:10.1016/j.talanta.2007.07.033 |
| [7] | Wang Q, Ji S, Yu S W, et al. Three new phenolic compounds from the roots of Glycyrrhiza yunnanensis[J]. Fitoterapia , 2013, 85 (1) :35–40. |
| [8] | Yang Z Z, Wang Y C, Wang Y, et al. Bioassay-guided screening and isolation of α-glucosidase and tyrosinase inhibitors from leaves of Morus alba[J]. Food Chem , 2012, 131 (2) :617–625. DOI:10.1016/j.foodchem.2011.09.040 |
| [9] | 崔锡强, 陈若芸. 滇桑茎皮中化学成分的研究[J]. 中草药 , 2010, 41 (3) :352–355. |
| [10] | Hu Q F, Zhou B, Ye Y Q, et al. Cytotoxic deoxybenzoins and diphenylethylenes from Arundina Graminifolia[J]. J Nat Prod , 2013, 76 (10) :1854–1859. DOI:10.1021/np400379u |
 2016, Vol. 47
2016, Vol. 47


