2. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001
2. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China
脑缺血(cerebral ischemia)是全世界人民致死、致残的主要原因之一,并且随着年龄增长呈上升趋势[1-2],在我国和许多工业化国家致死率居高不下。近年来随着病理生理学的发展,在治疗缺血性脑卒中类疾病取得了长足的进步,但还缺乏有效的治疗手段,如重组组织型纤维蛋白酶原激活剂(rtPA)是目前唯一被美国FDA批准使用的溶栓药物[3]。脑缺血患者即便得到及时而有效的抢救,迅速恢复供血,再灌注时会造成大脑神经的二次损伤[4-5],其发病机制涉及缺血中心区和周围缺血半暗带区的去极化、脑组织能量代谢、兴奋性氨基酸毒性、自由基损伤、钙超载、炎症反应、神经细胞凋亡等多个环节[6-7]。
银杏内酯(ginkgolide)包括属于二萜内酯类的银杏内酯A、B、C、J、K、L、M(ginkgolide A、B、C、J、K、L、M)和属于倍半萜内酯的白果内酯(bilobalide)。近年来大量文献报道银杏内酯具有抗氧化、抗炎、抗血小板聚集、抗细胞凋亡及死亡、扩张血管、保护中枢神经和缺血组织等药理作用,其中以银杏内酯A、B、C、K及白果内酯效果较为明显,尤其在治疗缺血性脑卒中方面具有独特的优势。本文对银杏内酯类化合物治疗脑缺血的作用机制及潜在靶点进行综述。
1 抗自由基和氧化应激损伤在脑缺血/再灌注的情况下机体的氧化和抗氧化平衡被破坏,自由基(free radicals,FRs)异常积累,造成脂质过氧化,核酸、蛋白质、酶和脂质等结构和功能被破坏,导致神经元的损伤和脑细胞死亡。在恢复供血过程中,由于抗氧化酶相对不足,高浓度的活性氧(reactive oxygen species,ROS)进一步对中枢神经系统造成损伤。总之,细胞氧化应激被认为是缺血性脑卒中导致组织和细胞损伤最重要的原因之一[8-9]。因此清除ROS成为学者研究的重点,但是ROS的来源在缺血再灌注过程中尚不明确,临床的实验结果也不尽人意[4, 10]。Ma等[11]通过实验证明银杏内酯K(GK)可以保护过氧化氢(H2O2)诱导的PC12细胞过氧化损伤,包括维持细胞功能、降低ROS水平、抑制乳酸脱氢酶(LDH)的释放,从而在一定程度上缓解损伤。Priyanka等[12]报道白果内酯(BB)通过其抗氧化作用扭转缺氧所导致的氧化应激、炎症及线粒体损伤。
2 抗炎作用炎症是缺血性脑卒中重要的损伤机制之一[13-14],卒中发生后促炎-抗炎平衡被打破[15],坏死细胞及碎片、ROS和其他多种因素均可刺激炎症的产生,并通过上调趋化因子的表达趋化炎症细胞进入脑缺血组织,造成脑微血管阻塞和免疫细胞的浸润[16]。另一方面,卒中导致的血管通透性增加又加速了炎症细胞向血管内膜浸润,促进了炎症反应[17]。因此,抗炎在脑缺血的治疗中具有重要作用[15]。刘雪青等[18]采用高糖刺激的人脐静脉血管内皮细胞模型研究表明,银杏内酯A(GA)可通过调节白细胞介素4、6、13(IL-4、6、13)等因子的释放,降低炎症反应,通过调节STAT3介导信号通路产生抗炎作用。Liu等[19]通过氧化低密度脂蛋白(ox-LDL)诱导血管内皮细胞炎症反应,证明银杏内酯B(GB)通过抑制JAM-A、Cx43等连接蛋白表达,阻断PI3K/Akt信号通路的转导,改善内皮细胞状态,抑制炎症反应。
3 神经保护及缺血预处理作用脑缺血发生后,神经元的损伤和功能丧失可激活神经保护机制,机体通过释放保护因子、活化胶质细胞、动员白细胞到缺血组织等方式发挥神经保护作用。例如,γ-氨基丁酸(GABA)、促红细胞生成素(EPO)、IL-1α/β等因子可以与同源受体相互作用,活化细胞生存网络、抑制有害细胞信号转导,改善缺血半暗带神经元的损伤[20-22]。Kiewert等[23]研究BB对大鼠海马神经元的保护作用,表明BB可直接阻断GABAA受体,同GABAA受体拮抗剂具有协同作用。缺血预适应(ischaemic preconditioning,IP)是一种强有力的自适应防御机制,短暂的缺血损伤可诱导抑制代谢、激活细胞防御机制、神经元兴奋/抑制的平衡转化、减少炎症后遗症等,药物可通过无损伤的预适应刺激大脑,开启防御系统[24]。大量动物实验已经证明,这种缺血预适应在脑缺血发生后可有效减少大脑的急性损伤,缓解症状。Wu等[25]分别通过IP和GB预刺激ICR小鼠原代皮质神经元,证实GB和IP均可通过提高PI3K信号通路上的HIF-1、EPO和磷酸化Bad的表达,抑制缺糖/缺氧导致的细胞凋亡,从而发挥神经元保护作用。然而,由于IP和药物不可控的副作用而难以应用于临床[26-27],因此,以银杏内酯为代表的毒副作用较低的中药或天然药物,将来有望被开发成安全、有效的治疗心脑血管疾病药物[25, 28-29]。
4 抗细胞凋亡作用脑缺血的病理状态下,许多基因和蛋白可以通过线粒体通路调节细胞凋亡的进程,如Bax/Bcl-2、Caspase-3、Caspase-8、Caspase-9等,线粒体膜通透性的改变可以诱导细胞色素C的释放,最终活化Caspase-3凋亡蛋白,导致细胞凋亡和DNA Ladder的形成[11, 30]。Caspase-3在死亡受体途径和线粒体凋亡途径中扮演重要的角色,Botao等[31]发现GB可显著缓解高原脑水肿大鼠脑水肿症状、抑制Caspase-3和多聚腺嘌呤二核苷酸核糖聚合酶-1(PARP-1)表达,提示GB的保护作用可能与抑制Caspase依赖的凋亡通路有关。线粒体膜电位(mitochondrial membrane potential,MMP)和细胞色素C以及相关凋亡基因也是学者们研究的重点之一。Ma等[11]采用过氧化氢(H2O2)致PC12细胞氧化损伤模型,经过GK干预后发现细胞凋亡率、细胞色素C释放Caspase-3和Caspase-9的表达显著降低,而MMP的表达则明显升高。
5 恢复缺血区供血脑缺血发生后,常表现为血流动力学异常、脑微循环障碍、血液黏度增高及血栓形成[32]。血小板活化因子(patelet-activating factor,PAF)作为促炎信号诱导炎症的发生、发展,当脑缺血/再灌注发生后,PAF迅速合成,进而转化为促炎因子和神经毒性介质[33]。近年来大量文献报道称PAF受体拮抗剂具有良好治疗脑缺血的作用[34-36],GB是天然产物中最强的PAF受体拮抗剂之一[37-38]。Pei等[39]进一步证明GB作为PAF受体拮抗剂在治疗心肌缺血/再灌注中也具有良好的效果。马舒伟等[40]采用小鼠双侧颈总动脉结扎致急性不完全脑缺血模型,发现GK可作为PAF受体拮抗剂降低小鼠脑指数、脑含水量、组织坏死率及神经损伤率。因此,阻断PAF与受体结合可能是其治疗脑缺血的主要机制之一。血管内皮生长因子(VEGF)可促进血管生成及神经再生,正常情况下VEGF的量难以对抗缺血所引起的损伤。Shah等[41]分别给予永久性大脑中动脉栓塞(pMCAO)模型小鼠GA、GB及BB,发现上述3种成分均能有效减少小鼠脑梗死体积,而BB组小鼠脑组织中VEGF量明显高于假手术组。王军等[42]也通过实验证实GB对缺氧缺血性脑损伤(HIBD)新生大鼠脑组织VEGF mRNA的表达有上调作用,提示银杏内酯治疗脑缺血的机制可能与增加VEGF的量,改善损伤区微环境和促进脑组织修复有关。
6 抑制兴奋性毒性与能量代谢兴奋性氨基酸(EAAs)是中枢神经系统的兴奋性神经递质,其中谷氨酸是最常见且作用最强的兴奋性神经递质,广泛分布于中枢神经系统。当脑缺血发生时,大量谷氨酸被释放到细胞外液,导致神经细胞退行性病变和钙离子超载[43-44],加剧脑组织的损伤。Lang等[45]通过脑中动脉阻断法复制MCAO模型,给予银杏内酯后发现缺血核心和半暗带区域兴奋性谷氨酸的量明显减少,进一步研究表明银杏内酯可减少谷氨酸的释放,而不是通过抑制谷氨酰胺酶发挥作用。有报道称银杏内酯抑制兴奋性氨基酸产生是通过减少细胞外能量代谢,而发挥抗脑缺血的作用。缺血、缺氧使脑组织能量耗竭,细胞膜Na+, K+-ATP酶泵功能异常,同时Ca2+发生超载,促进细胞色素C、细胞凋亡诱导因子(AIF)、Caspase3的释放,引起细胞凋亡[32]。马舒伟等[46]报道GK可明显改善MCAO模型大鼠神经缺损症状,显著降低脑梗死面积及含水量,并且能够提高超氧化物歧化酶(SOD)活性、降低丙二醛(MDA)水平,以及抑制Ca2+超载。此外,研究[47]发现严重的脑缺血分为两2个阶段,第1阶段持续1~2 min,细胞外K+的浓度逐渐升高,其他离子变化不明显,第2阶段伴随着快速去极化,离子梯度丧失,释放谷氨酸和其他神经递质;相反,短暂性缺血可能导致脑组织预适应,预防以后的缺血发作[48],因此,在早期适量增加谷氨酸可以激发脑组织的预适应机制,是银杏内酯预防脑缺血的机制之一。
7 调节星形胶质细胞作用星形胶质细胞是脑中量最丰富的细胞类型[49],对维持大脑组织结构、调节神经可塑性以及在病理条件下对维持机体中枢神经系统的稳定具有重要作用[50]。在脑缺血条件下,星形胶质细胞具有抗氧化保护、营养神经和清除谷氨酸的功能[51],但星形胶质细胞的过度胶质化可形成物理屏障,干扰髓鞘和轴索的再生[48]。因此,调节星形胶质细胞状态也是治疗脑缺血的重要靶标之一。张敬各等[52]通过光化学诱导法复制局灶性脑缺血模型,观察缺血后不同时间GB对脑组织星形胶质细胞形态学改变,以及半暗区及对侧皮层神经胶质纤维酸性蛋白(GFAP)的表达情况,结果发现GB既可维持星形胶质细胞一定程度的活化状态,又可防止其过度胶质化,有利于星形胶质细胞在脑缺血时保护神经元,促进损伤神经元修复。
8 结语与展望缺血性脑卒中发生后涉及炎症、氧化应激、血栓形成、细胞凋亡、兴奋性毒性等多个方面(图 1)[8, 16, 20, 24, 30, 33, 43-44, 53-56],每个环节又相互影响,机制十分复杂,也给患者的治疗及恢复带了极大的困难,本文对银杏内酯类化合物治疗脑缺血的机制进行了综述,初步明确了脑缺血发生机制及银杏内酯类化合物作用的靶点,为深入研究银杏内酯类药物治疗脑缺血/再灌注奠定了基础。
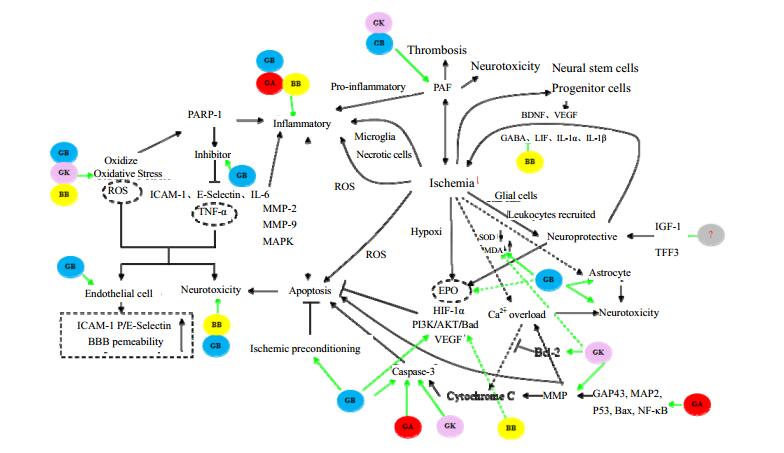
|
图 1 银杏内酯治疗脑缺血相关机制及作用靶点网络图 Fig.1 Mechanism and targets of ginkgolides for cerebral ischemia treatment |
脑缺血的根本机制和最终结局都是脑组织缺血、缺氧,临床常用药物均有着不同的疗效及靶点,但不良反应、再灌注后的氧化损伤、价格昂贵等因素仍然成为限制药物发挥疗效的主要原因,对梗死区域造成的终身损伤依然无法逆转,银杏内酯类药物在治疗脑缺血及挽救缺血半暗带的过程中存在着多靶点、疗效显著等优势,具有良好的开发前景,因此以下几个方面将成为研究重点:(1)银杏提取物中含有少量银杏酸,是导致不良反应的主要原因,能否通过精密提取、吸附、配伍等方法降低银杏酸的量从而优化银杏提取物制剂,减轻毒副作用;(2)GC、GJ、GK、GL、GM在国内外的研究报道较少,GA、GB、GK及BB单独使用均有良好的抗脑缺血作用,然而银杏内酯、银杏二萜内酯及提取物等上市制剂在上述各靶点作用比较并不明确,是否具有协同作用也不得而知;(3)目前研究多围绕PI3K/AKT/Bad、核因子-κB(NF-κB)等信号通路进行,一些潜在作用靶点如受到损伤后肝肾分泌的胰岛素样生长因子(IGF-1)、三叶因子3(TFF3)等因子以及前列腺素受体研究鲜有报道,也有望成为未来的工作重点。
| [1] | Donnan G A, Fisher M, Macleod M, et al. Stroke[J]. Lancet , 2008, 371 (9624) :1612–1623. DOI:10.1016/S0140-6736(08)60694-7 |
| [2] | Simerabet M, Robin E, Aristi I, et al. Preconditioning by an in situ administration of hydrogen peroxide: involvement of reactive oxygen species and mitochondrial ATP-dependent potassium channel in a cerebral ischemia-reperfusion model[J]. Brain Res , 2008, 1240 (2) :177–184. |
| [3] | Ying W H, Xiong Z G. Oxidative stress and NAD+ in ischemic brain injury: Current advances and future perspectives[J]. Curr Med Chem , 2010, 17 (20) :2152–2158. DOI:10.2174/092986710791299911 |
| [4] | Dong Y H, Wang H X, Chen Z F. Alpha-lipoic acid attenuates cerebral ischemia and reperfusion injury via insulin receptor and PI3K/Akt-dependent inhibition of NADPH oxidase[J]. Int J Endocrinol , 2015, 2015 :13. |
| [5] | Cohen J E, Leker R R. Intravenous thrombolytic therapy for acute ischemic stroke[J]. New England J Med , 2011, 365 (10) :964–965. DOI:10.1056/NEJMc1108289 |
| [6] | 陈东, 赵贵德, 考宏盛. 缺血性脑卒中发病机制研究新进展[J]. 国外医学:神经病学神经外科学分册 , 2001, 28 (1) :32–34. |
| [7] | 刘抒雯, 刘敬霞, 虎喜成, 等. 三七总皂苷治疗缺血性脑卒中研究进展[J]. 中国实验方剂学杂志 , 2015, 21 (15) :217–220. |
| [8] | Cassarino D S, Bennett J P. An evaluation of the role of mitochondria in neurodegenerative disease: mitochondrial mutations and oxidative pathology, protective nuclear responses, and cell death in neurodegeneration[J]. Brain Res Rev , 1999, 29 (1) :1–25. DOI:10.1016/S0165-0173(98)00046-0 |
| [9] | Finkel T, Holbrook N J. Oxidants, oxidative stress and the biology of ageing[J]. Nature , 2000, 408 (6809) :239–247. DOI:10.1038/35041687 |
| [10] | Silachev D N, Plotnikov E Y, Zorova L D, et al. Neuroprotective effects of mitochondria-targeted plastoquinone and thymoquinone in a rat model of brain ischemia/reperfusion injury[J]. Molecules , 2015, 20 (8) :14487–14503. DOI:10.3390/molecules200814487 |
| [11] | Ma S W, Liu X Y, Xun Q R, et al. Neuroprotective effect of ginkgolide K against H2O2-induced PC12 cell cytotoxicity by ameliorating mitochondrial dysfunction and oxidative stress[J]. Biol Pharm Bull , 2014, 37 (2) :217–225. DOI:10.1248/bpb.b13-00378 |
| [12] | Priyanka A, Nisha V M, Anusree S S, et al. Bilobalide attenuates hypoxia induced oxidative stress, inflammation, and mitochondrial dysfunctions in 3T3-L1 adipocytes via its antioxidant potential[J]. Free Radical Res , 2014, 48 (10) :1206–1217. DOI:10.3109/10715762.2014.945442 |
| [13] | Becker K J. Inflammation and acute stroke[J]. Curr Opin Neurol , 1998, 11 (1) :45–49. DOI:10.1097/00019052-199802000-00008 |
| [14] | Stanimirovic D B, Wong J, Shapiro A, et al. Increase in surface expression of ICAM-1, VCAM-1 and E-selectin in human cerebromicrovascular endothelial cells subjected to ischemia-like insults[J]. Acta Neurochir Suppl , 1997, 70 :12–16. |
| [15] | Jin R, Liu L, Zhang S H, et al. Role of inflammation and its mediators in acute ischemic stroke[J]. J Cardiovasc Transl Res , 2013, 6 (5) :1–31. |
| [16] | Kim J Y, Kawabori M, Yenari M A. Innate inflammatory responses in stroke: mechanisms and potential therapeutic targets[J]. Curr Med Chem , 2014, 21 (18) :2076–2097. DOI:10.2174/0929867321666131228205146 |
| [17] | Zhao Q, Gao C, Cui Z. Ginkgolide A reduces inflammatory response in high-glucose-stimulated human umbilical vein endothelial cells through STAT3-mediated pathway[J]. Int Immunopharmacol , 2015, 25 (2) :242–248. DOI:10.1016/j.intimp.2015.02.001 |
| [18] | 刘雪青, 陈北冬, 鲍利, 等. 银杏内酯B对内皮细胞连接蛋白的影响及其分子机制研究[J]. 中国药理学通报 , 2014, 30 (5) :646–651. |
| [19] | Liu X, Sun W, Zhao Y, et al. Ginkgolide B inhibits JAM-A, Cx43, and VE-cadherin expression and reduces monocyte transmigration in oxidized LDL-stimulated human umbilical vein endothelial cells[J]. Oxidative Med Cell Longevity , 2015 . DOI:10.1155/2015/907926 |
| [20] | Liu S Q, Roberts D, Zhang B, et al. Trefoil factor 3 as an endocrine neuroprotective factor from the liver in experimental cerebral ischemia/reperfusion injury[J]. PLoS One , 2013, 8 (10) :e77732. DOI:10.1371/journal.pone.0077732 |
| [21] | Bhuiyan M I, Kim Y J. Mechanisms and prospects of ischemic tolerance induced by cerebral preconditioning[J]. Int Neurourol J , 2010, 14 (4) :203–212. DOI:10.5213/inj.2010.14.4.203 |
| [22] | Dirnagl U, Simon R P, Hallenbeck J M. Ischemic tolerance and endogenous neuroprotection[J]. Trends Neurosci , 2003, 26 (5) :248–254. DOI:10.1016/S0166-2236(03)00071-7 |
| [23] | Kiewert C, Kumar V, Hildmann O. Role of GABAergic antagonism in the neuroprotective effects of bilobalide[J]. Brain Res , 2007, 1128 (1) :70–78. |
| [24] | Jeffrey M. Gidday pharmacologic preconditioning: translating the promise[J]. Transl Stroke Res , 2010, 1 (1) :19–30. DOI:10.1007/s12975-010-0011-y |
| [25] | Wu X, Qian Z, Ke Y. Ginkgolide B preconditioning protects neurons against ischaemia-induced apoptosis[J]. J Cell Mol Med , 2009, 13 (11/12) :4474–4483. |
| [26] | Zhao H, Ren C, Chen X, et al. From rapid to delayed and remote postconditioning: the evolving concept of ischemic postconditioning in brain ischemia[J]. Curr Drug Targets , 2012, 13 (2) :173–187. DOI:10.2174/138945012799201621 |
| [27] | Freiberger J J, Suliman H B, Sheng H, et al. A comparison of hyperbaric oxygen versus hypoxic cerebral preconditioning in neonatal rats[J]. Brain Res , 2006, 1075 :213–222. DOI:10.1016/j.brainres.2005.12.088 |
| [28] | Nada S E, Shah Z A. Preconditioning with Ginkgo biloba (EGb 761®) provides neuroprotection through HO1 and CRMP2[J]. Neurobiol Dis , 2012, 46 (1) :180–189. DOI:10.1016/j.nbd.2012.01.006 |
| [29] | 赵瑛, 张季, 金成. 御风胶囊对脑缺血-再灌注损伤大鼠的预防性神经保护作用[J]. 中草药 , 2004, 35 (5) :548–551. |
| [30] | Jang J H, Surh Y J. Bcl-2 protects against Abeta (25-35)-induced oxidative PC12 cell death by potentiation of antioxidant capacity[J]. Biochem Biophys Res , 2004, 320 :880–886. DOI:10.1016/j.bbrc.2004.06.035 |
| [31] | Botao Y, Ma J, Xiao W, et al. Protective effect of ginkgolide B on high altitude cerebral edema of rats[J]. High Alt Med Biol , 2013, 14 (1) :61–64. DOI:10.1089/ham.2012.1080 |
| [32] | 蒋文潇, 王保和. 银杏内酯对缺血性脑血管疾病的药理研究进展[J]. 辽宁中医杂志 , 2015, 42 (2) :441–444. |
| [33] | Chen C, Bazan N G. Lipid signaling: sleep, synaptic plasticity, and neuroprotection[J]. Prostaglandins Other Lipid Mediat , 2005, 77 (1/4) :65–76. |
| [34] | Belayev L, Khoutorova L, Atkins K. LAU-0901, a novel platelet-activating factor antagonist, is highly neuroprotective in cerebral ischemia[J]. Exp Neurol , 2008, 214 (2) :253–258. DOI:10.1016/j.expneurol.2008.08.009 |
| [35] | Belayev L, Khoutorova L, Atkins K, et al. LAU-0901, a novel platelet-activating factor receptor antagonist, confers enduring neuroprotection in experimental focal cerebral ischemia in the rat[J]. Brain Res , 2009, 1253 (50) :184–190. |
| [36] | Belayev L, Eady T N, Khoutorova L., et al. Superior neuroprotective efficacy of LAU-0901, a novel platelet-activating factor antagonist, in experimental stroke[J]. Transl Stroke Res , 2012, 3 (1) :154–163. DOI:10.1007/s12975-011-0116-y |
| [37] | Waller A K, Sage T, Kumar C, et al. Staphylococcus aureus lipoteichoic acid inhibits platelet activation and thrombus formation via the Paf receptor[J]. J Infect Dis , 2013, 208 (12) :2046–2057. DOI:10.1093/infdis/jit398 |
| [38] | Vogensen S B, Strømgaard K, Shindou H, et al. Preparation of 7-substituted ginkgolide derivatives: potent platelet activating factor (PAF) receptor antagonists[J]. J Med Chem , 2003, 46 (4) :601–608. DOI:10.1021/jm0203985 |
| [39] | Pei H X, Hua R, Guan C X, et al. Ginkgolide B reduces the degradation of membrane phospholipids to prevent ischemia/reperfusion myocardial injury in rats[J]. Pharmacology , 2015, 96 (5/6) :233–239. |
| [40] | 马舒伟, 陈旅翼, 何盛江, 等. 银杏内酯K对脑缺血的保护作用[J]. 中国现代应用药学 , 2011, 28 (10) :877–880. |
| [41] | Shah Z A, Nada S E, Doré S. Heme oxygenase1, beneficial role in permanent ischemic stroke and in Gingko biloba (EGb761) neuroprotection[J]. Neuroscience , 2011, 180 :248–55. DOI:10.1016/j.neuroscience.2011.02.031 |
| [42] | 王军, 尚凤伟, 朱登纳, 等. 银杏内酯B对缺氧缺血性脑损伤新生大鼠脑组织Caspase-3及VEGF mRNA表达的影响[J]. 郑州大学学报:医学版 , 2013, 48 (2) :175–177. |
| [43] | Szydlowska K, Tymianski M. Calcium, ischemia and excitotoxicity[J]. Cell Calcium , 2010, 47 (2) :122–129. DOI:10.1016/j.ceca.2010.01.003 |
| [44] | Gao H J, Liu P F, Li P W, et al. Ligustrazine monomer against cerebral ischemia/reperfusion injury[J]. Neural Regen Res , 2015, 10 (5) :832–840. DOI:10.4103/1673-5374.156991 |
| [45] | Lang D, Kiewert C, Mdzinarishvili A, et al. Neuroprotective effects of bilobalide are accompanied by a reduction of ischemia-induced glutamate release in vivo[J]. Brain Res , 2011, 1425 (33) :155–163. |
| [46] | 马舒伟, 张现涛, 何盛江, 等. 银杏叶内酯K对大鼠脑缺血再灌注损伤的保护作用[J]. 中国药学杂志 , 2011, 46 (13) :993–997. |
| [47] | Andrade A L, Rossi D J. Simulated ischaemia induces Ca2+-independent glutamatergic vesicle release through actin filament depolymerization in area CA1 of the hippocampus[J]. J Physiol , 2010, 588 (9) :1499–1514. DOI:10.1113/jphysiol.2010.187609 |
| [48] | Rossi D J, Brady J D, Mohr C. Astrocyte metabolism and signalling during brain ischemia[J]. Nat Neurosci , 2007, 10 (11) :1377–1386. DOI:10.1038/nn2004 |
| [49] | Sofroniew M V, Vinters H V. Astrocytes: biology and pathology[J]. Acta Neuropathol , 2010, 119 (1) :7–35. DOI:10.1007/s00401-009-0619-8 |
| [50] | Barreto G, White R E, Ouyang Y B, et al. Astrocytes: Targets for neuroprotection in stroke[J]. Cent Nerv Syst Agents Med Chem , 2011, 11 (2) :164–173. DOI:10.2174/187152411796011303 |
| [51] | Bovolenta P, Wandosell F, Nieto-Sampedro M. CNS glialscar tissue: A source of molecules which inhibit central neutriteout growth[J]. Prog Brain Res , 1992, 94 (2) :367–379. |
| [52] | 张敬各, 李树清, 王树人, 等. 银杏内酯B对局灶性脑缺血时星形胶质细胞GFAP表达的影响[J]. 四川大学学报 , 2007, 38 (2) :284–286. |
| [53] | Truettner J, Busto R, Zhao W, et al. Effect of ischemic preconditioning on the expression of putative neuroprotective genes in the rat brain[J]. Brain Res Mol Brain Res , 2002, 103 (1/2) :106–15. |
| [54] | 刘永刚, 李芳君, 王婧, 等. 银杏内酯B对大鼠脑缺血-再灌注损伤炎症反应的影响[J]. 中药材 , 2010, 33 (4) :578–580. |
| [55] | Nabavi S M, Habtemariam S, Daglia M, et al. Neuroprotective effects of ginkgolide B against ischemic stroke: A review of current literature[J]. Curr Topics Med Chem , 2015, 15 (21) :2222–2232. DOI:10.2174/1568026615666150610142647 |
| [56] | Gu J H, Ge J B, Li M, et al. Inhibition of NF-kappaB activation is associated with anti-inflammatory and anti-apoptotic effects of ginkgolide B in a mouse model of cerebral ischemia/reperfusion injury[J]. Eur J Pharm Sci , 2012, 47 (4) :652–660. DOI:10.1016/j.ejps.2012.07.016 |
 2016, Vol. 47
2016, Vol. 47


