2. 大理大学药学与化学学院, 大理 671000 ;
3. 重庆市食品药品检验所 重庆市药物过程与质量控制工程技术研究中心, 重庆 401121
2. College of Pharmacy and Chemistry, Dali University, Dali 671000, China ;
3. Chongqing Engineering Research Center for Pharmaceutical Process and Quality Control, Chongqing Institute for Food and Drug Control, Chongqing 401121, China
重楼属Paris L.隶属于百合科多年生草本植物,全世界24种,中国19种,以西南各省区居多,其中,三峡库区有6种9变种,是重楼属药用植物的地理分布中心之一,药材品种丰富[1-2]。据调查,三峡库区为重楼属药用植物的药材主产区,除《中国药典》收载的品种外,市场上有多种重楼属药用植物流通和使用[3]。现代研究表明,重楼具有抗肿瘤、抗病毒、免疫调节、止血、镇痛、抗菌、抗炎等生物活性[4]。
核苷类物质是生物机体细胞维持生命活动的基本组成元素,具有抗肿瘤、抗病毒、免疫调节、抗缺血性损伤、抗菌、抗血小板聚集等多种生物活性[5-7],与重楼的生物活性具有一定关联性,可作为重楼药材的质量评价指标之一。
随着重楼需求量的增加,野生资源蕴藏量急剧减少,现已列为二级濒危药用植物之一[8]。商品药材依靠栽培生产提供为解决市场供需矛盾、实现重楼的有效保护和可持续利用的唯一途径[9]。为此,本课题组深入三峡库区的主要栽培区考察重楼资源状况,实地采集重楼属药用植物,鉴定品种,比较各种重楼所含核苷和碱基类成分的差异性和同一性,评价产地及品种因素对重楼属药用植物质量的影响,为更好探讨重楼药效物质基础提供依据。
1 仪器与试药LC-20AT型高效液相色谱仪(日本岛津集团);DZF-6050MBE型电热恒温真空干燥箱(上海博讯实业有限公司);SB-5200DTN型超声波清洗机(宁波新芝生物科技股份有限公司,功率300 W,频率40 kHz);TDZ5-WS型多管架自动平衡离心机(湖南赛特湘仪离心机仪器有限公司);CP225D型分析天平(德国Sartorius公司)。
尿嘧啶(批号100469-200401)、鸟嘌呤(批号140631-201205)、尿苷(批号110887-200202)、腺嘌呤(批号886-200001)、肌苷(批号140669-200903)、胸苷(批号101215-201401)和腺苷(批号110879-200202)对照品购自中国食品药品检定研究院;对照品胞苷、鸟苷、2′-脱氧腺苷均购自南京都莱生物技术有限公司,质量分数经HPLC峰面积归一化法计算均大于98%。
重楼新鲜根茎采集于重庆市开县满月乡等地,每份样品均取自10株成熟植株根茎以保证样品代表性,由中国科学院昆明植物研究所李恒研究员鉴定(表 1)。色谱纯甲醇为德国默克公司,其他试剂均为分析纯,水为娃哈哈牌纯净水。
|
|
表 1 重楼样品来源 Table 1 Sources of samples inParisL. |
2 方法与结果 2.1 色谱条件
色谱柱:Venusil MP C18(2)柱(250 mm×4.6 mm,5μm);流动相为甲醇(A)-水(B),梯度洗脱,0~10 min,1%~5% A;10~15 min,5%~15% A;15~20 min,15%~20% A;20~30 min,20%~30% A;检测波长260 nm;体积流量1.0 mL/min;进样量20μL;柱温35℃。按照上述色谱条件进行分析,各成分分离度良好,对照品和药材色谱图见图 1。
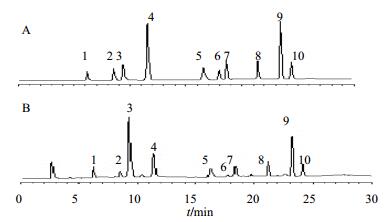
|
图 1 混合对照品(A)及S8号样品(B)的HPLC图谱 Fig.1 HPLC of mixed reference substances (A) and S8 Sample (B) |
2.2 对照品溶液的制备
分别精密称取减压干燥至恒定质量的尿嘧啶、胞苷、鸟嘌呤、尿苷、腺嘌呤、肌苷、鸟苷、胸苷、腺苷、2′-脱氧腺苷对照品适量,加纯净水溶解并制成质量浓度分别为1 039.0、1 040.4、992.4、1 057.2、618.0、1 061.0、486.0、1 080.0、1 040.4、1 020.8μg/mL的对照品贮备液。取各对照品贮备液适量,加纯净水定容至50 mL制成混合对照品溶液,各对照品质量浓度分别为10.390 0、52.020 0、36.718 8、158.580 0、46.350 0、15.915 0、28.431 0、172.800 0、93.636 0、91.872 0μg/mL。并逐级稀释,得到一系列不同质量浓度的10种混合对照品溶液,置于4℃的冰箱内,临用前以0.22μm微孔滤膜滤过,供分析用。
2.3 供试品溶液的制备精密称取重楼粉末(过50目筛)1.0 g,置50 mL具塞锥形瓶中,精密加纯净水10 mL,称定质量,混匀,密封,室温下超声提取15 min(超声功率300 W,工作频率40 kHz),取出,放至室温,用纯净水补足减失质量,倒入离心管中,4 000 r/min离心10 min,取上清液以0.22μm微孔滤膜滤过,即得。
2.4 线性关系的考察精密吸取“2.2”项下的不同质量浓度的系列混合对照品溶液各20μL,在“2.1”项下色谱条件下测定,以对照品的峰面积(Y)对相应的质量浓度(X)进行线性回归,得回归方程和线性范围:尿嘧啶Y=91 737 X-6 198.3,r2=0.999 3,线性范围0.519 5~10.390 0μg/mL;胞苷Y=38 337 X-2 577,r2=0.999 8,线性范围2.601 0~52.020 0μg/mL;鸟嘌呤Y=5 608.1 X-1 019.1,r2=0.999 9,线性范围1.835 9~36.718 8μg/mL;尿苷Y=51 423 X+24 962,r2=0.999 3,线性范围7.929 0~158.580 0μg/mL;腺嘌呤Y=108 249 X+4 140.6,r2=0.999 4,线性范围2.317 5~46.350 0μg/mL;肌苷Y=14 466 X+2 267.7,r2=0.999 6,线性范围0.795 8~15.915 0μg/mL;鸟苷Y=73 426 X+9 797.7,r2=0.999 1,线性范围1.421 6~28.431 0μg/mL;胸苷Y=43 699 X+15 039,r2=0. 999 7,线性范围8.640 0~172.800 0μg/mL;腺苷Y=78 096 X-12 577,r2=0.999 1,线性范围4.681 8~93.636 0μg/mL;2′-脱氧腺苷Y=67 858 X+15 905,r2=0.999 9,线性范围4.593 6~91.872 0μg/mL。
2.5 精密度试验精密吸取混合对照品溶液20μL,连续进样6次。结果尿嘧啶、胞苷、鸟嘌呤、尿苷、腺嘌呤、肌苷、鸟苷、胸苷、腺苷、2′-脱氧腺苷峰面积的RSD分别为0.12%、0.19%、0.07%、0.07%、0.74%、0.66 %、0.62%、0.11%、0.08%、0.12%,表明本方法精密度良好。
2.6 重复性试验取同一重楼样品(S8)6份,每份1.0 g,精密称定,依“2.3”项下方法平行制备供试品溶液,依“2.1”项下色谱条件进行分析,记录其色谱峰面积。结果尿嘧啶、胞苷、鸟嘌呤、尿苷、腺嘌呤、肌苷、鸟苷、胸苷、腺苷、2′-脱氧腺苷质量分数的RSD分别是1.64%、1.06%、1.74%、2.73%、2.22%、2.37 %、2.89%、2.45%、1.61%、1.40%,表明样品制备方法重复性良好。
2.7 稳定性试验将制成的供试品溶液(S8)在室温条件下密闭放置,分别在0、2、4、8、12、16 h进样,记录其色谱峰面积。结果尿嘧啶、胞苷、鸟嘌呤、尿苷、腺嘌呤、肌苷、鸟苷、胸苷、腺苷、2′-脱氧腺苷峰面积的RSD分别是1.38%、2.21%、2.37%、2.36%、2.89%、1.22%、0.61%、2.87%、1.51%、1.30%,表明样品样品溶液16 h内稳定性良好。
2.8 加样回收率试验取已测定的重楼样品(S8)6份,每份约0.5 g,精密称定,分别依次加入“2.2”项下的对照品贮备液适量,按“2.3”项下方法制备加样回收率的供试品溶液,在“2.1”项下色谱条件下进样,计算各成分的加样回收率和RSD,结果尿嘧啶、胞苷、鸟嘌呤、尿苷、腺嘌呤、肌苷、鸟苷、胸苷、腺苷、2′-脱氧腺苷平均回收率97.50%、97.57%、104.34%、96.04%、97.18%、97.17%、99.21%、97.26%、99.32%、98.92%,RSD分别为2.04%、1.34%、2.94%、1.21%、1.73%、1.20 %、2.50%、1.36%、1.73%、2.63%。
2.9 样品的测定取16批重楼药材粉末,按“2.3”项下方法各制备3份供试品溶液,在“2.1”项下色谱条件下进样,进行峰面积测定,标准曲线法计算重楼药材中10种成分的量,结果见表 2。
|
|
表 2 不同产地重楼中10种成分的量(n=3) Table 2 The content of 10 analytes in Paris sample from different location (n=3) |
测定结果表明,不同产地、不同品种重楼药材均含有10个核苷及碱基类成分,表明10种重楼属药用植物中核苷和碱基类成分较为相似。其中,尿苷、鸟苷、胸苷、腺苷和2′-脱氧腺苷量相对较高,胞苷、鸟嘌呤、腺嘌呤和肌苷量次之,而尿嘧啶量较低,说明从质量分数上看尿苷、鸟苷、胸苷、腺苷和2′-脱氧腺苷为主要核苷和碱基类成分。
2.10 聚类分析分别对16批重楼属药用植物的测定结果进行聚类分析。以表 2中重楼药材中10种核苷和碱基量为依据,利用SPSS19.0版本软件欧式距离平方(squared Euclidean distance)计算样品间的相似系数,并用离差平方和法(Ward法)进行系统聚类。结果见图 2。由图 2可见,当分类距离为15时,可将16批重楼药材分为3类:第1类有9批药材,即S2、S3、S5~S7、S9~S11、S14,此类样品中10种核苷及碱基量均较低,均低于平均值;第2类有5批药材,即S1、S4、S8、S13、S16,此类药材中10种被测成分各质量分数较均衡,与平均值无较大差异;第3类有2批药材,即S12、S15,此类药材中10种被测成分总量较高,尤其尿嘧啶、胞苷、鸟嘌呤、尿苷、腺嘌呤量均远高于其他样品,这5个成分几乎是其他样品的2倍。
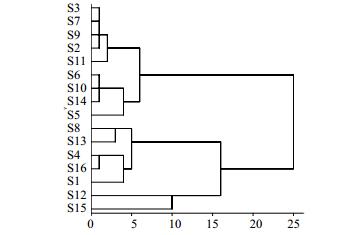
|
图 2 16批重楼药材聚类分析树状图 Fig.2 Dendrogram of 16 batches of samples in Paris L. |
3 讨论 3.1 提取条件的选择与优化
本实验考察了回流提取法和超声提取法2种方法,结果显示超声提取法明显高于回流提取法,故选择超声提取法。由于分析物的高极性,故采用不同体积比的甲醇水溶液进行提取溶剂效率的优化。结果显示以纯净水为提取溶剂时的提取液出峰多、目标化合物量高。另外,本实验还对提取时间、提取次数和提取溶剂用量分别进行了考察,最终确定了“2.3”项中的方法。此法步骤简单,易操作,误差小,更能真实地反映出重楼药材中核苷和碱基类成分的量。
3.2 色谱条件的选择与优化核苷和碱基类化合物极性大,较难分离,本实验比较了以下4种色谱柱Innoval AQ C18柱(250 mm×4.6 mm,5μm),Venusil XBP C18(L)柱(250 mm×4.6 mm,5μm),Durashell C18柱(250 mm×4.6 mm,5μm)和Venusil MP C18(2)柱(250 mm×4.6 mm,5μm)。实验结果表明,Venusil MP C18(2)柱(250 mm×4.6 mm,5μm)对10种核苷和碱基类成分达到了良好的分离,第2~3种色谱柱不能很好的分离10种核苷和碱基类成分,而第1种色谱柱峰形较差。同时比较了不同的流动相组成如乙腈-水、甲醇-水、乙腈-甲酸水溶液和甲醇-甲酸水溶液,结果显示甲醇-水做流动相时分析物的分离效果较好,因此最终选择了Venusil MP C18(2)柱(250 mm×4.6 mm,5μm)和甲醇-水系统梯度洗脱。
3.3 结果分析不同栽培品种重楼药材中核苷和碱基类成分总量具有显著差别,相差近2倍。各核苷和碱基总量平均值高低排列顺序为巴山重楼(S12)>长药隔重楼(S15)>卵叶重楼(S13)>五指莲重楼(S16)>狭叶重楼(S8~S9)>华重楼(S1~S3)>滇重楼(S4~S7)>花叶重楼(S14)>小重楼(S10)>毛重楼(S11)。同时,不同产地、不同品种重楼药材中10种核苷和碱基类成分量及组成结构比存在着较大差异,与杨德全等[10]和付绍智等[11]对重楼属药用植物中甾体皂苷的报道类似,非药典品种(巴山重楼、长药隔重楼等)中核苷类量甚至超过药典品种(滇重楼、华重楼),进一步表明重楼属药用植物具有一定的化学等同性,在民间代用重楼具有一定的科学性,但药效的差异性有待进一步研究。
同一栽培品种在不同栽培地区的重楼药材,各核苷类成分及总核苷的量亦不相同。其中以重庆市开县(S4)与其他栽培区域滇重楼中10种核苷和碱基量相差近2倍,而2个不同栽培区域的狭叶重楼量相差甚微,表现出一定的地域及生境依赖性。但来源于同一栽培区域不同种植基地的华重楼量相差近2倍,进一步表明重楼品质的形成受小气候影响较大[9]。造成以上差异的原因,可能与栽培技术、产地环境等有关,表明需加大对重楼药材的人工栽培技术和产地适宜性研究,以确保重楼药材资源可持续利用和重楼医药产业可持续发展。
鉴于核苷和碱基类成分在重楼药材中质量分数为735.390 1~1 612.807 3μg/g,进一步探讨以其含量高低作为重楼药材质量优劣的衡量指标,很有必要。本方法专属性强,简便可靠,可为全面客观地认识重楼属药用植物功效物质基础、丰富和发展重楼药材多指标评价体系研究提供新的方法参考。
| [1] | 刘欢, 何忠俊, 梁社往, 等. 滇重楼高效液相色谱指纹图谱研究[J]. 中草药 , 2012, 43 (9) :1846–1851. |
| [2] | 张植玮, 刘正宇, 陈玉菡, 等. 重庆三峡库区重楼属药用植物资源调查[J]. 资源开发与市场 , 2008, 24 (3) :254–256. |
| [3] | 刘银花, 王跃华, 唐旭, 等. 华重楼植株的快速繁殖研究[J]. 中草药 , 2015, 46 (19) :2925–2931. |
| [4] | 武珊珊, 高文远, 段宏泉, 等. 重楼化学成分和药理作用研究进展[J]. 中草药 , 2004, 35 (3) :344–345. |
| [5] | 张雪梅, 杨丰庆, 夏之宁. 食品中核苷类成分的药理作用研究进展[J]. 食品科学 , 2012, 33 (9) :277–282. |
| [6] | Lee J, Chuang T H, Redecke V, et al. Molecular basis for the immunostimulatory activity of guanine nucleoside analogs: activation of Toll-like receptor 7[J]. Proc Natl Acad Sci USA , 2003, 100 (11) :6646–6651. DOI:10.1073/pnas.0631696100 |
| [7] | Kinahan J J, Kowal E P, Grindey G B. Biochemical and antitumor effects of the combination of thymidine and 1-β-D-arabinofuranosylcytosine against leukemia L1210[J]. Cancer Res , 1981, 41 (2) :445–451. |
| [8] | 黄璐琦, 肖培根, 王永炎. 中国珍稀濒危药用植物资源调查[M]. 上海: 上海科学技术出版社, 2011 . |
| [9] | 杨永红, 戴丽君, 何昆鸿, 等. 土壤营养与人工栽培滇重楼品质相关性评价[J]. 中药材 , 2012, 35 (10) :1557–1561. |
| [10] | 杨德全, 杨勤, 周浓. 多基源重楼的质量等同性研究[J]. 中国实验方剂学杂志 , 2014, 20 (3) :91–94. |
| [11] | 付绍智, 李楠, 刘振, 等. HPLC法测定不同产地重楼属植物中7种甾体皂苷成分[J]. 中草药 , 2012, 43 (12) :2435–2437. |
 2016, Vol. 47
2016, Vol. 47


