内生真菌是在其生活史或生活史中某一段时间生活在植物组织内,但不会引起植物组织明显病害症状的真菌,其广泛存在于不同地域、不同种类的植物组织内[1]。内生真菌在长期协同进化过程中与宿主逐渐形成了互惠关系。宿主为内生真菌提供生长所需的营养物质,内生真菌则可促进宿主生长[2-3]、提高宿主对病虫害、环境胁迫等方面的抗性[4-5]。研究表明,内生真菌不仅与宿主的次生代谢产物的合成有关,还能直接影响药用植物的品质。内生真菌还可产生具有特殊结构或者新颖的生物活性的化合物,是一类筛选新药、农药活性物质的重要微生物资源,在农业、医药及食品工业中具有很大的应用潜力[6]。杜仲Eucommia ulmoides Oliv.是杜仲科(Eucommiaceae)现存唯一的一个种[7],其树皮和叶入药,具有补肝肾、强筋骨、安胎的作用[8]。杜仲主要次生代谢产物有绿原酸、桃叶珊瑚苷、京尼平苷等,它们均具有抗菌、抗肿瘤等药理活性[7],因此,杜仲是提取绿原酸的主要资源之一。由于杜仲野生植物资源的过度开发,杜仲现为我国二级保护植物。从杜仲植物体中分离内生真菌产生这些活性成分是保护资源和满足药用资源的有效途径。Chen等[9]从杜仲茎皮和叶片中分离到一株产绿原酸的内生真菌。杨明琰等[10]从慈利、略阳和遵义3个产地杜仲皮中分离到152个菌株,结果发现,不同产地杜仲皮内生真菌的组成结构上存在差异。目前,杜仲内生真菌研究主要集中于陕西、四川、上海等地[9-10],分离部位主要为茎皮。河南位于我国中部,目前杜仲内生菌研究还处于空白。叶片最容易受到病菌侵害,其内生菌在其抗病中起着重要作用,但从叶片中分离内生菌的研究很少,果实内生菌的分离更是空白。本研究拟从河南栽培的杜仲叶片和果实中分离内生真菌,筛选具有抑菌活性的菌株,为下一步筛选活性物质,用于生物制药和农业产业打下基础。
1 材料 1.1 材料2013年11月和2014年5月在河南大学药用植物园随机选取5棵无病虫害的杜仲树,采取新鲜叶片和果实置于保鲜袋中备用,由笔者鉴定为杜仲Eucommia ulmoides Oliv.叶片和果实。供试病原菌由河南工业大学伊艳杰博士提供。植物源病菌有禾谷丝核菌Rhizoctonia cerealis Van der Hoeven,小麦根腐病菌Drechslera Sofokiniana (Sacc.) Subram. Gain.,禾谷镰刀菌Fusarium graminearum Schw.,蜡样芽孢杆菌Bacillus cereus Frankland;人类致病菌有金黄色葡萄球菌Staphylococcus aureus Rosenbach,白色念珠菌Monilia albican,猪霍乱沙门氏菌Salmonella choleraesuis,大肠杆菌Escherichia coli。
1.2 仪器与试剂对照品绿原酸由日本养命酒株式会社中央研究院Deyama先生赠送,经归一化法测定质量分数为99.2%。;高效液相色谱仪为Agilent 1260型(美国Agilent公司,包括G1311C四元梯度泵、G1329B自动控温自动进样器、G1316A柱温箱、G1314B可变波长紫外检测器、ChemStation6.01色谱工作站)。
2 方法 2.1 分离培养基的制备分离及抑菌活性检验培养基为马铃薯葡萄糖琼脂(PDA)固体培养基,其做法是将去皮马铃薯切成小片在去离子水中煮沸30 min,用纱布滤过得到马铃薯汤汁,加入2%葡萄糖、2%琼脂,不需调pH。发酵以及鉴定培养基用PDA液体培养基。
2.2 杜仲内生真菌的分离和纯化将杜仲叶片或果实分切成长1.5 cm左右,宽1 cm左右的小片,先用75%乙醇处理30 s,然后用2%次氯酸钠溶液处理灭菌2、3、5 min,无菌水冲洗5~6遍,接种于PDA固体培养基上。用最后一次洗叶片的无菌水作空白对照。将接种后的培养基放置于28℃恒温培养室中培养,5 d后产生的菌丝用1/4画线法进行分离纯化。纯化后的菌种移至PDA固体培养基的试管斜面上,培养至稳定期后在4℃条件下保存。
2.3 产杜仲活性成分菌株筛选将各菌株接种于100 mL PDA液体培养基中,30℃、120 r/min发酵7 d。发酵液用超声波细胞破碎仪处理30 min,破碎液在14 000 r/min条件下离心10 min。上清液用0.22μm滤膜滤过后进行HPLC分析[8]。色谱柱为Hypersil BDS C18型(250 mm×4.6 mm,5.0μm)。以杜仲活性成分绿原酸为对照品,对杜仲内生真菌代谢产物粗提液进行检测。流动相为1.0%磷酸水溶液-甲醇(72∶28),体积流量1.0 mL/min,检测波长360 nm,柱温25℃。
2.4 拮抗菌株筛选 2.4.1 对峙法将供试菌和测试菌菌饼放在同一个倒有新鲜固体PDA培养基的培养皿中,2个菌饼相距3 cm。将接好菌饼的培养皿放置在30~32℃恒温条件下培养4~5 d,测量抑菌环宽度。以无菌蒸馏水和PDA培养基提取物作为阴性对照,以50μg/mL绿原酸溶液作为阳性对照。每个菌株与每个病原菌作为1个处理,接种5个培养皿,每种处理设置3次重复。
2.4.2 生长速率法为了排除病原菌对供试菌株的抑制作用,将对峙法中检测有抑菌活性的内生真菌在PDA液体培养基中培养5 d,离心取上清液30 mL倒入含1 L的PDA固体培养基中制成发酵液平板,每个培养皿放入3个菌柄,在30~32℃恒温条件下培养4~5 d,测量致病菌菌落半径。同样以无菌蒸馏水和PDA培养基提取物作为阴性对照,以50μg/mL绿原酸溶液作为阳性对照。每种处理设置3次重复。
数据分析用Excel 2003对统计数据进行计算,用SPSS 13.0软件进行显著性方差分析。
2.5 菌种分子鉴定对于抑菌效果良好和产杜仲活性成分的内生真菌,测定ITS序列鉴定其归属。液体培养5 d的菌液,进行抽滤收集菌丝体。使用宝生物工程(大连)有限公司植物基因组DNA抽提试剂盒(DV811A)提取真菌基因组DNA,操作流程按试剂盒说明书进行。以8 g/L琼脂糖凝胶电泳检测所提取DNA的质量。扩增ITS区所用引物为ITS-1:5’-TCCGTAGGT-GAACCTGCGG-3’和ITS-4:5’-GGAAGTAAAAG-TCGTAACAAGG-3’。引物、Taq聚合酶等均来自上海生工生物工程技术服务有限公司。PCR总反应体系为20μL,含30 ng模板DNA、引物浓度为0.4μmol/L、60μmol/L dNTPs、2 mmol/L MgCl2及0.5 U Taq DNA聚合酶。PCR扩增反应在S1000 Thermal cycler PCR仪上进行。PCR反应程序为95℃变性5 min后,进行30个循环的94℃变性50 s,52℃退火60 s,72℃延伸55 s,再经72℃延伸10 min后于4℃保存。检测成功后将PCR反应产物寄往北京六合华大基因科技股份有限公司进行测序。所得序列在GeneBank上进行Blast比对,确定其归属。
3 结果与分析 3.1 杜仲内生真菌的分离将在PDA固体培养基上培养5 d后得到的杜仲内生真菌用1/4划线法进行分离纯化,根据其菌落形态进行初步分类。2013年11份采集的叶片和果实中共分离纯化得到39株真菌,2014年5月采集的叶片和果实中分离得到52株真菌,将2次采集杜仲样本分离得到的内生真菌进行菌落形态分析,最终确认得到52株真菌(编号1~52)。
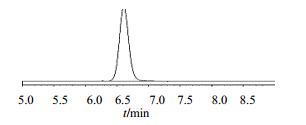
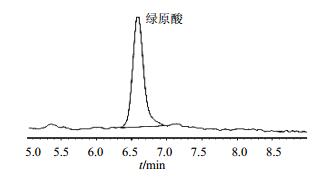
3.2 产杜仲活性成分菌株用HPLC法对分离到的52株杜仲内生真菌进行产绿原酸能力鉴定,结果发现,4和7号2个菌株可以产生绿原酸,质量浓度分别为0.210和0.205 mg/L。绿原酸对照品的HPLC图谱见图 1,样品的色谱图见图 2。
|
图 1 绿原酸对照品的HPLC图 Fig.1 HPLC of chlorogenic acid reference substance |
|
图 2 4号菌株的HPLC图 Fig.2 HPLC of stain 4 |
3.3 抑菌菌株筛选
将分离获得的52株杜仲内生真菌通过对峙培养法进行拮抗筛选,结果表明,有11个菌株对8种供试致病菌分别呈现出不同程度的抑制作用(表 1)。对禾谷丝核菌有拮抗作用的有8个菌株,其中9、18、41、42号菌株抑菌环宽度达到3 mm以上。对小麦根腐病有抑菌效果的有9个菌株,其中41号株菌抑菌环达到3 mm。对禾谷镰孢菌有抑菌效果的有10个菌株,其中18号和42号菌株抑菌环为3 mm。对蜡样芽孢杆菌有抑菌效果的有7个菌株,18号菌株抑菌环为3.5 mm;对金黄色葡萄球菌有拮抗作用有9个菌株,其中18号菌株抑菌环高达4 mm,27和42号菌株抑菌环为3 mm。对白色念珠菌有拮抗效果的有5个菌株。对猪霍乱沙门氏菌和大肠杆菌有拮抗效果的有3个菌株。总之,杜仲内生真菌对植物源的病原菌拮抗作用较好,而在人类致病菌中仅对金黄色葡萄球菌拮抗作用较好,对其余3种人类致病菌拮抗作用则较弱。
|
|
表 1 对峙法抑菌实验结果 Table 1 Results of antimicrobial activity through standoff method |
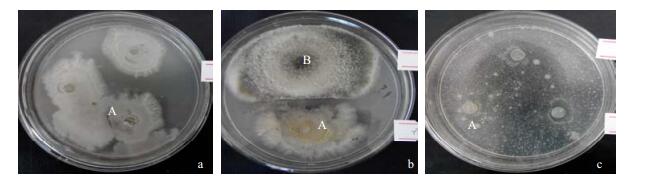
将对峙法中检测具有抑菌作用的内生真菌再用生长速率法检测其抑菌活性(表 2)。结果发现对禾谷丝核菌抑制率高达60%以上有3个菌株,分别为7、9和41号菌株,然而在对峙法中拮抗作用最好的42号菌株却对禾谷丝核菌无抑制作用。对小麦根腐菌抑制率达60%以上的菌株有7、23、27、41和42号菌株,而在对峙法中无抑菌作用的27号菌株抑制率却高达69.0%。对禾谷镰孢菌抑制率达60%以上有9个菌株,其结果与对峙法基本一致。无论是对峙法还是生长速率法,7号菌株均表现较好的抑菌作用,图 3显示了其对禾谷镰孢菌的抑菌效果。对蜡样芽孢杆菌抑制率与对峙法结果基本一致,但在对峙法中有微弱抑菌作用的1号菌株抑制率却达到69.0%,而抑制作用最好的18号菌株的抑制率仅为33.3%。对整个人类致病菌的拮抗作用都不明显,抑制率最高的27号菌株对金黄色葡萄球菌仅为20.8%。在对峙法中有拮抗作用的7、18和29号菌株在生长速率法中抑制率均为0。
|
图 3 7号菌株对禾谷镰孢菌的抑制作用 Fig.3 Inhibition of endophytic fungus stain 7 on F. graminearum |
|
|
表 2 菌丝生长速率法抑菌实验结果 Table 2 Results of antimicrobial activity through growth rate method |
3.4 菌种鉴定
对具有良好抑菌效果的11个杜仲内生真菌菌株进行ITS序列测定,经Blast比对发现,1、2、7、9、18、23、27、29、42、46号菌株ITS序列与链格孢属Alternaria的数个种类序列相似度为100%,因此,这些菌株均属于链格孢属Alternaria sp.。41号菌株ITS序列与叶点霉属Phyllosticta、派伦霉属Peyronellaea、茎点霉属Phoma的一些种类序列相似度也为100%,只能确定其归属为子囊菌门(Ascomycota)座囊菌纲(Dothideomycetes)。对能够代谢产生杜仲活性成分绿原酸的4号菌株进行ITS序列测定,经Blast比对发现,4号菌株与黑孢属Niqrospora sp.数个菌株相似度为99%,确定其隶属于黑孢属Niqrospora sp.。
4 讨论杜仲传统上是以茎皮入药,而本研究选择从杜仲叶片和果实中分离内生真菌,一方面叶中可能有丰富的内生菌,Arnold[11]认为叶中的内生真菌要多于茎中,Souza等[12]从Strychnos cogens和Palicourea longiflora中分离内生真菌,也发现叶中内生真菌高于茎中,甚至高于根中。其次,目前杜仲内生菌的研究主要集中于茎皮,从叶中分离杜仲内生菌的研究较少,果实更是没有研究,更重要的是本研究的目的是分离具有抑菌作用的内生真菌,叶更容易受到病害侵害,更容易分离到有拮抗作用的内生真菌。
Strobel等[13]于1993年首次从短叶红豆杉Taxus brevifolia的韧皮部中分离到一株产生其活性成分紫杉醇的内生真菌Taxomyces andreanal Nutt.。这一发现为人类寻找活性成分资源提供了新思路,掀起了对植物内生菌及其活性物质开发的热潮。从杜仲内生菌分离活性成分也有一定研究,Chen等[9]从四川成都的杜仲皮中分离到1株产绿原酸的真菌。刘超等[14]和李爱华等[7]从采自陕西杨凌带杜仲皮分离到8株产松脂醇二葡萄糖苷的内生真菌。本研究发现2个菌株能产生绿原酸。
Strobel等[15]认为植物内生真菌能产抗菌物质(如肽、有机酸、萘等),可以保护宿主植物免受其他的细菌、真菌、病毒等的侵害,同时也对某些人类病原菌有一定的拮抗作用,内生真菌是筛选抗菌活性成分的重要资源。本研究分别用对峙法和生长速率法检测了杜仲内生真菌对一些植物和人类病原菌的抑菌活性,目的是筛选抑菌效果明显的真菌,为进一步分离抗菌活性物质筛选真菌资源。对峙法抑菌实验中抑菌环宽度是评价抑菌活性的重要参考指标,且抑菌环的宽度与抑菌作用呈正比。结果发现,筛选得到的11个活性菌株对8种致病菌中至少3种有抑制作用,尤其是10个菌株(90.9%)对禾谷镰孢菌都有抑制作用,且9个抑菌环宽度大于1 mm,而对猪霍乱沙门氏菌和大肠杆菌有拮抗作用的仅3个菌株(27.3%),且抑菌环较小。可见,内生真菌对植物源的病原菌拮抗作用要显著高于对人类致病菌的拮抗作用。生长速率法与对峙法结果基本一致,但一些对峙法中拮抗效果明显的菌株在生长速率法中却无任何效果,如42号菌株对禾谷丝核菌在对峙法中抑菌环高达3.5 mm,而在生长速率法中抑制率为0,可能是对峙法中病原菌抑制了内生菌的生长,即内生菌对病原菌无拮抗作用。本研究得到的11株内生真菌至少对植物病原菌有显著拮抗作用,现已大批量发酵培养部分内生真菌,为下一步筛选活性物质提供材料。
| [1] | Mcgee A P. Distribution of the Orchid Mycorrhizal Fungus, Rhizoctonia solani, in Relation to Its Host, Pterostylis acuminata, in the Field[J]. Austr J Bot , 1995, 43 (6) :565–575. DOI:10.1071/BT9950565 |
| [2] | Redlin S C, Carris L M. Endophytic Fungi in Grasses and Woody Plants: Systematics, Ecology, and Evolution[M]. St. Paul, Minn: APS Press, 1996 . |
| [3] | Gamboa M A, Laureano S, Bayman P. Measuring diversity of endophytic fungi in leaf fragments: does size matter?[J]. Mycopathologia , 2002, 156 (1) :41–45. DOI:10.1023/A:1021362217723 |
| [4] | W01li P R, Ahlholm J U, Helander M, et al. Occurrence and genetic structure of the systemic grass endophyte Epichlo05 festucae in fine fescue populations[J]. Microb Ecol , 2007, 53 (1) :20–29. DOI:10.1007/s00248-006-9076-2 |
| [5] | Rudgers J A, Fischer S, Clay K. Managing plantsymbiosis: fungal endophy tegen otypealters plant community composition[J]. J Appl Ecol , 2010, 47 (2) :468–477. DOI:10.1111/(ISSN)1365-2664 |
| [6] | Arnold A E. Understanding the diversity of foliar endophytic fungi: progress, challenges, and frontiers[J]. Fungal Biol Rev , 2007, 21 :51–66. DOI:10.1016/j.fbr.2007.05.003 |
| [7] | 李爱华, 樊明涛, 师俊玲. 杜仲内生菌的分离及产PDG菌株的筛选[J]. 西北植物学报 , 2007, 27 (3) :616–619. |
| [8] | 中国药典[S].一部. 2010. |
| [9] | Chen X, Sang X, Li S, et al. Studies on a chlorogenic acid-producing endophytic fungi isolated from Eucommia ulmoides Oliver[J]. J Ind Micrbiol Biotechnol , 2010, 37 (5) :447–454. DOI:10.1007/s10295-010-0690-0 |
| [10] | 杨明琰, 田稼, 马瑜, 等. 杜仲内生真菌的分离鉴定及抗菌活性研究[J]. 西北植物学报 , 2012, 32 (1) :193–198. |
| [11] | Amold A E. Understanding the diversity of foliar endophytic fungi: progress, challenges, and frontiers[J]. Fungal Biol Rev , 2007, 21 :51–56. DOI:10.1016/j.fbr.2007.05.003 |
| [12] | Strobel G, Stierle A, Stierle D, et al. Taxomyces andreanae, a proposed new taxon for a bulbilliferous hyphomycete associated with Pacific yew (Taxus brevifolia)[J]. Mycotaxon , 1993, 47 :71–80. |
| [13] | 刘超, 师俊玲, 周小娟, 等. 产PDG杜仲内生菌的分离筛选和分类鉴定及生长条件研究[J]. 西北农林科技大学学报:自然科学版 , 2011, 39 (1) :203–209. |
| [14] | Strobel G A, Miller R V, Miller C, et al. Cryptocandin, a potent antimycotic from the endophytic fugus Cryptosporiosis cf. quercina[J]. Cryptocandin, a potent antimycotic from the endophytic fugus Cryptosporiosis cf. quercina , 1999, 145 :1919–1926. |
| [15] | Souza A Q L D, Souza A D L D, Astolfi Filho S, et al. Atividade antimicrobiana de fungos endofíticos isolados de plantas tóxicas da amazônia: Palicourea longiflora(Aubl.) riche Strychnos cogens bentham[J]. Acta Amaz , 2004, 34 (2) :185–195. DOI:10.1590/S0044-59672004000200006 |
 2016, Vol. 47
2016, Vol. 47


