2. 湖北中医药大学药学院, 湖北 武汉 430000
2. College of Pharmacy, Hubei University of Chinese Medicine, Wuhan 430000, China
参环毛蚓Pheretima aspergillum (E. Perrier)是《中国药典》2015年版地龙项下4种原动物之一,因其主产于广东、广西地区,故又称为广地龙。其性寒凉,味咸,具有清热定惊、通络、平喘、利尿等功效,广泛应用于经络不通所致脑栓塞、脑梗死、冠心病、脑卒中、关节麻痹、肢体麻木、半身不遂等疾病以及哮喘等呼吸道疾病,是国内外药材市场中公认的地龙优质品[1]。目前广地龙和地龙药材多为野生采集,其质量和产量容易受环境条件、自然气候、采集以及炮制等因素的影响而不稳定。其中,环境因素里重金属超标问题一直难以控制,极大地制约着广地龙药材的生产和发展。
金属硫蛋白(metallothionein,MTs),是一类广泛存在于生物中的低相对分子质量(2 000~7 000)、富含半胱氨酸(20%~30%)、低芳香族氨基酸的一类金属结合蛋白质,因其具有独特的四面硫体结构可螯合重金属[2],而成为多种生物体的重要的解毒途径。本课题组前期的研究发现参环毛蚓体内的MTs表达量会随着生活环境Cd2+浓度的递增而增加[3-7],众多研究结果也表明MTs是主导参环毛蚓重金属耐受和富集的关键蛋白,也是导致广地龙重金属超标的主要原因[8-9]。因此克隆MT-2 5’端启动子序列来了解MT-2基因的转录调控机制[10-11],是从源头上探索解决广地龙重金属超标问题的重要研究方向,也是近年来本团队工作的重点。
本研究通过分离克隆参环毛蚓MT-2基因组序列,分析其启动子区的调控元件,以期探索参环毛蚓MT-2基因的调控转录机制,为今后用基因工程技术改良参环毛蚓重金属富集性状奠定基础。
1 材料 1.1 动物材料参环毛蚓样品来自广西省钦州市灵山县,经广州中医药大学李薇教授鉴定为钜蚓科动物参环毛蚓Pheretima aspergillum (E. Perrier)的健康成熟活体,实验室人工饲养2周。
1.2 养殖土壤养殖土壤采自广州市番禺区长洲岛田间洁净土壤,自然干燥。同时取部分土壤送青岛科标化工分析检测有限公司进行检测。土壤理化性质:土壤pH值为5.9,有机质76.67 g/kg,含沙量15.99%,其中重金属Cd的量30.0μg/kg,远低于国家土壤质量标准(GB 15618-1995),故农田土壤Cd的本底值可忽略。
1.3 试剂Genome Walking Kit(TAKARA公司,批号6108),pMD®18-T Vector(TAKARA公司,批号D101A),Marker(Takara,批号D501A),琼脂糖(GENE COMPANY),Mollusc DNA Kit(美国OMEGA公司,批号D3373-01),DNA纯化试剂盒(百泰克生物技术有限公司),GoldView染料(华齐盛生物科技有限公司),蛋白酶K(美国MerCk公司)。
称取27 g Tris、1.86 g Na2EDTA、13.75 g硼酸,用去离子水配制成250 mL储存液,常温储存,得到TBE试剂。
称取0.2 g琼脂糖,加入20 mL 1×TBE,于电炉上加热至熔化,冷却至55℃左右,再加入核酸染料Goldview 1μL,混匀,铺胶,冷却至室温,得到1%琼脂糖凝胶。
1.4 引物设计采用Primer5自行设计,由北京六合华大基因科技股份有限公司和上海生工生物技术服务有限公司合成,用无菌的去离子水溶解得到100μmol/L的储存液。取适量稀释成10μmol/L作为引物工作液,−20℃保存。
1.5 仪器LDZX-50FAS立式力蒸汽灭菌器(上海申安医疗器械厂),AUY120电子分析天平(日本岛津),TG16微量高速台式离心机(长沙湘怡离心机仪器有限公司),VS-840-1洁净工作台(等级100级,上海讯实业有限公司医疗设备厂),PCR仪(杭州朗基科学仪器有限公司),WFH-203B三用紫外分析仪(上海驰唐电子有限公司),LSY电热恒温水浴锅(北京市医疗器械厂),SmartSpectmPlus Spectrophotometer核酸蛋白检测仪、电泳仪、水平电泳槽、自动凝胶成像系统均购自美国Bio-rad公司。
2 方法 2.1 参环毛蚓基因组DNA提取选取性成熟,生殖环带明显的成年参环毛蚓,吐泥1 d。置超净工作台上,75%乙醇简单麻醉后,剪取尾巴处的肌肉组织约50 mg,ddH2O震荡洗涤3次,吸水纸吸干。采用软体动物DNA提取试剂盒(Omega公司)提取样品DNA,并使用DNA纯化试剂盒(Bioteke)对所提取的DNA进行纯化。
2.2 参环毛蚓MT-2编码区序列扩增本课题组前期研究利用RT-PCR及TA克隆技术获知了参环毛蚓MT-2基因的部分cDNA序列518 bp,虽然未包含内含子部分,但为设计扩增MT-2基因编码区全长的引物和启动子序列的引物提供参考。根据此cDNA序列设计PCR引物SP1:5’-TGTTCTCGAAATTAATGCTAGCCCA-3’、QYWF:3’-AAGGCGAGAAACTCTTTGTGGCGGA-5’。PCR反应体系与程序如下:PCR反应总体积为50μL,含有DNA模板5μL,10×PCR Buffer LA Taq 5μL,dNTP(2 mmol/L)5μL,引物SP1和QYWF各2μL,LA Taq(Takara)0.5μL,双蒸水补足体积。PCR扩增参数为94℃预变性4 min;94℃变性30 s,55℃退火30 s,72℃延伸3 min,共30个循环;72℃延伸5 min,4℃保存备用。将PCR产物采用1%琼脂糖凝胶电泳(90 V,30 min)检测,将条带大小正确的样品送到上海生工科技有限公司测序,测序获得的序列与本实验室之前克隆获得的MT基因cDNA序列(登录号KC787373.1)进行比对。
2.3 参环毛蚓MT-2基因启动子序列扩增 2.3.1 特异引物的设计根据“2.2”项方法获得的MT-2基因编码区序列,按照TAKARA Walking试剂盒特异性序列设计原则设计3条特异性的引物序列。设计方向为需要扩增的未知区域方向,SP2的位置应设计在SP1的内侧,SP3位于SP2的内侧。引物序列见表 1。
|
|
表 1 MT-2基因启动子扩增引物序列 Table 1 Amplification primers of MT-2 gene promoter |
2.3.2 MT-2基因启动子PCR的扩增
(1)第1轮PCR反应:PCR反应总体积为50μL,含有DNA模板2μL,dNTP Mixture(2.5 mmol/L)8μL,10×LA PCR Buffer Ⅱ(Mg2+ plus)5μL,TaKaRa LA Taq®(5 U/μL)0.5μL,AP1~AP4引物(genome walking kit试剂盒)(100 pmol/μL)1μL,W296-1(SP1)(10 pmol/μL)1μL,双蒸水补足体积。PCR扩增参数为94℃、1 min,98℃、1 min,94℃、30 s,55℃、1 min,72℃、2~4 min,共5个循环;94℃、30 s,25℃、3 min,72℃、2~4 min,94℃、30 s,55℃、1 min,72℃、2~4 min,94℃、30 s,55℃、1 min,72℃、2~4 min,94℃、30 s,44℃、1 min,72℃、2~4 min,共15个循环;72℃、10 min,4℃保存备用。
(2)第2轮PCR反应:将第1轮PCR反应液稀释1~1 000倍后,取1μL作为第2轮PCR反应的模板,以AP1引物为上游引物,W296-2(SP2)引物为下游引物,进行第2次PCR反应。PCR反应体系与程序如下:PCR反应总体积为50μL,含有DNA模板1μL,dNTP Mixture(2.5 mmol/L)8μL,10×LA PCR Buffer Ⅱ(Mg2+ plus)5μL,TaKaRa LA Taq®(5 U/μL)0.5μL,AP1~AP4引物(100 pmol/μL)1μL,W296-2(SP2)(10 pmol/μL)1μL,双蒸水补足体积。PCR扩增参数为94℃、30 s,55℃、1 min,72℃、2 min,94℃、30 s,55℃、1 min,72℃、2 min,94℃、30 s,44℃、1 min,72℃、2 min,共15个循环;72℃、10 min,4℃保存备用。
(3)第3轮PCR反应:将第2轮PCR反应液稀释1~1 000倍后,取1μL作为第3轮PCR反应的模板,以AP1为上游引物,W296-3(SP3)为下游引物,进行第3轮PCR反应。PCR反应体系与程序如下,PCR反应总体积为50μL,含有DNA模板1μL,dNTP Mixture(2.5 mmol/L)8μL,10×LA PCR Buffer Ⅱ(Mg2+ plus)5μL,TaKaRa LA Taq®(5 U/μL)0.5μL,AP1~AP4引物(100 pmol/μL)1μL,W296-3(SP3)(10 pmol/μL)1μL,双蒸水补足体积。PCR扩增参数为94℃、30 s,55℃、1 min,72℃、2~4 min,94℃、30 s,55℃、1 min,72℃、2~4 min,共15个循环;72℃、10 min,4℃保存备用。
(4)琼脂糖凝胶回收:将3轮扩增的产物采用1%琼脂糖凝胶电泳(90 V,30 min)检测。取第3轮条带大小正确的PCR反应产物,使用凝胶回收试剂盒(Bioteke),切胶回收。再经1%琼脂糖凝胶电泳(90 V,30 min)检测回收产物,进行TA克隆测序。
2.3.3 MT基因启动子序列分析采用启动子分析软件Promoter Prediction和Patch软件(http://www.gene-regulation.com/cgi-bin/pub/programs/patch/bin/patch.cgi?)等对克隆得到的启动子序列进行序列分析。
3 结果与分析 3.1 参环毛蚓MT-2基因编码区序列扩增采用引物SP1和QYWF从参环毛蚓基因组DNA中扩增到长度约2 800 bp的片段(图 1),该片段送至上海生工科技有限公司进行测序,获得总长度为2 826 bp的序列,为MT-2基因编码区的全长。将该序列与本实验室之前克隆获得的MT-2基因cDNA序列(登录号为KC787373.1)通过NCBI中Blast及手工相结合方法比对,发现除外显子序列有几个碱基突变外完全相同,此外该序列还包含4个内含子。其中,第1个内含子位于基因组转录起始位点17 bp位置,长度为403 bp;第2个内含子在447 bp的位置,长度为626 bp;第3个内含子在1 181 bp位置,长度396 bp,第4个内含子在1 661 bp位置,长度1 065 bp(图 2)。将其和可检索到的红正蚓Lumbricus rubellus MT-2基因组3种基因位点序列结构对比分析,两种蚯蚓编码区的序列外显子和内含子组成数目并不相同,参环毛蚓编码区较红正蚓多出1个内含子,且两者内含子的长度相差悬殊。本研究还发现蚯蚓的第1和第2个外显子的碱基长度较哺乳动物的短(表 2)。
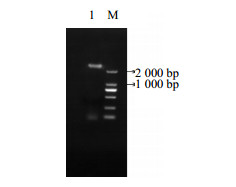
|
图 1 MT-2基因PCR扩增 Fig.1 Amplification of MT-2 gene by PCR |

|
图 2 MT-2基因编码区序列 Fig.2 MT-2 gene coding sequence |
|
|
表 2 蚯蚓MT-2基因外显子和内含子碱基比例及位置 Table 2 Percentage and location of exons and introns in MT-2 gene |
3.2 参环毛蚓MT-2基因启动子的克隆
根据MT-2基因的5’端序列设计3个巢式的特异性引物作为反向引物,以Genome Walking Kit试剂盒自带的随机引物AP1~AP4作为正向引物,通过染色体步移法扩增MT-2基因的启动子序列。将3轮的PCR产物用1%琼脂糖凝胶电泳检测。电泳结果显示,试剂盒中的随机引物AP3和3个特异引物在3轮PCR中扩增得到较清晰明亮的条带,而采用随机引物AP1、AP2、AP4扩增的产物均出现抹带或无条带的现象(图 3,泳道9、10、12)。尤其是在第3轮PCR中,只有随机引物AP3和特异引物SP3成功扩增出MT-2基因的启动子(图 3,泳道11),长度约1 600 bp。将产物进一步纯化后连接至T载体进行TA克隆,随机挑选阳性克隆测序。获得了一个长度为1 646 bp的序列,将其自行拼接后与参环毛蚓的MT-2基因编码区序列比对,两者间有112 bp的重复序列,表明其为参环毛蚓MT-2基因的5’端序列。
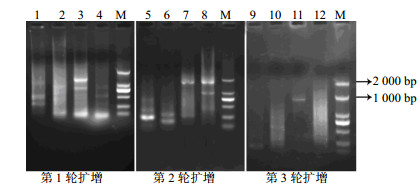
|
图 3 MT-2基因启动子PCR扩增 Fig.3 Amplification of MT-2 promoter by PCR |
3.3 参环毛蚓MT-2基因启动子序列分析
将克隆分析得到的1 646 bp序列,经Promoter Predictions软件分析后(http://www-bimas.cit.nih.gov/molbio/signal/)发现,MT-2基因启动子除具有一般启动子含有的作用元件:RNA聚合酶的结合位点TATA box和调控基因转录起始频率的CAAT box外,还有很多潜在的顺式作用元件如SP1、Ap-1、abaA等转录因子结合位点,都是基础启动子所具有的转录激活因子。此外,还发现3个MTF的结合位点,即典型的MT基因启动子所具有金属响应元件MRE的序列(TGCRCNC)。将主要的转录因子结合位点标注在克隆得到的序列中,发现参环毛蚓MT-2的MRE主要位于启动子−212~−215、−1 425~−1 382以及互补链−380~−374的位置处(图 4)。然而其拷贝数目远没有哺乳动物报道的4~6个之多,说明蚯蚓的MT基因的调控机制与哺乳动物可能存在着差异。

|
图 4 MT-2基因上游调控序列及预测的顺式作用元件 Fig.4 Upstream nucleotide sequence of MT-2 gene and predicted cis-regulatory elements |
4 讨论
基因的表达模式和水平取决于启动子的顺式作用元件,故获得MT-2启动子序列是揭示MT-2基因的转录调控机制的基础。本研究通过基因步移技术,自行设计3个特异引物进行扩增,其中只有随机引物中的AP3和自行设计的引物能扩增出目的序列,由此可见,启动子的成功克隆引物是关键。
在脊椎动物中,所有MT基因启动子区都具有典型的MRE保守序列。本研究对获知的MT-2启动子序列进行分析,发现该序列不仅含有TATA-box、CAAT-box等核心启动子软件,还具有3个与脊椎动物类似能特异响应重金属启动MT-2表达的MRE元件,表明参环毛蚓可能具有脊椎动物同样的MT-2基因的调控方式,且MRE是实现其转录水平调控的核心元件[10-12]。因此,MT-2启动子及其MRE的克隆和鉴定,对于研究广地龙重金属富集机制和利用基因工程技术改良蚯蚓重金属超富集性状有着重要意义。
目前蚯蚓种属中唯一明确MT-2基因启动子序列的物种是红正蚓L. rubellus HOffnleister,且与参环毛蚓亲缘关系较近,故将二者进行比较,发现两者的MRE元件拷贝数量一致,但分布位置不同,参环毛蚓的MRE分别在转录起始位点上游的−212~−215、−1 425~−1 382以及互补链−355~−362位置处,分布成近端和远端,而红正蚓的MRE则集中位于近起始密码子−350 bp以内,形成近端集群[13]。有文献报道MRE分布位置的不同,其活性及重金属响应活性不尽相同。如银鱼MT-2启动子在均含有位于近起始密码子位置近端和远端的MRE时诱导活性最强,然而只有近端的MRE能够响应金属[14]。由此表明,2种蚯蚓MT-2基因响应重金属诱导表达的方式可能稍有不同。
本研究通过克隆和分析参环毛蚓MT-2基因的启动子序列,在分子层面阐明了MT-2基因的的转录调控机制,还进一步在本实验室所建立的肠上皮细胞(IEC)培养系统基础上研究MT基因表达调控过程,但局限于实验条件,使得构建启动子的荧光素酶载体未能顺利转染。以期在今后的研究中,优化已建立的参环毛蚓IEC培养体系,逐步解决这些问题,以期从多层面阐明MTs介导参环毛蚓重金属富集机制。
| [1] | 林小桦, 李薇, 侯雪芹, 等. 参环毛蚓细胞原代培养灭菌方法的研究[J]. 广州中医药大学学报 , 2011, 28 (3) :264–267. |
| [2] | Ngu T T, Sturzenbaum S R, Stillman M J. Cadmium binding studies to the earthworm Lumbricus rubellus metallothionein by electrospray mass spectrometry and circular dichroism spectroscopy[J]. Biochen Biophys Res Commun , 2006, 351 (1) :229–233. DOI:10.1016/j.bbrc.2006.10.023 |
| [3] | 吴波, 李薇, 付玉梅, 等. 重金属镉对参环毛蚓胃肠道上皮细胞超微结构损伤的研究[J]. 中药材 , 2011, 34 (12) :1833–1837. |
| [4] | 郭永灿, 王振中, 赖勤, 等. 株洲工业区土壤重金属污染与蚯蚓同工酶的研究[J]. 应用生态学报 , 1995, 6 (3) :317–322. |
| [5] | 牛明芬, 崔玉珍. 蚯蚓对垃圾与底泥中镉的富集现象[J]. 农村生态环境 , 1997, 13 (3) :54–55. |
| [6] | 李薇, 沈克, 杨洁瑜, 等. 广地龙对重金属富集特性的初步研究[J]. 中药材 , 2007, 30 (5) :519–521. |
| [7] | Morgan J E, Morgan A J. Zinc sequrstration by earthworm (Annelida: Oligochaeta) chloragocytes. An in vivo investigation using fully quantitative electron probr X-ray micro-analysis[J]. Histochemistry , 1989, 90 (5) :405–411. DOI:10.1007/BF00508320 |
| [8] | 吴波, 李薇, 江庆萍, 等. 金属硫蛋白在参环毛蚓不同组织中的表达研究[J]. 中国药房 , 2012, 23 (15) :1345–1347. |
| [9] | 李维, 李薇, 吴文如, 等. 4种重金属对参环毛蚓金属硫蛋白诱导特性的研究[J]. 中国药房 , 2013, 24 (15) :1348–1350. |
| [10] | Radtke F, Heuchel R, Georgiev O, et al. Cloned transcription factor MTF-1 activates the mouse metallothionein Ⅰ promoter[J]. EMBO J , 1993, 12 (4) :1355–1362. |
| [11] | Andrews G K. Regulation of metallothionein gene expression by oxidative stress and metal ions[J]. Biochem Pharmacol , 2000, 59 (1) :95–104. DOI:10.1016/S0006-2952(99)00301-9 |
| [12] | Wimmer U, Wang Y, Georgiev O, et al. Two major branches of anti-cadmium defense in the mouse: MTF-1/metallothioneins and glutathione[J]. Nucl Acids Res , 2005, 33 (18) :5715–5727. DOI:10.1093/nar/gki881 |
| [13] | Sturzenbaum S R, Georgiev O, Morgan A J, et al. Cadmium detoxification in earthworms: from genes to cells[J]. Environ Sci Technol , 2004, 38 (23) :6283–6289. DOI:10.1021/es049822c |
| [14] | Scudiero R, Carginale V, Capasso C, et al. Strucural and functional analysis of metal regulatory alaments in the promoter region of genes encoding metallothionein isoforms in the Antarctic fish Chionodraco hamatus (icefish)[J]. Gene , 2001, 274 (1/2) :199–208. |
 2016, Vol. 47
2016, Vol. 47


