民间常认为中药汤剂应趁热服下,否则疗效降低。中药汤剂是热服更好还是冷服更好,尚未有研究报道。本研究采用溃疡性结肠炎(ulcerative colitis,UC)大鼠为模型,研究服用温度对葛根芩连汤疗效的影响。
葛根芩连汤出自东汉张仲景的《伤寒杂病论》,由葛根、黄芩、黄连和炙甘草组成,主治表证未解、邪热入里症[1]。UC是一种慢性非特异性肠炎,在中医中属于泄泻、痢疾等范畴。刘河间《原病式》指出:“诸泻痢皆属于湿,湿热甚于肠胃之内,而肠胃怫郁,以致气液不得宣通而成”,可将UC归为中医的湿热病[2]。
基于多年来对于葛根芩连汤治疗UC的临床应用和观察,证实葛根芩连汤对UC具有较好的疗效[3-4];同时对汤药饮用时的温度,中医素有讲究,例如“湿热证的汤剂应冷服”的医嘱,汤药冷、热时服用的效果可因病证而异。本研究以葡聚糖硫酸钠(DSS)诱导大鼠UC模型,以不同温度的葛根芩连汤对UC大鼠进行ig给药,并对给药后的大鼠进行疾病活动指数(DAI)评分,观察给药前后病理学改变及髓过氧化物酶(MPO)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷光甘肽过物氧化酶(GHS-Px)、肿瘤坏死因子-α(TNF-α)的变化,以探讨不同温度对葛根芩连汤发挥药效的影响,为临床应用提供参考。
1 材料 1.1 动物雄性SD大鼠50只,体质量(200±10)g,由浙江省实验动物研究中心提供,生产许可证号SCXK(Z2014-0001)。
1.2 药物与试剂葛根芩连汤组方药材葛根、黄芩、黄连、甘草、干姜饮片均由北京市双桥燕京中药饮片厂提供,由福建中医学院杨成梓教授鉴定,分别为豆科植物野葛Pueraria lobata (Wild.) Ohwi的干燥根、唇形科植物黄芩Scuterllaria baicalensis Georgi.的干燥根、毛茛科植物黄连Coptis chinensis Franch.的干燥根、豆科植物甘草Glycyrrhiza uralensis Fisch.干燥根茎(蜜炙)、姜科植物姜Zingiber officinale Rosc.的干燥根茎;柳氮磺吡啶片(批号20131017)由上海中西三维药业有限公司提供;DSS由MP Biomedicals生物医学公司提供;GHS-Px、SOD、MPO、MDA、TNF-α试剂盒均购自南京建成生物工程研究所。
1.3 仪器SpectraMax M4多功能酶标仪(Molecular Devices);电子天平(Mettler Toledo);高速离心机(日本Hitachi Koki公司);冷冻切片机(美国Leica公司)。
2 方法 2.1 葛根芩连汤的制备葛根36 g、黄芩13.5 g、黄连13.5 g、甘草9 g、干姜2.25 g,加600 mL水,浸泡30 min,大火煮40 min,6层纱布滤过,滤液浓缩至150 mL(经测定含葛根素12.84 mg/mL、黄芩苷38.30 mg/mL、小檗碱19.07 mg/mL、黄连碱6.34 mg/mL)。
2.2 动物分组、造模与给药将50只SD雄性大鼠,随机分为5组,即对照组、模型组、阳性药(柳氮磺吡啶片)组、葛根芩连汤高温组(42℃)、葛根芩连汤低温组(10℃)。除对照组外,其余4组大鼠给予3% DSS水溶液自由饮用,连续7 d,建立UC大鼠模型;造模成功后,阳性药组ig给予柳氮磺吡啶片180 mg/kg,每日1次;葛根芩连汤高温组与低温组分别ig给予葛根芩连汤10 mL/kg(生药剂量4.95 g/kg,相当于人临床等效剂量,每次给药的汤剂及灌胃针均由水浴严格控制温度,所给汤剂每天现煎煮),每日1次;模型组ig给予蒸馏水,所有大鼠给药7 d。
2.3 一般情况观察实验过程观察大鼠的精神状态,毛发光泽,活动状态,大便颜色、性状,是否有脓血便,体质量及进食量等情况变化。对大鼠进行DAI评定,评分标准参照Mtwano等[5]文献方法。
2.4 肉眼观察结肠黏膜损伤程度及进行形态学评分治疗7 d后处死大鼠,取近肛门8 cm处结肠组织,沿纵轴剪开结肠,进行大体损伤评分。参考Luk等[6]所述标准进行结肠黏膜大体形态损伤评分。同时计算肠壁厚度,参考Carmuesco等[7]所述,计算公式:肠壁厚度=结肠质量(g)/结肠长度(cm)。
2.5 结肠黏膜组织病理学观察大鼠病变结肠组织(每只大鼠取距肛门相同距离处同一部位结肠组织标本)甲醛固定后,冷冻切片,进行HE染色,光镜下观察炎症浸润情况,并进行拍照对比。参考Dieleman等[8]所述的标准根据溃疡损伤的深度、范围、修复及炎症程度进行评分。
2.6 血清和结肠组织的生化指标测定实验结束后大鼠ip 1%戊巴比妥麻醉,打开腹腔,利用促凝剂分离胶真空采血管于腹主动脉处取血,室温放置30 min,1 200×g离心10 min,取血清待测。
取近肛门10 cm处结肠组织,沿纵轴剪开,冰生理盐水冲洗粪便,称取结肠组织0.3 g,以生理盐水研磨制成10%的组织匀浆液,离心后提取上清液,−20℃保存。血清及结肠组织中SOD、MDA、MPO、GHS-Px、TNF-α均严格按照试剂盒说明书方法测定。
2.7 统计方法采用SPSS 17.0统计学软件进行统计分析,计量资料数据以表示,组间比较采用单因素方差分析(ANOVA)及t检验。
3 结果 3.1 DAI比较对照组大鼠饮水、进食正常,无明显体质量下降,无腹泻、便血等异常改变。模型组DAI评分明显高于对照组(P<0.01)。药物治疗后,葛根芩连汤组及阳性药物组均显示出明显的治疗效果;而葛根芩连汤低温组、阳性药组均恢复到与对照组相当水平(P>0.05),但葛根芩连汤高温组DAI评分仍显著高于对照组(P<0.05)。葛根芩连汤低温组与高温组相比虽无显著性差异,但低温组DAI评分更低。见表 1。
|
|
表 1 各组大鼠DAI评分及结肠组织损伤评分(x±s, n=10) Table 1 Score of DAI and colonic tissue injury of rats in each group (x±s, n=10) |
3.2 结肠形态和病理学改变
结肠肉眼形态学观察可见对照组结肠组织无明显损伤;模型组结肠黏膜充血、水肿,广泛糜烂,多处溃疡形成,有的形成深大溃疡;阳性药组结肠黏膜轻度充血、水肿,未见明显溃疡形成,伴少量炎性细胞浸润;葛根芩连汤高、低温组结肠黏膜均存在轻度充血、水肿,未见明显溃疡形成,伴少量炎性细胞浸润;但较阳性药组略显严重,与模型组比较则有明显改善。
镜下病理学观察结果如图 1所示,对照组上皮完整,黏膜下血管正常,腺体及杯状细胞排列整齐,无中性粒细胞、淋巴细胞浸润及溃疡形成;模型组黏膜缺损严重,腺体破坏、消失,杯状细胞减少,大量炎性细胞浸润,隐窝缺损明显;阳性药组肠壁增厚,黏膜局部有脱落现象,有中性粒细胞、淋巴细胞浸润;葛根芩连汤高温组腺体呈不同程度扩张,黏膜局部脱落,杯状细胞缺失,有中性粒细胞、淋巴细胞浸润;葛根芩连汤低温组结肠黏膜上皮有缺失,腺管排列较整齐,极向明显,散见少量淋巴细胞及中性粒细胞。
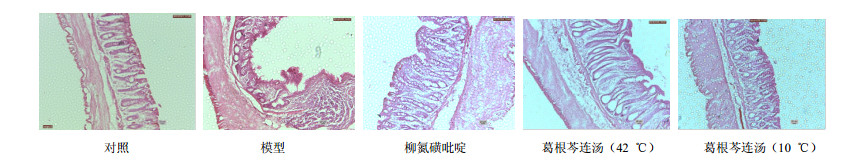
|
图 1 各组大鼠结肠组织病理学观察 Fig.1 Pathological observation on colon tissue of rats in each group |
对结肠形态及病理损伤进行评分,结果模型组组织大体评分和病理组织学评分均显著高于对照组(P<0.01);阳性药组大体评分和病理组织学评分较模型组显著下降(P<0.01),葛根芩连汤高温组、低温组病理组织学评分较模型组显著下降(P<0.05、0.01);葛根芩连汤低温组大体评分及病理学评分都较高温组低,且病理学评分具有显著性差异(P<0.05)。
模型组和各药物干预组的肠壁厚度均高于对照组(P<0.05);葛根芩连汤低温组、阳性药组肠壁厚度显著薄于模型组,而葛根芩连汤高温组与模型组无显著性差异;低温组与高温组相比具有显著性差异(P<0.05),低温组肠壁更薄,见表 1。
3.3 血清和结肠组织生化指标变化各组大鼠血清和结肠组织匀浆中GHS-Px、SOD、MPO、MDA、TNF-α水平见表 2和3。
|
|
表 2 各组大鼠血清中GSH-Px、SOD活性和MPO、MDA、TNF-α水平比较(x±s, n=10) Table 2 Comparison on activities of GSH-Px and SOD and levels of MPO, MDA, and TNF-αin serum of rats in each group (x±s, n=10) |
|
|
表 3 各组大鼠结肠组织中GSH-Px、SOD活性和MPO、MDA水平比较(x±s, n=10) Table 3 Comparison on activities of GSH-Px and SOD and levels of MPO, MDA in colon tissue of rats in each group (x±s, n=10) |
由表 2可知,与对照组比较,模型组血清GSH-Px、SOD活性明显降低(P<0.01),MDA、MPO及TNF-α水平明显升高(P<0.05),表明造模成功。与模型组比较,葛根芩连汤低温组GSH-Px、SOD活性显著升高(P<0.05、0.01),MPO和MDA水平显著降低(P<0.05、0.01);而葛根芩连汤高温组只有SOD活性及MDA水平有显著性变化(P<0.05、0.01)。葛根芩连汤低温组与高温组相比,无统计学差异,但低温组各项指标都优于高温组。
由表 3可知,与对照组比较,模型组结肠组织的GSH-Px、SOD活性降低,MDA和MPO水平显著升高(P<0.05、0.01)。与模型组比较,葛根芩连汤低温组GSH-Px、SOD活性升高及MDA水平显著降低(P<0.05);葛根芩连汤高温组GSH-Px、SOD活性显著升高(P<0.05、0.01)。低温组与高温组相比,无统计学差异,但是低温组各项指标优于高温组。
4 讨论本实验采用3% DSS水溶液给予SD大鼠自由饮用,成功复制出与人类临床和病理表现均极为相似的UC模型,模型组大鼠在饮用DSS 7 d后出现腹泻、稀便、脓血便,活动、进食均明显减少,镜下观察肠黏膜破损,大量炎性细胞浸润,溃疡形成,DAI和组织学评分显著升高,与对照组相比,差异具有统计学意义,说明造模成功。治疗组大鼠给予不同温度的葛根芩连汤治疗后,结肠炎症状减轻,其对应的DAI值和组织学评分及各项生化指标显著优于模型组,表明葛根芩连汤对DSS诱导大鼠形成的UC症状具有明显的治疗作用。
观察不同温度的葛根芩连汤对UC大鼠各项指标的影响,结果显示,低温组在病理组织学评分、肠壁厚度和生化指标上均明显好于高温组,表明10℃的葛根芩连汤ig给药对UC大鼠的治疗效果要明显优于高温组。在UC模型上,葛根芩连汤冷服效果优于热服。
虽有研究表明UC的病因和免疫、遗传、感染、应激等多种因素有关,但其发病机制尚不完全明确。近年来有研究表明,广泛分布于人体胃肠道的肥大细胞在UC的发病中起着相当重要的作用。例如,在UC的发生发展中,通常伴随溃疡性结肠组织中的黏膜层、黏膜下层肥大细胞的数目明显增加。研究[7-9]发现炎症性肠病病人炎症性区域的肥大细胞数目增加,多可增加达十几倍。同时,越来越多的证据表明,肥大细胞分泌的各种炎症因子在介导肠道炎症中发挥了重要作用[10-12]。此外,已知升高温度会增加肥大细胞的应激反应。例如,Mortaz等[13]发现对来源于小鼠骨髓的肥大细胞进行43℃热休克,会诱导炎症介质半胱氨酰白三烯分泌增多,进而促进TNF-α及活性氧等的释放,最终表现为炎症加剧。在本研究中42℃服用的葛根芩连汤同样可能对胃肠道黏膜附近的肥大细胞造成热应激,诱导炎症介质和其他炎症因子的释放,并最终削弱了治疗效果。据此,上述葛根芩连汤冷服、热服的不同疗效可能与肠道肥大细胞的应激反应有关。
肥大细胞受应激而激活的机制有多种,主要有免疫机制与非免疫机制。免疫机制主要是由IgE介导,每个肥大细胞膜表面约有3×105个高亲和力IgE受体,IgE可介导肥大细胞激活脱颗粒,释放组胺、炎症因子等。而非免疫机制主要指肥大细胞直接受到一些化学、物理(如温度、压力等)等因素刺激,主要有Toll样受体(TLRs)通道[14]、香草素瞬时受体电位(TRPV2)通道[15]等。Mortaz等[13]对肥大细胞进行直接物理应激,其机制主要是热应激产生热休克蛋白(HSP70),HSP70蛋白通过Toll样受体4(TLR4)通道使肥大细胞激活,从而使炎症介质半胱氨酰白三烯分泌增多。在本研究中42℃服用的葛根芩连汤相对10℃服用药效减弱,可能也通过类似机制起效果。
本研究初步探讨了葛根芩连汤给药温度对实验性UC大鼠疗效的影响,结果显示冷服葛根芩连汤相较热服具有更好的治疗效果,在一定程度上契合了传统中医对于“湿热证的汤剂应冷服”的临床经验[16]。上述结果是否具有普适性,即服用温度是否影响其他中药汤剂的疗效,尚需更多研究。
| [1] | 杨连柱. 葛根芩连汤临证应用体会[J]. 北京中医药大学学报:中医临床版 , 2003, 10 (4) :46–48. |
| [2] | 刘大铭, 王新月. 难治性溃疡性结肠炎中医病因病机探讨[J]. 中医杂志 , 2011, 52 (24) :2156–2157. |
| [3] | 贺佳蓓, 杨向东. 葛根芩连汤加减治疗大肠湿热型溃疡性结肠炎的疗效观察[J]. 四川中医 , 2013, 31 (1) :104–105. |
| [4] | 王家华. 葛根芩连汤治疗溃疡性结肠炎的疗效观察[J]. 现代医药卫生 , 2011, 27 (22) :3462. |
| [5] | Mtwano M, Maemura K, Hirata I, et al. Therapeutic effect of intracolonically administered nuclear factor kappa B (p65) anti-sense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis[J]. Clin Exp lmmunol , 2000, 120 (1) :51–58. DOI:10.1046/j.1365-2249.2000.01183.x |
| [6] | Luk H H, Ko J K, Fung H S, et al. Delination of the protective action of zinc sulfate on ulcerative colitis in rat[J]. Eur J Pharmacol , 2002, 443 (1/3) :197–204. |
| [7] | Carmuesco D, Galvez J, Nieto A, et al. Dietary olive oil supplemented with fish oil, rich in EPA and DHA(n-3) polyunsaturated fatty acids, attenuates colonic inflammation in rats with DSS-induced colitis[J]. J Nutr , 2005, 135 (4) :687–694. |
| [8] | Dieleman L A, Palmen M J, Akol H, et al. Chronic expertimental colitis induced by dextral sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines[J]. Clin Exp Immunol , 1998, 114 (3) :385–391. DOI:10.1046/j.1365-2249.1998.00728.x |
| [9] | Dvorak A M, Monahan R A, Osage J E, et al. Crohn's disease: transmission electron microscopic studies. Ⅱ. Immunologic inflammatory response. Alterations of mast cells, basophils, eosinophils, and the microvasculature[J]. Hum Pathoi , 1980, 11 (6) :606–619. DOI:10.1016/S0046-8177(80)80072-4 |
| [10] | King T, Biddle W, Bhatia P, et al. Colonic mucosal mast cell distribution at line of demarcation of active ulcerative colitis[J]. Dig Dis Sci , 1992, 37 (4) :490–495. DOI:10.1007/BF01307568 |
| [11] | Nishida Y, Murase K, Isomoto H, et al. Different distribution of mast cells and macrophages in colonic mucosa of patients with eollagenous colitis and inflammatory bowel disease[J]. Hepatogastroenterology , 2002, 49 (45) :678–682. |
| [12] | Furusu H, Murase K, Nishida Y, et al. Accumulation of mast cells and macrophages in focal active gastritis of patients with Crohn's disease[J]. Hepatogastroenterology , 2002, 49 (45) :639–643. |
| [13] | Mortaz E, Redegeld F A, Dunsmore K, et al. Stimulation of cysteinyl leukotriene production in mast cells by heat shock and acetylsalicylic acid[J]. Eur J Pharmacol , 2007, 561 (1/3) :214–219. |
| [14] | Brzezińska-Błaszczyk E, Wierzbicki M. Mast cell Toll-like receptors (TLRs)[J]. Postepy Hig Med Dosw , 2010, 64 (840537) :11–21. |
| [15] | Zhang D, Spielmann A, Wang L, et al. Mast-cell degranulation induced by physical stimuli involves the activation of transient-receptor-potential channel TRPV2[J]. Physiol Res , 2012, 61 (1) :113–124. |
| [16] | 张娟娟, 张帅. 口服中药汤剂的服药指导[J]. 中国误诊学杂志 , 2007, 7 (4) :673. |
 2016, Vol. 47
2016, Vol. 47


