P-糖蛋白(P-glycoprtein,P-gp)为20世纪80年代发现的由人体多药耐药基因1(MDR1)基因编码的跨膜转运蛋白[1],其能在ATP酶水解释放出能量的驱动下将异源性物质“泵”出细胞外(外排功能),从而降低细胞内的药物浓度[2-3]。白芷为我国大宗常用中药材品种之一,具有祛风散寒、燥湿排脓、止痛等功效[4]。而其中含有的香豆素类化合物是一类重要的有效成分,具有抗肿瘤、抗病毒、抗凝血、止血、平喘、保护血管和抗骨质疏松等作用[5]。本课题组前期研究了白芷香豆素类化合物(欧前胡素、异欧前胡素、佛手柑内酯、氧化前胡素)在Caco-2细胞的跨膜转运,结果表明欧前胡素、异欧前胡素、氧化前胡素能促进长春新碱透过Caco-2细胞单层转运,佛手柑内酯对长春新碱透过Caco-2细胞单层转运有抑制作用[6]。本研究通过研究白芷香豆素类化合物对ATP酶活性的影响,进而探讨其对P-gp功能的影响,为阐明白芷香豆素类化合物与其他药物的相互作用提供依据。
1 材料多功能酶标仪(VariosKan Flash,Thermo Fisher Scinentific,美国);未经处理的96孔板(美国Corning公司);P-gp-GloTM检测体系(由P-gp膜、ATP检测基质、ATP检测缓冲液、P-gp检测缓冲液、维拉帕米、Mg-ATP、矾酸钠等组成,均来自美国Promega公司);二甲基亚砜(北京索来宝科技有限公司);佛手柑内酯对照品(上海亿欣生物科技有限公司,批号10042131);氧化前胡素对照品(上海融禾医药科技发展有限公司,批号100420);欧前胡素对照品(批号110826-200712)、异欧前胡素对照品(批号110827-200407),中国食品药品检定研究院,以上各对照品质量分数均≥98%。
2 方法 2.1 ATP酶标准曲线的建立制备Mg-ATP标准液,将Mg-ATP溶解于P-gp检测缓冲液中,使Mg-ATP标准液系列浓度分别为30、15、7.5、3.75 mmol/L,各取10μL加入96孔板。在检测前加入ATP酶检测液,使终浓度分别为3、1.5、0.75、0.375 mmol/L。最后用多功能酶标仪测得其荧光强度值,将荧光强度值与ATP浓度进行线性回归分析,绘制ATP标准曲线。
2.2 工作液的制备用P-gp检测缓冲液稀释维拉帕米、矾酸钠、Mg-ATP与P-gp膜,使最终浓度分别为0.5、0.25、25、1.25 mmol/L。
将待测药物溶解于P-gp检测缓冲液中,制备2.5倍浓度。在检测荧光前加入ATP检测液,使各药物终质量浓度分别为欧前胡素10、5、1μg/mL;异欧前胡素10、5、1μg/mL;佛手柑内酯10、5、1μg/mL;氧化前胡素20、5、1μg/mL;以上药物质量浓度均依据MTT实验结果确定。
2.3 ATP活性检测(1)添加20μL P-gp检测缓冲液到标有“NT”的孔中(空白);(2)添加20μL 0.5 mmol/L矾酸钠到标有“矾酸钠”和“ATP标准”的孔中;(3)将0.25 mmol/L维拉帕米添加到标有“Ver”的孔中;(4)添加2.5倍浓度的各测试化合物20μL至标有“TC”的孔中;(5)添加1.25 mmol/L P-gp膜20μL至各孔,在37℃孵育5 min;(6)除“ATP标准”孔外,其他孔加入25 mmol/L Mg-ATP各10μL,37℃孵育40 min;(7)在下一步操作的2 min前,添加Mg-ATP标准液至“ATP标准”相应的孔中;(8)从37℃孵育箱中取出96孔板,停止反应,每孔添加ATP检测试剂各50μL;(9)将96孔板放在振动筛上混合,在室温孵育20 min,使之产生荧光信号;(10)使用酶标仪检测,读取荧光强度值。
2.4 数据处理[6]计算矾酸钠组平均荧光强度值(RLU矾酸钠)与空白组平均荧光强度值(RLUNT)的差值,得到ΔRLUbasal,反映基础P-gp ATP酶活性。计算RLU矾酸钠与测试化合物组平均荧光强度值(RLUTC)的差值,得到ΔRLUTC,反映存在受试化合物的情况下P-gp ATP酶的活性。
如果RLUTC<RLUNT,则受试化合物可诱导P-gp ATP酶活性;如果RLUNT<RLUTC≤RLU矾酸钠,则受试化合物可抑制P-gp ATP酶活性;如果RLUTC=RLUNT,则受试化合物对P-gp ATP酶无作用。
如果ΔRLUTC>ΔRLUbasal,则受试化合物为P-gp ATP酶活性刺激物;如果ΔRLUTC=ΔRLUbasal,则受试化合物对P-gp ATP酶活性无影响;如果ΔRLUTC<ΔRLUbasal,则受试化合物是P-gp ATP酶活性抑制剂。
采用SPSS 19.0软件进行统计分析,数据以荧光强度值表示,组间采用配对样本t检验分析。
3 结果 3.1 ATP标准曲线ATP标准曲线为Y=5.665 847 11×106 X+1.75×106,R2=0.993 2。结果表明,荧光强度值与ATP浓度呈线性关系,且相关性较好。如果反应消耗ATP,将会产生较弱的信号,反映ATP的浓度相对较低;如果不消耗ATP,荧光信号将相对较强。
3.2 各对照组荧光强度本实验的空白组、阳性对照组(维拉帕米)及阴性对照组(矾酸钠)的荧光强度值如图 1所示。空白组的荧光强度比矾酸钠组的低,反映了P-gp ATP酶活性的基础水平。矾酸钠是一种P-gp选择性抑制剂,经矾酸钠处理的样品没有P-gp ATP酶活性,所以矾酸钠处理组被选为阴性对照。维拉帕米是P-gp的底物,可以激活P-gp ATP酶活性,所以被选为阳性对照底物。维拉帕米组的荧光强度值小于矾酸钠组,即维拉帕米可激活P-gp ATP酶活性。
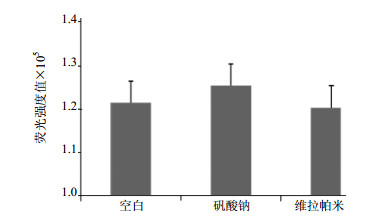
|
图 1 各对照组的荧光强度值(x±s, n=3) Fig.1 Fluorescence intensity of each control group (x±s, n=3 |
3.3 测试药物组的荧光强度
不同质量浓度测试药物组的荧光强度值结果见表 1。
|
|
表 1 不同质量浓度测试化合物的荧光强度值(x±s, n=3) Table 1 Fluorescence intensity of tested compounds at different concentration (x±s, n=3) |
3.4 受试物对P-gp ATP酶活性的影响以及与基础荧光强度值的比较
各受试物对P-gp ATP酶活性的影响通过ΔRLUTC与ΔRLUbasal的比较来反映,结果见图 2。欧前胡素和氧化前胡素ΔRLUTC均大于ΔRLUbasal,推测这2种化合物对P-gp有诱导作用;且这2组的RLU值都小于维拉帕米组,由此推测在反应过程中消耗的ATP较少,与P-gp的亲和力较弱;每种化合物的高、中、低3个质量浓度的RLU值均无明显差异,可推测其对P-gp的诱导作用无浓度依赖性。中、低质量浓度异欧前胡素及高、低质量浓度佛手柑内酯ΔRLUTC均小于ΔRLUbasal,推测其可能是ATP酶抑制剂,能够抑制P-gp的活性;可推测其对P-gp的抑制作用为浓度依赖型。经典的P-gp抑制剂维拉帕米与P-gp的亲和力较高,与P-gp结合时消耗ATP,所以使得剩余ATP的量较少,测得荧光强度较弱。另外,高质量浓度的异欧前胡素、中质量浓度的佛手柑内酯,其ΔRLUTC大于ΔRLUbasal,由此可推测出这2种化合物在此质量浓度时对P-gp有诱导作用。
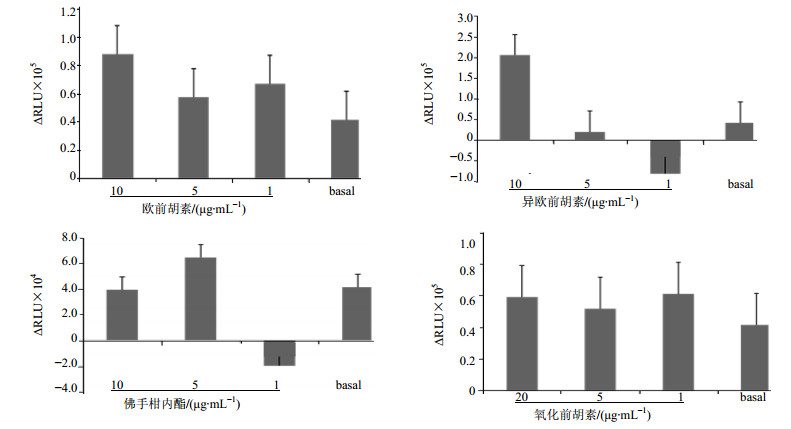
|
图 2 各待测化合物对P-gp ATP酶活性的影响及与基础荧光值的比较 Fig.2 Effects of tested compounds on P-gp ATPase activity and their comparison with basal fluorescence value |
4 讨论
P-gp是一种能量依赖性转运蛋白,能利用ATP水解释放的能量主动地将疏水亲脂性药物转运至细胞外,分布于人体很多正常组织,如肠道、肝、肾、胎盘屏障的上皮细胞,其对药物的吸收、分布、代谢、排泄均有重要影响。在药物的相互作用和多药耐药的产生中发挥着重要作用。
P-gp可使细胞内药物浓度低于起效浓度而产生多药耐药,降低药物疗效。为了逆转P-gp引起的多药耐药,目前已开发出许多P-gp调节剂(如维拉帕米、环孢菌素A、他莫昔芬等)。而中医临床及实验研究表明,中医方药可增加化疗的治疗效果,中药及其单体成分可逆转肿瘤的多药耐药性,如广泛存在于植物中的黄酮类成分槲皮素是P-gp的底物,可竞争P-gp,从而影响ATP发挥作用,进而抑制P-gp的外排功能[8]。因此,充分了解药物之间在P-gp环节可能产生的相互作用,对于寻找促进药物的转运和吸收的手段,提高药物疗效具有重要意义。
在本实验中,采用ATP酶活性测试法,基于ATP产生的荧光信号强度,通过考察待测试药物对ATP酶的活性的影响来确定其是否通过干扰ATP酶活性而阻断了P-gp的功能。P-gp依赖的荧光信号的降低反映了P-gp对ATP的消耗,信号强度降低的程度越大,P-gp的活性越强。
体外实验显示,P-gp介导的底物转运需要依靠ATP水解释放能量形成底物的浓度梯度。P-gp与底物结合后,ATP酶的活性可提高3~4倍,甚至20倍[9]。底物所致ATP酶活性的改变是双向性的,有一些物质在高浓度时起抑制作用,却在低浓度时可以增强ATP酶的活性,而另一些药物对ATP酶的增强作用存在浓度依赖性。对P-gp ATP酶活性的诱导与抑制作用都是化合物与P-gp相互作用的指标。本研究结果表明,欧前胡素、异欧前胡素、佛手柑内酯和氧化前胡素均为P-gp底物,其中,欧前胡素及氧化前胡素为非浓度依赖性的ATP酶诱导剂;异欧前胡素和佛手柑内酯为浓度依赖的ATP酶双向调节因子,高质量浓度的异欧前胡素、中质量浓度的佛手柑内酯可诱导ATP酶活性,对P-gp具有诱导作用,中、低质量浓度的异欧前胡素及高、低质量浓度的佛手柑内酯对P-gp具有抑制作用。
| [1] | Chan L M, Lowes S, Hirst B H. The ABCs of drug transport in intestine and liver: efflux proteins limiting drug absorption and bioavailability[J]. Eur J Pharm Sci , 2004, 21 (1) :25–51. DOI:10.1016/j.ejps.2003.07.003 |
| [2] | Pleban K, Kopp S, Csaszar E, et al. P-glycoprotein substrate binding domains are located at the transmembrane domain/transmembrane domain interfaces: a combined photoaffinity labeling-protein homology modeling approach[J]. Mol Pharmacol , 2005, 67 (2) :365–374. |
| [3] | Gottesman M M, Pastan I. Biochemistry of multidrug resistance mediated by the multidrug transporter[J]. Annu Rev Biochem , 1993, 62 :385–427. DOI:10.1146/annurev.bi.62.070193.002125 |
| [4] | 中国药典[S].一部. 2015. |
| [5] | 李苏宁, 杨秀伟. 6个线型呋喃香豆素类化合物在人源肠Caco-2细胞模型的吸收转运研究[J]. 中草药 , 2011, 42 (1) :96–102. |
| [6] | 管雪静, 余世平, 廖正根, 等. 白芷中10种呋喃型香豆素对长春新碱肠道转运的影响[J]. 中草药 , 2015, 46 (14) :2117–2121. |
| [7] | 戴立波, 方平飞, 蔡骅琳, 等. P-糖蛋白与中枢抑制药物相互作用的体外研究[J]. 中国医院药学杂志 , 2012, 32 (12) :919–923. |
| [8] | Wang X, Morris M E. Effect of the flavonoid chrysin on nitofurantoin pharmacokinetics in rats; potential involvement of ABCG2[J]. Drug Metab Dispos , 2007, 35 (2) :268–274. |
| [9] | Al-Shawi M K, Polar M K, Omote H, et al. Transition stat e analysis of the coupling of dr ug transport to ATP hydrolysis by P-glycoprotein[J]. J Biol Chem , 2003, 278 (52) :52629–52640. DOI:10.1074/jbc.M308175200 |
 2016, Vol. 47
2016, Vol. 47


