2. 南京中医药大学 江苏省中药资源产业化过程协同创新中心, 江苏 南京 210023 ;
3. 南京中医药大学 江苏省植物药深加工工程研究中心, 江苏 南京 210029
2. Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, Nanjing University of Chinese Medicine, Nanjing 210023, China ;
3. Jiangsu Botanical Medicine Refinement Engineering Research Center, Nanjing University of Chinese Medicine, Nanjing 210029, China
黄连解毒汤是清热解毒方中的经典方剂,首载于晋朝葛洪《肘后备急方•卷十二•治伤寒时气温病门》,但未出方名。唐代王焘《外台秘要•卷一》引《崔氏方》始冠名为黄连解毒汤。随着研究的不断深入,人们发现其在治疗脑源性疾病方面具有极大的潜力。现代研究发现,小檗碱为黄连解毒汤的主要药效成分之一,能通过血脑屏障进入脑组织。Wang等[1]采用尾iv给予大鼠黄连提取物后,对海马进行检测发现,小檗碱能迅速入脑(t1/2α=0.215 h),且滞留时间长,消除缓慢;Regmi等[2]采用尾iv和鼻腔同时给予大鼠小檗碱,发现2种给药方式均能使小檗碱迅速入脑。现代药理学研究亦发现,小檗碱能改善脑缺血、缺氧,缩小梗死范围[3-8];在脑部疾病的治疗方面,小檗碱的这一性质为黄连解毒汤治疗脑部疾病提供了保障。然而,中药复方是历代医家在长期的医疗实践中经验和智慧的结晶,小檗碱作为黄连解毒汤中君药黄连和佐药黄柏的主要药效成分,其在复方配伍条件下的药动学研究对于揭示黄连解毒汤的作用特点和作用规律具有重要参考价值。基于此,本研究选择小檗碱、组合药物(小檗碱+黄芩苷+栀子苷,黄连解毒汤中的3种主要药效成分)和黄连解毒汤全方作为研究对象,比较复方配伍条件对小檗碱在大鼠脑组织中药动学的影响,以期发现黄连解毒汤治疗脑部疾病的药效物质基础,为黄连解毒汤治疗脑部疾病的剂型改进与新药设计提供实验依据。
1 材料 1.1 药品与试剂对照品盐酸小檗碱(质量分数86.7%,批号110713-201212)、延胡索乙素(质量分数98%,批号110726-200409)均购自中国食品药品检定研究院;黄连Coptidis Rhizoma(产地四川,批号131203)、黄柏Phellodendri Cortex(产地四川,批号131202)、黄芩Scutellariae Radix(产地内蒙古,批号131202)、栀子Gardeniae Fructus(产地江西,批号130416)均购自安徽亳州市中药饮片厂,经南京中医药大学生药学教研室吴启南教授鉴定,均符合《中国药典》2015年版规定;盐酸小檗碱提取物(质量分数98%,批号ZL20150965)、栀子苷提取物(质量分数91%,批号ZL20150923)、黄芩苷提取物(质量分数98%,批号ZL20150834)均购自南京泽朗医药科技有限公司;水合氯醛(分析纯,国药集团化学试剂有限公司);甲醇(色谱纯,江苏汉邦科技有限公司);乙腈(色谱纯,美国默克公司);甲酸(分析纯,南京化学试剂有限公司);乙酸铵(分析纯,国药集团化学试剂有限公司);氯化钠注射用水(批号140709,安徽双鹤药业有限责任公司);水为超纯水(自制);其余试剂均为分析纯。
1.2 仪器超高效液相色谱-QDa质谱检测仪/ACQUITY系统(美国Waters公司),Libro AEL-40SM十万分之一电子分析天平(日本岛津);Centri Vap型离心浓缩仪(美国Labconco公司);涡旋混合器(北京踏锦科技有限公司);低温高速离心机(美国赛默飞);移液器(德国Eppendor公司);E6/10-8G型超细匀浆器(上海弗鲁克流体机械制造有限公司);−80℃超低温冰箱(美国赛默飞)。
1.3 动物雄性SD大鼠,体质量250~270 g,由上海杰思捷动物有限公司提供,清洁级,合格证号SCXK2013-0006。
2 方法 2.1 黄连解毒汤的制备及给药剂量的确定根据本课题组前期优选的工艺条件提取黄连解毒汤[9],得到复方中水提物粉末(得率23.33%)。黄连解毒汤给药剂量为全方生药16.8 g/kg(相当于全方提取物3.92 g/kg)。黄连解毒汤全方提取物中小檗碱、黄芩苷、栀子苷的质量分数分别为6.19%、3.25%、2.62%,而小檗碱、黄芩苷、栀子苷提取物质量分数分别为98%、98%、91%,计算得小檗碱、黄芩苷、栀子苷提取物的给药剂量分别为247.39、130.11、113.01 mg/kg。分别精密称取一定量的黄连解毒汤全方水提物以及对应量的小檗碱、黄芩苷、栀子苷提取物置于研钵中,加入少量0.5%的羧甲基纤维素钠(CMC-Na)溶液,研磨均匀后,配成黄连解毒汤、小檗碱单体和组合药物(小檗碱+黄芩苷+栀子苷)混悬液,给药体积为20 mL/kg。
2.2 给药与样品采集180只SD大鼠随机分成3组,即小檗碱单体组、组合药物组和黄连解毒汤组,每组60只大鼠。大鼠给药前禁食12 h,自由饮水;各组均ig给予相应剂量的药物混悬液,分别于给药后0.083、0.25、0.5、1、2、4、6、8、12、24 h,每组随机取6只大鼠,以10%水合氯醛(0.4 mL/kg)ip麻醉大鼠,迅速处死大鼠后快速取出脑组织,脑组织用生理盐水洗净,并用镊子将肉眼可见的血丝,包裹在脑组织上的薄膜挑拣干净,滤纸吸干表面水分,称质量,于−80℃冰箱保存待测。
2.3 大鼠脑组织样品中小檗碱定量测定 2.3.1 色谱条件色谱柱为Acquity UPLC BEH C18(50 mm×2.1 mm,1.7μm);流动相为10 mmol/L乙酸铵-0.1%甲酸水(A)-乙腈(B),梯度洗脱程序:0~0.3 min,30% B;0.3~1 min,30%~60% B;1~3.5 min,60% B;3.5~4 min,60%~30% B;4~5 min,30% B;体积流量为0.5 mL/min;进样量10μL,柱温30℃;内标法峰面积定量。
2.3.2 质谱条件Waters四级杆质谱仪(QDa),离子化方式电喷雾离子化(ESI),选择性监测离子扫描模式(SIR);主要质谱参数为毛细管电压0.8 kV,锥孔电压15 V,脱溶剂温度600℃。小檗碱及延胡索乙素检测离子的选择(m/z):小檗碱(ES+,336.04);延胡索乙素(ES+,356.12)。
2.3.3 样品处理大鼠脑组织解冻后,精确称质量,每克脑组织加4 mL生理盐水,冰浴中匀浆。取100μL匀浆液置于1.5 mL的EP管中,加入100μL内标延胡索乙素对照液(50 ng/mL),加入400μL甲醇沉淀蛋白,立即涡旋振摇1 min,于低温(4℃)高速离心机中以16 000 r/min高速离心10 min。取上清液,于40℃条件下,离心浓缩仪浓缩,残留物用100μL混合溶液(0.1%甲酸水-甲醇5:5)溶解涡旋混匀,以16 000 r/min低温(4℃)高速离心10 min,取上清液,作为样品液,备用。
2.3.4 对照品溶液的制备精密称取适量盐酸小檗碱对照品,置于25 mL量瓶中,甲醇定容,配制成0.1 mg/mL盐酸小檗碱储备液;精密量取盐酸小檗碱储备液,倍比稀释,得到5 000 ng/mL的盐酸小檗碱对照品溶液,于4℃保存;采用相同方法制备质量浓度为50 ng/mL的延胡索乙素内标溶液。
2.3.5 专属性考察在本实验条件下,分别对空白脑组织匀浆液、空白脑组织匀浆液+小檗碱对照品、空白脑组织匀浆液+内标及小檗碱单体组给药后大鼠脑组织匀浆液样品+内标进样分析,结果盐酸小檗碱和延胡索乙素均有较强的色谱峰和很好的分离度,空白脑组织匀浆也中未检测到盐酸小檗碱及内标物延胡索乙素,说明本方法具有较好的专属性,盐酸小檗碱和延胡索乙素的保留时间分别为3.887、3.772 min。HPLC色谱图见图 1。
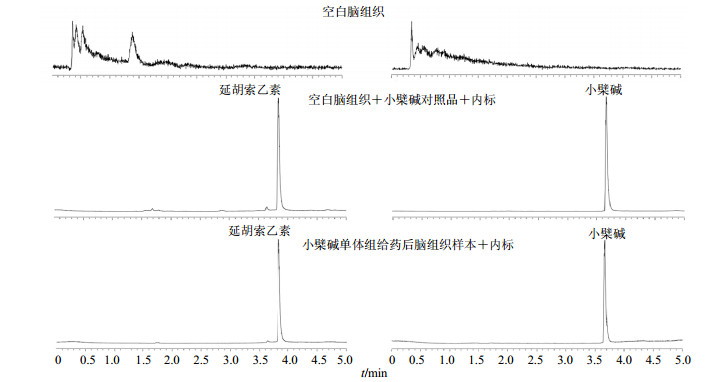
|
图 1 脑组织中指标性成分UPLC图 Fig.1 UPLC of index compounds in brain tissue |
2.3.6 线性关系考察
分别取7份空白脑组织,置1.5 mL离心管中,向空白脑组织中加入不同质量浓度的盐酸小檗碱对照品溶液100μL,配成含盐酸小檗碱1、5、10、25、50、100、400 ng/mL的组织样品,按“2.3.3”项进行样品处理后,依法测定。以盐酸小檗碱与内标延胡索乙素的峰面积之比为纵坐标(Y),以质量浓度为横坐标(X),作图,进行线性回归,得回归方程Y=0.013 5 X+0.007 1,线性范围为1~400 ng/mL,R2=0.999 9,最低检测限(LOQ)为1 ng/mL。
2.3.7 提取回收率在空白脑组织样品中加入已知量的盐酸小檗碱对照品,制成高、中、低质量浓度为100、50、5 ng/mL的样品,每个质量浓度样品制备5份,按“2.3.3”项方法进行样品处理后,依法测定。另取空白脑组织样品,按“2.3.3”项方法进行样品处理,离心后得上清液,分别加入与上述相应质量浓度的对照品溶液,离心浓缩仪浓缩,残留物用100μL混合溶液复溶,处理后依法测定。以2种方法测得的盐酸小檗碱峰面积比值来计算提取回收率。高、中、低质量浓度脑组织样品中小檗碱的提取回收率分别为(98.52±2.02)%、(97.43±1.27)%、(98.19±2.99)%,RSD分别为7.54%、2.65%、8.35%,符合生物样品分析规定。
2.3.8 基质效应取大鼠空白脑组织样品,按“2.3.3”项下操作,不加内标,挥干后加入盐酸小檗碱对照品,加流动相溶解残渣,使终质量浓度为5、25、100 ng/mL,每个质量浓度进样5次,记录峰面积为A1;另取盐酸小檗碱对照品,挥干,加流动相溶解残渣,使终质量浓度同上,每个质量浓度进样5次,记录峰面积为A2,以A1/A2的值作为基质效应的考察指标。内标同法进行考察。结果:盐酸小檗碱低、中、高3个质量浓度下A1/A2的值分别为(104.44±2.08)%、(95.57±3.06)%、(86.26±2.24)%;延胡索乙素低、中、高3个质量浓度下A1/A2的值分别为(94.30±3.09)%、(89.27±2.88)%、(86.81±1.24)%。无论小檗碱还是延胡索乙素在脑组织中低、中、高3个质量浓度下,A1/A2的值都在85%~115%,表明无基质效应。
2.3.9 精密度考察在空白脑组织样品中加入已知量的盐酸小檗碱对照品,制成高、中、低质量浓度的样品溶液,质量浓度分别为100、25、5 ng/mL,按“2.3.3”项进行样品处理后,各样品于日内重复测定5次,计算日内精密度;连续测定3 d,每天1次,计算日间精密度。结果表明,盐酸小檗碱低、中、高3个质量浓度的日内精密度RSD分别为1.86%、4.62%、1.70%;日间精密度RSD分别为4.92%、5.43%、2.91%,符合规定。
2.3.10 稳定性试验在空白脑组织样品中加入已知量的盐酸小檗碱对照品,制成高、中、低质量浓度的样品溶液,质量浓度分别为100、25、5 ng/mL,按“2.3.3”项方法处理,分别在常温放置0、12、24 h后测定。结果表明,盐酸小檗碱低、中、高3个质量浓度的RSD分别为1.85%、1.65%、1.73%;同法,分别配制高、中、低3种质量浓度样品溶液,置于−80℃冰箱中冷藏1周,用37℃恒温水浴反复冻融3次,按“2.3.3”项方法处理,依法测定。结果表明,盐酸小檗碱低、中、高3个质量浓度的RSD分别为2.91%、2.64%、1.91%。
2.4 统计学处理小檗碱脑药浓度数据均采用药动学计算程序DAS 2.1处理,计算药动学参数,数据以表示,组间比较采用t检验。
3 结果大鼠分别ig给予小檗碱、组合药物(小檗碱+黄芩苷+栀子苷)、黄连解毒汤组后,脑组织的药物浓度-时间曲线见图 2,药动学参数见表 1。
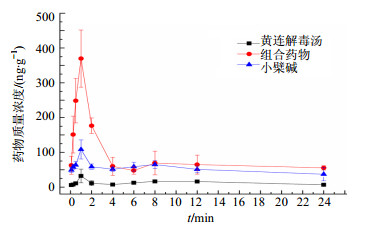
|
图 2 小檗碱在大鼠脑组织中浓度-时间曲线(x±s, n=5) Fig.2 Concentration-time curves of berberine in brain tissue of rats (x±s, n=5) |
|
|
表 1 小檗碱在大鼠脑组织中的主要药动学参数(x±s, n=5) Table 1 Main pharmacokinetic parameters of berberine in brain tissue of rats (x±s, n=5) |
由图 2结果可知,小檗碱能迅速吸收进入脑组织,5 min时在大鼠脑组织中可检测到小檗碱。表 1的药动学参数表明,在小檗碱组、组合药物组和黄连解毒汤组中,小檗碱均1 h达到最大脑药浓度,Cmax分别为108.012、368.587、31.967 ng/g;与小檗碱组相比,组合药物组中小檗碱在脑内的药物质量浓度显著增加,远大于黄连解毒汤原方给药中小檗碱的入脑浓度;组合药物组的AUC0~∞(3 236.60 min·ng/g)远大于小檗碱组的AUC0~∞(2 701.37 min·ng/g)和黄连解毒汤组AUC0~∞(420.34 min·ng/g)。小檗碱在脑组织中的药动学行为与在血浆中并不一样,前期研究表明在大鼠血浆中,与小檗碱组相比,黄连解毒汤组能促进小檗碱吸收入血,组合药物组没有明显的促进作用[10]。
由图 2可知,脑组织的药-时曲线出现双峰现象。本课题组在前期的药动学研究中也发现,小檗碱的血药浓度-时间曲线呈二次吸收的特征,其原因可能为药物在体内存在肝肠循环或其他循环过程,结合型态小檗碱分解转变为游离小檗碱后的吸收峰,多部位吸收等原因导致出现双峰现象[11-15]。但是,小檗碱在脑组织中出现的双峰现象是否与血液中出现的双峰现象有关,还有待进一步研究。
4 讨论中药复方所含化学成分复杂,各成分之间产生协同或拮抗作用,共同发挥复方的治疗作用。本课题组在前期研究中发现[16-17],黄连解毒汤中的黄芩苷对小檗碱的吸收有抑制作用,栀子苷可促进小檗碱的吸收,而三者合用后栀子苷可削弱黄芩苷对小檗碱吸收的抑制作用;在脑缺血模型大鼠中,小檗碱对栀子苷的吸收几乎没有什么影响,而黄芩苷能促进栀子苷的吸收,三者合用后小檗碱可以减弱黄芩苷对栀子苷的抑制作用。王静等[18]研究也发现,分别给大鼠ig盐酸小檗碱单体和含有相同剂量盐酸小檗碱的黄连提取物、黄连-吴茱萸药对提取物后,与盐酸小檗碱单体相比,黄连提取物吸收与消除较快,但最大吸收(Cmax)没有太大变化,由此推测黄连药材中的其他成分能加速盐酸小檗碱的吸收和消除;与黄连提取物相比较,黄连-吴茱萸药对配伍后吴茱萸促进了盐酸小檗碱的吸收。
上述研究结果提示,复方配伍环境对药物的吸收具有显著性影响。而复方配伍环境下的药动学特征是中药复方体内过程的真实体现,亦是阐明复方药效物质基础的有效研究途径之一。在本课题组前期对黄连解毒汤进行系统研究的基础上,以黄连解毒汤君药黄连和佐药黄柏的主要药效成分小檗碱为研究对象,探讨不同复方配伍环境下小檗碱在大鼠脑组织中的药动学特征,研究结果表明:与小檗碱单体给药组相比,组合药物组能促进小檗碱进入脑组织,而黄连解毒汤组抑制小檗碱进入脑组织。黄连解毒汤传统用药方式为汤剂口服给药,前期的肠道吸收研究表明,小檗碱可通过调控肠道激素分泌、调整肠道菌群结构、改善肠道能量代谢影响肠道功能,在大鼠肠道微生物作用下小檗碱通过脱甲基、脱羟基、去亚甲基等反应转化为小檗红碱、药根碱等多种代谢产物[19-20]。血脑屏障的完整性和通透性的波动取决于肠道菌的组成和多元性,在这种情况下,研发以肠道微生物为标靶疗法——增加药物输送所需的血脑屏障的通透性,或可矫正与治疗在许多神经退行性疾病中扮演重要角色的血脑屏障的功能障碍[21]。
本研究结果表明,黄连解毒汤治疗脑部疾病的合理药物组合不是各味药主要药效成分的简单加和,应从检测比较血液、脑脊液、病灶部位药效成分及肠道吸收影响等多维角度出发,确定该方治疗脑部疾病的药效组合和用药剂量。该研究结果为后期针对脑部疾病的中药复合粒子剂型设计和新药研发奠定基础。
| [1] | Wang X L, Wang R F, Xing D M, et al. Kinetic difference of berberine between hippocampus and plasma in rat after intravenous administration of Coptidis rhizoma extract[J]. Life Sci , 2005, 77 (24) :3058–3067. DOI:10.1016/j.lfs.2005.02.033 |
| [2] | Regmi B, Yuan Y H, Kou J P, et al. Plasma and hippocampal pharmacokinetics of berberine after intravenous or intranasal administration in rats[J]. Pharm Biotechnol , 2007, 14 (5) :348–355. |
| [3] | 吴彦, 孙建宁, 张爱林, 等. 黄连解毒汤有效部位对实验性脑缺血的保护作用[J]. 中药材 , 2004, 27 (5) :357–360. |
| [4] | 吴俊芳, 刘少林, 潘鑫鑫, 等. 小檗碱对培养大鼠神经细胞"缺血"性损伤的保护作用[J]. 中国药理学通报 , 1999, 15 (3) :243–246. |
| [5] | 陈春花, 胡琴, 杨磊, 等. 小檗碱对局部脑缺血组织中HIF-1α表达的影响[J]. 解剖学报 , 2007, 8 (4) :394–399. |
| [6] | 吴俊芳, 史以菊, 刘天培. 小檗碱对小鼠及大鼠脑缺血的保护作用[J]. 中国药理与毒理学杂志 , 1995, 9 (2) :100–103. |
| [7] | 汤依群, 戴德哉, 赵健, 等. 氯苄四氢小檗碱对小鼠缺氧大脑线粒体的保护作用[J]. 中国药理与毒理学杂志 , 1996, 10 (1) :31–33. |
| [8] | 玛丽众, 肖培根, 郭宝林. 几种中药成分对脑组织的保护作用[J]. 中国中药杂志 , 1999, 24 (4) :238–239. |
| [9] | Zeng M F, Pan L M, Zhu H X, et al. Comparative pharmacokinetics of baicalin in plasma after oral administration of Huang-Lian-Jie-Du-Tang or pure baicalin in MCAO and sham-operated rats[J]. Fitoterapia , 2010, 81 (6) :490–496. DOI:10.1016/j.fitote.2010.01.004 |
| [10] | 王文哲.基于系统模拟的黄连解毒汤抗脑缺血的整合PK-PD研究[D].南京:南京中医药大学, 2014. |
| [11] | 朱华旭, 张新龙, 曾明飞, 等. 黄连解毒汤中小檗碱在脑缺血模型大鼠体内药动学与药效学相关性研究[J]. 中草药 , 2012, 43 (3) :546–550. |
| [12] | Deng Y, Liao Q, Li S, et al. Simultaneous determination of berberine, palmatine, and jatrorrhizine by liquid chromatography-tandem mass spectrometry in rat plasma and its application in a pharmacokinetic study after oral administration of Coptis-Evodiaherb couple[J]. J Chromatogr B Analyt Technol Biomed Life Sci , 2008, 863 (2) :95–205. |
| [13] | 肖学凤, 乔晓莉, 高岚, 等. 黄连解毒汤中三种成分在大鼠体内的药代动力学研究[J]. 中国医药导报 , 2008, 5 (3) :13–17. |
| [14] | 吴晓霞.黄连解毒汤三种生物碱在糖尿病大鼠体内的药代动力学研究[D].北京:中国中医科学院, 2006. |
| [15] | 赵玉男, 邢东明, 丁怡, 等. 解热药YL2000中小檗碱在正常和发热大鼠体内的药物代谢动力学比较[J]. 中国药学通报 , 2003, 19 (10) :1170–1173. |
| [16] | 王文哲, 周静, 郭立玮, 等. 黄连解毒汤中小檗碱及其他成分模拟组合在脑缺血大鼠体内药动学比较研究[J]. 中草药 , 2014, 45 (1) :64–68. |
| [17] | Pan L M, Wang W Z, Shi F Y, et al. Exploratory pharmacokinetics of geniposide in rat model of cerebral ischemia orally administered with or without baicalin and/or berberine[J]. Evidence-Based Compl Alter Med , 2013 . DOI:10.1155/2013/349531 |
| [18] | 王静, 袁子民, 张振秋. 黄连、吴茱萸药对中盐酸小檗碱在大鼠体内的药代动力学研究[J]. 药物分析杂志 , 2009, 29 (5) :755–759. |
| [19] | 姚霜霜, 张翼飞, 张志国, 等. 小檗碱改善代谢性疾病的肠道相关机制[J]. 国际内分泌代谢杂志 , 2014, 34 (6) :386–389. |
| [20] | 李梦, 徐佳, 赵梅, 等. UPLC-Q-TOFMS/MS联用技术分析大肠道微生物体外对小檗碱的代谢产物[J]. 信阳师范学院学报:自然科学版 , 2014, 27 (4) :510–514. |
| [21] | Brainite V, Al-Asmakh M, Kowal C. The gut microbiota influences blood-brain barrier permeability in mice[J]. Sci Trans Med , 2014, 6 (266) :1–11. |
 2016, Vol. 47
2016, Vol. 47


