2. 池州市九华山黄精研究所, 安徽 池州 242800 ;
3. 温州新特医药有限公司, 浙江 温州 325000
2. Jiuhua Mountain Research Institute of Polygonatum in Chizhou City, Chizhou 242800, China ;
3. Wenzhou Xinte Medicine Co., Ltd., Wenzhou 325000, China
炎症是由烧伤、病原体入侵和化学刺激物等作用于机体而引起的复杂的生物学反应,炎症因子的过度表达往往会导致各种急性或慢性的炎症性疾病[1-3]。炎症因子的过度表达在多种疾病(如脓毒症、溃疡性结肠炎、糖尿病、类风湿性关节炎)的发病过程中起重要作用[4]。几个比较重要的炎症因子如肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)被认为是治疗上述疾病的重要分子靶点。在盲肠结扎穿孔手术诱导的脓毒症休克模型中,抑制炎症因子TNF-α和IL-6的分泌能够缓解大鼠的脓毒性死亡[5]。在临床上靶向抑制炎症因子TNF-α的表达能够缓解类风湿性关节炎[6]。同时,炎症细胞如肥大细胞、淋巴细胞和巨噬细胞释放的炎症因子被认为是炎症性紊乱的重要介质[7]。抑制巨噬细胞释放的炎症因子已经成为当前药物发现的焦点,并成为评价药物抗炎活性的一个重要方法。
姜黄素是一种从自然界广泛存在的姜黄的根茎中提取的天然活性酚类化合物,具有抗氧化、抗肿瘤、抗凝、抗炎、抗动脉粥样硬化、调血脂等多种生物学活性[8]。但是姜黄素由于其结构中的β-二酮基团导致其存在结构不稳定、生物利用度低和体内代谢快等缺点[9-10],限制了其在临床中的进一步应用。为了获得结构稳定的姜黄素类似物,国内外学者尝试了多种方法,也得到了多个活性化合物[11-13]。其中结构稳定的单羰基姜黄素类似物备受广大学者的青睐,Weng等[14]合成了一批单羰基姜黄素类似物,它们具有显著的抗肿瘤活性,其中化合物22[(1E, 4E)-1, 5-bis[3-methoxy-4-(3-morpholinopropoxy) phenyl] penta-1, 4-dien-3-one,图 1]表现出显著的抗炎活性。本实验利用脂多糖(LPS)刺激巨噬细胞释放炎症因子为细胞模型,探讨化合物22的抗炎活性,并且探讨其抗炎机制,为炎症类疾病的治疗提供候选化合物。
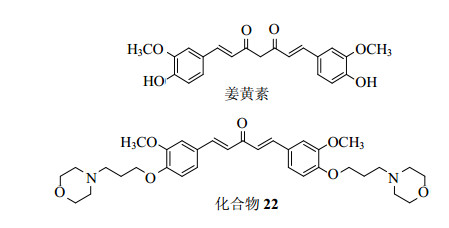
|
图 1 姜黄素及其单羰基姜黄素类似物22的化学结构 Fig.1 Chemical structures of curcumin and its mono-carbonyl |
1 材料 1.1 药品与试剂
RPMI 1640培养基、FBS(Gibco);青链霉素混合液(Hyclone);可溶性淀粉(Solarbio);LPS(Sigma);MTT粉末(广州斯佳科技有限公司);DMSO(Solarbio);鼠IL-6、TNF-αELISA试剂盒(eBioscience);姜黄素(国药集团化学试剂有限公司,F20111027,分析纯);姜黄素类似物化合物22由本课题组合成,HPLC测定质量分数99.2%;M-MLV逆转录试剂盒、RT-qPCR引物(Invitrogen);SYBR Green PCR Premix HS Taq(Bio-rad);p-ERK、ERK、IκBα和GAPDH(Santacruz);p-P38、P38、p-JNK和JNK(Cell Signaling Technology)。
1.2 仪器CO2细胞培养箱、细胞超净台、低温离心机、超低温冰箱(Thermo);酶标仪(Spectra max M2);电泳仪、曝光仪、RT-qPCR仪、PCR仪(Bio-rad);正置相差显微镜(Nikon);水浴锅(Sumsuny)。
1.3 动物ICR雄性小鼠,体质量20~22 g,购自上海斯莱克实验动物中心,动物使用许可证号SYXK(浙)2009-0129。
2 方法 2.1 姜黄素及化合物22稳定性考察用DMSO将姜黄素及化合物22配成1 mmol/L的母液,然后用磷酸盐缓冲液(PBS,pH 7.4)稀释化合物22浓度到20μmol/L,取100μL加入到比色皿中,用酶标仪在25℃、250~600 nm波长处扫描化合物的吸光度(A)值,总共检测25 min,每隔5 min检测1次。
2.2 淀粉肉汤的制备按照每100毫升淀粉肉汤溶液中含有淀粉0.3 g、氯化钠1 g、蛋白胨0.5 g、牛肉膏6 g的比例配制淀粉肉汤溶液50 mL,在100℃沸水中搅拌均匀至溶液清澈透明,后用0.22μm的微孔过滤器滤过除去不溶性颗粒。
2.3 原代巨噬细胞的提取采用ip给药的方式,每只小鼠给予1.5~2.0 mL配制好的淀粉肉汤溶液。普通洁净级实验室饲养3 d后,处死并提取腹腔巨噬细胞。将所得腹腔巨噬细胞1 000 r/min离心3 min,更换RPMI 1640完全培养基均匀铺在6孔板中,每孔细胞按照5×105的密度铺盘。4 h后去除培养基以无菌的PBS冲洗,去除悬浮的非贴壁细胞,再次更换为RPMI 1640完全培养基,在37℃CO2恒温培养箱培养过夜。
2.4 MTT实验原代巨噬细胞按照4 000个/孔的密度接种于96孔板中,用含10% FBS的RPMI 1640完全培养基进行培养,待细胞贴壁过夜,换液,实验设DMSO组和化合物22给药组(浓度分别为1.25、2.5、5、10、20μmol/L),药物作用24 h后,观察细胞存活情况,并在每孔中加入25μL MTT(5 mg/mL),置于37℃、5% CO2培养箱中孵育4 h,吸取上清,留下结晶,用DMSO溶解结晶,室温下避光振荡10 min后在酶标仪490 nm处测定A值。
2.5 酶联免疫吸附(ELISA)法测定细胞上清液中炎症因子水平原代巨噬细胞按照5.0×105个/孔的密度接种于6孔板中,用含10% FBS的RPMI 1640完全培养基进行培养,待细胞贴壁过夜,换液,设置阴性对照组(DMSO)、模型组(LPS刺激)和给药组,给药组细胞预孵育姜黄素(10μmol/L)或不同浓度(2.5、5、10μmol/L)的化合物22 30 min后,加入0.5μg/mL LPS刺激细胞24 h后收集细胞培养基和总蛋白。用ELISA法检测细胞培养基中的IL-6和TNF-α的量,并且用同一培养皿中的总蛋白质量浓度进行定量。
2.6 qRT-PCR检测原代巨噬细胞中炎症基因表达原代巨噬细胞按照5.0×105个/孔的密度接种于6孔板中,用含10% FBS的RPMI 1640完全培养基进行培养,待细胞贴壁过夜,换液,设置阴性对照组(DMSO)、模型组(LPS刺激)和化合物22给药组,给药组细胞预孵育10μmol/L的化合物22 30 min后,加入0.5μg/mL LPS刺激细胞6 h后收集细胞总RNA,采用qRT-PCR实验技术检测细胞中的炎症基因IL-1β、IL-6、IL-12和TNF-α表达,并且以β-actin基因为管家基因。各引物的序列如下:IL-1β正向引物5’-ACTCCTTAGTCCTCGGCCA-3’,反向引物5’-CCATCAGAGGCAAGGAGGAA-3’;IL-6正向引物5’-GAGGATACCACTCCCAACAGA-CC-3’,反向引物5’-AAGTGCATCATCGTTGTTCAT-ACA-3’;IL-12正向引物5’-GGAAGCACGGCAG-CAGAATA-3’,反向引物5’-AACTTGAGGGAGAA-GTAGGAATGG-3’;TNF-α正向引物5’-TGGAA-CTGGCAGAAGAGG-3’,反向引物5’-AGACAG-AAGAGCGTGGTG-3’;β-actin正向引物5’-TGGA-ATCCTGTGGCATCCATGAAAC-3’,反向引物5’-TAAAACGCAGCTCAGTAACAGTCCG-3’。
2.7 Western blotting法检测原代巨噬细胞中ERK/JNK及NF-κB信号通路相关蛋白原代巨噬细胞按照1.0×106个/孔的密度接种于6孔板中,用含10% FBS的RPMI 1640完全培养基进行培养,待细胞贴壁过夜,换液,细胞预孵育不同浓度(2.5、5、10、20μmol/L)的化合物22 30 min后,加入0.5μg/mL LPS刺激细胞20 min后收集细胞总蛋白,采用Western blotting实验技术检测细胞中ERK、P38和JNK的磷酸化以及IκBα的降解。
2.8 统计学方法数据采用表示,采用GraphPad Prism 6.0进行作图,用Student’s t test进行统计学分析。
3 结果 3.1 化合物22的稳定性由于天然产物姜黄素的化学结构不稳定及体内代谢快等缺点限制了其临床应用,因此在体外条件下研究了姜黄素及化合物22的稳定性,实验结果见图 2。从图中可以看出在最大吸收峰处姜黄素在25 min内随着时间的增加,A值逐渐下降,说明姜黄素不稳定易降解;化合物22在25 min内最大吸收峰处的A值没有发生变化,这说明化合物22在检测时间内没有发生降解。表明化合物22比姜黄素要稳定。
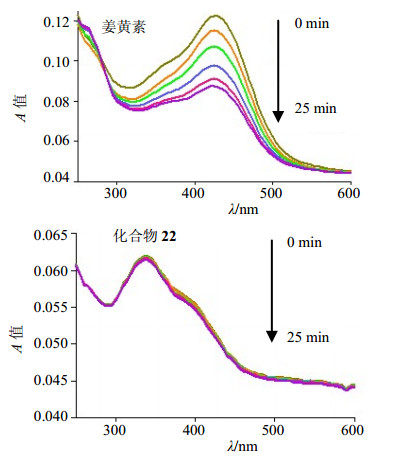
|
图 2 姜黄素和化合物22的稳定性 Fig.2 Stability of curcumin and compound 22 |
3.2 化合物22的细胞毒性
在进行细胞实验之前,首先对化合物的细胞毒性进行检测,实验结果见图 3,与对照组(DMSO)相比,不同浓度(1.25、2.5、5、10、20μmol/L)的化合物22作用于细胞24 h后,均不能引起明显的细胞毒性,说明化合物22在检测浓度范围内对细胞是无毒的。
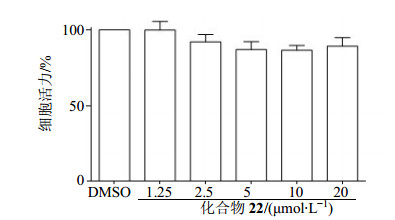
|
图 3 化合物22的细胞毒性(x±s, n=3) Fig.3 Cytotoxicity of compound 22 (x±s, n=3) |
3.3 化合物22具有显著的抗炎活性
在体外细胞实验中,采用LPS刺激原代巨噬细胞释放炎症因子IL-6和TNF-α为细胞模型评价化合物22的抗炎活性。从图 4可以看出,化合物22能够剂量依赖性地抑制LPS诱导的IL-6的释放,且在较低浓度2.5μmol/L时就能表现出比先导物姜黄素更强的抑制活性;对于LPS诱导的TNF-α释放,化合物22在低浓度时没有表现出抑制TNF-α释放的活性,但是在10μmol/L时对TNF-α释放的抑制活性明显优于先导物姜黄素。表明化合物22具有显著的抗炎活性。
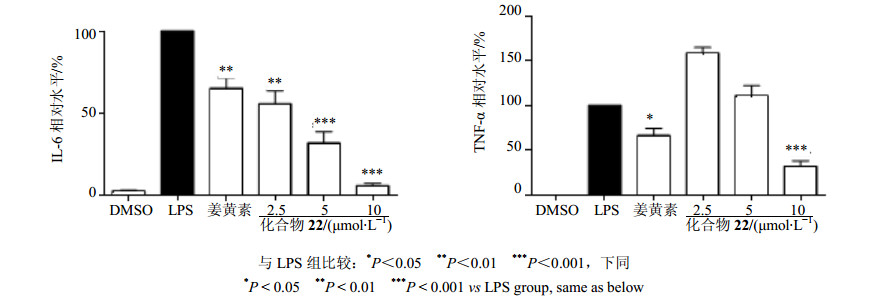
|
图 4 化合物22对LPS诱导的小鼠原代巨噬细胞IL-6和TNF-α释放的影响(x±s, n=3) Fig.4 Effect of compound 22 on LPS-induced production of IL-6 and TNF-αin peritoneal macrophages of mice (x±s, n=3) |
3.4 化合物22抑制LPS诱导的炎症基因表达
除了上述实验中检测的IL-6和TNF-α,在炎症相关性疾病中炎症因子IL-1β和IL-12也同样起重要的作用。从表 1可以看出,LPS能显著地诱导炎症因子IL-1β、IL-6、IL-12和TNF-α的基因表达,预孵育化合物22以后,能明显抑制LPS诱导的炎症基因表达,且具有统计学差异(P<0.05、0.01),说明化合物22能够抑制LPS诱导的炎症基因表达。
|
|
表 1 化合物22对LPS诱导的小鼠原代巨噬细胞炎症基因表达的影响(x±s, n=3) Table 1 Effect of compound 22 on LPS-induced expression of inflammatory gene in peritoneal macrophages of mice (x±s, n=3) |
3.5 化合物22的抗炎机制
LPS作用于机体后,与细胞膜上的TLR4受体结合,启动TLR4下游的信号通路,其中MAPK和核因子-κB(NF-κB)是2条比较经典的TLR4下游信号通路,调控LPS诱导的炎症反应[15]。因此本实验在细胞层面上研究化合物22对MAPK信号通路磷酸化和NF-κB激活的影响,实验结果见图 5。从图中可以看出,加入LPS刺激后能明显诱导MAPK 3个亚基ERK、P38和JNK的磷酸化以及IκBα的降解,预孵育不同浓度的化合物22后,能剂量依赖性地抑制ERK和JNK的磷酸化以及IκBα的降解,但是对LPS诱导的P38的磷酸化没有抑制活性。表明化合物22是通过影响ERK、JNK和NF-κB信号通路发挥抗炎活性的。
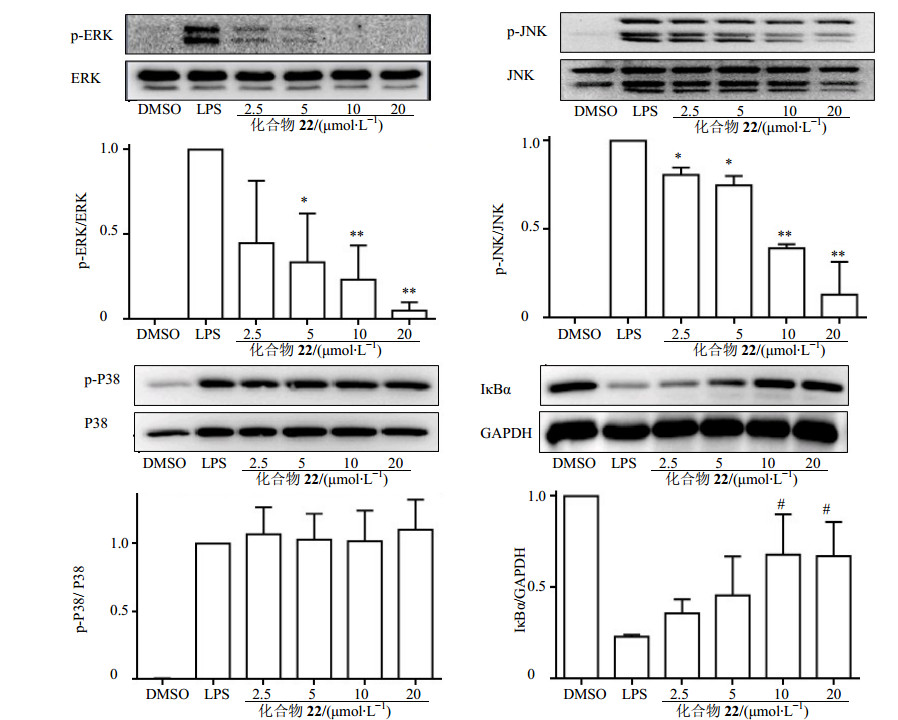
|
图 5 化合物22的抗炎机制(x±s, n=3) Fig.5 Anti-inflammatory mechanism of compound 22 (x±s, n=3) |
4 讨论
姜黄素是从姜黄的根茎中提取的天然活性酚类化合物,具有抗炎、抗氧化、抗肿瘤等多种生物学活性,尤其具有较强的抗炎活性[8]。报道指出,在小鼠巨噬细胞中姜黄素能够剂量依赖性地抑制LPS诱导的炎症因子TNF-α和IL-6的释放[16]。然而姜黄素的代谢缺陷使得国内外学者对其结构进行改造,得到了很多具有抗炎活性的姜黄素类似物。在所有的姜黄素类似物中,单羰基姜黄素类似物具有比姜黄素更好的代谢稳定性和生物利用度且无毒副作用[13, 17-20]。本研究中化合物22具有比姜黄素更强的稳定性,且与姜黄素相比在相同浓度下对炎症因子TNF-α和IL-6的抑制活性更强。
LPS是革兰阴性菌细胞壁的主要活性成分,能够与细胞膜表面的TLR4受体结合启动下游的信号通路[21]。MAPK信号通路由丝/苏氨酸蛋白激酶组成,包括3个具有不同亚型的独立家庭成员,它们分别是ERK、P38和JNK,当LPS刺激细胞后触发TLR4信号通路,进而活化MAPK信号通路的3个成员,发生磷酸化作用[15]。姜黄素能够通过抑制ERK1/2和P38信号通路降低Aβ诱导的小角质神经细胞炎症反应[22]。姜黄素类似物22能够显著地抑制LPS诱导的ERK和JNK磷酸化,但是对P38的磷酸化没有抑制活性。表明姜黄素类似物22发挥抗炎活性的机制涉及ERK和JNK信号通路。
NF-κB是一种重要的多效性核转录因子,可与多种基因启动子部位的κB位点发生特异性结合而促进其转录表达[23]。在正常状态下NF-κB与IκB以复合物的形式存在于细胞质中,当受到外来刺激如病原体LPS入侵后,IκB发生磷酸化作用,进而IκB发生泛素化被蛋白酶体降解,从而释放NF-κB使其由细胞质进入到细胞核内,与细胞核内的DNA结合启动基因的转录诱导炎症介质的释放[23]。Poylin等[24]报道指出姜黄素作为NF-κB的抑制剂能够抑制脓毒症诱导的肌肉蛋白酶水解。本实验中发现姜黄素类似物22能够抑制LPS诱导的IκB蛋白的降解作用,表明姜黄素类似物22能够通过抑制LPS诱导IκB降解,阻断NF-κB信号通路发挥抗炎活性。
综上,本实验证实了单羰基姜黄素类似物22较姜黄素具有更稳定的性质并且能够有效抑制炎症反应。本研究还阐明了化合物22通过抑制ERK和JNK磷酸化和阻断NF-κB信号通路从而抑制炎症反应的分子机制。由于化合物22具有稳定的结构、较高的安全性能,良好的抗炎效果,因此单羰基姜黄素类似物22具有很好的开发前景。
| [1] | Bone R C, Balk R A, Cerra F B, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis[J]. Chest , 1992, 101 (6) :1644–1655. DOI:10.1378/chest.101.6.1644 |
| [2] | Annane D, Bellissant E, Cavaillon J M. Septic shock[J]. Lancet , 2005, 365 (9453) :63–78. DOI:10.1016/S0140-6736(04)17667-8 |
| [3] | Dellinger R P, Levy M M, Carlet J M, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2008[J]. Intens Care Med , 2008, 34 (1) :17–60. DOI:10.1007/s00134-007-0934-2 |
| [4] | Calixto J B, Campos M M, Otuki M F, et al. Anti-inflammatory compounds of plant origin. Part Ⅱ. modulation of pro-inflammatory cytokines, chemokines and adhesion molecules[J]. Planta Med , 2004, 70 (2) :93–103. DOI:10.1055/s-2004-815483 |
| [5] | Maciel M C, Fialho E M, Guerra R N, et al. Tityus serrulatus scorpion venom improves survival and lung inflammation in lethal sepsis induced by CLP in mice[J]. Toxicon:Offic J Int Soc Toxinol , 2014, 89 :1–8. DOI:10.1016/j.toxicon.2014.06.018 |
| [6] | Saraux A, Benichou J, Guillevin L, et al. Which patients with rheumatoid arthritis, spondyloarthritis, or juvenile idiopathic arthritis receive TNF-alpha antagonists in France? The CORPUS cohort study[J]. Clin Exper Rheumatol , 2015, 33 (5) :602–610. |
| [7] | Ghaffar O, Lavigne F, Kamil A, et al. Interleukin-6 expression in chronic sinusitis: colocalization of gene transcripts to eosinophils, macrophages, T lymphocytes, and mast cells[J]. Otolaryngol-head Neck Surg , 1998, 118 (4) :504–511. DOI:10.1016/S0194-5998(98)70209-8 |
| [8] | Hu J, Zhang Y, Dong L, et al. Design, synthesis, and biological evaluation of novel quinazoline derivatives as anti-inflammatory agents against lipopolysaccharide-induced acute lung injury in rats[J]. Chem Biol Drug Des , 2015, 85 (6) :672–684. DOI:10.1111/cbdd.2015.85.issue-6 |
| [9] | Grogan G. Emergent mechanistic diversity of enzyme-catalysed beta-diketone cleavage[J]. Biochem J , 2005, 388 (3) :721–730. DOI:10.1042/BJ20042038 |
| [10] | 刘佳, 黄宇虹, 王保和, 等. 姜黄素类化合物体内代谢途径及其代谢产物的研究进展[J]. 现代药物与临床 , 2015, 30 (12) :1553–1557. |
| [11] | Zhang Y, Jiang X, Peng K, et al. Discovery and evaluation of novel anti-inflammatory derivatives of natural bioactive curcumin[J]. Drug Des Dev Ther , 2014, 8 :2161–2171. |
| [12] | Liang G, Yang S, Zhou H, et al. Synthesis, crystal structure and anti-inflammatory properties of curcumin analogues[J]. Eur J Med Chem , 2009, 44 (2) :915–919. DOI:10.1016/j.ejmech.2008.01.031 |
| [13] | Patwardhan R S, Checker R, Sharma D, et al. Dimethoxycurcumin, a metabolically stable analogue of curcumin, exhibits anti-inflammatory activities in murine and human lymphocytes[J]. Biochem Pharmacol , 2011, 82 (6) :642–657. DOI:10.1016/j.bcp.2011.06.024 |
| [14] | Weng Q, Fu L, Chen G, et al. Design, synthesis, and anticancer evaluation of long-chain alkoxylated mono-carbonyl analogues of curcumin[J]. Eur J Med Chem , 2015, 103 :44–55. DOI:10.1016/j.ejmech.2015.08.036 |
| [15] | Byun E B, Sung N Y, Park J N, et al. Gamma-irradiated resveratrol negatively regulates LPS-induced MAPK and NF-kappaB signaling through TLR4 in macrophages[J]. Int Immunopharmacol , 2015, 25 (2) :249–259. DOI:10.1016/j.intimp.2015.02.015 |
| [16] | Guimaraes M R, Leite F R, Spolidorio L C, et al. Curcumin abrogates LPS-induced pro-inflammatory cytokines in RAW 264.7 macrophages. Evidence for novel mechanisms involving SOCS-1, -3 and p38 MAPK[J]. Arch Oral Biol , 2013, 58 (10) :1309–1317. DOI:10.1016/j.archoralbio.2013.07.005 |
| [17] | Zhao C, Liu Z, Liang G. Promising curcumin-based drug design: mono-carbonyl analogues of curcumin (MACs)[J]. Curr Pharm Des , 2013, 19 (11) :2114–2135. |
| [18] | Selvam C, Jachak S M, Thilagavathi R, et al. Design, synthesis, biological evaluation and molecular docking of curcumin analogues as antioxidant, cyclooxygenase inhibitory and anti-inflammatory agents[J]. Bioorg Med Chem Lett , 2005, 15 (7) :1793–1797. DOI:10.1016/j.bmcl.2005.02.039 |
| [19] | 姜程曦, 林良义, 宋娇, 等. 姜黄素类似物抑制炎症反应缓解1型糖尿病肾损伤实验研究[J]. 中草药 , 2015, 46 (12) :1785–1790. |
| [20] | 王敏姗, 姜程曦, 张亚利. 含氮杂环的单羰基姜黄素类似物的合成及抗炎活性[J]. 中草药 , 2014, 45 (24) :3532–3537. |
| [21] | Raetz C R, Whitfield C. Lipopolysaccharide endotoxins[J]. Ann Rev Biochem , 2002, 71 :635–700. DOI:10.1146/annurev.biochem.71.110601.135414 |
| [22] | Lee H S, Jung K K, Cho J Y, et al. Neuroprotective effect of curcumin is mainly mediated by blockade of microglial cell activation[J]. Die Pharmazie , 2007, 62 (12) :937–942. |
| [23] | Baldwin A S. The NF-kappa B and I kappa B proteins: new discoveries and insights[J]. Ann Rev Immunol , 1996, 14 :649–683. DOI:10.1146/annurev.immunol.14.1.649 |
| [24] | Poylin V, Fareed M U, O'Neal P, et al. The NF-kappaB inhibitor curcumin blocks sepsis-induced muscle proteolysis[J]. Mediat Inflamm , 2008, 2008 :317851. |
 2016, Vol. 47
2016, Vol. 47


