2. 北京中医药大学 科研实验中心, 北京 100029 ;
3. 北京中医药大学基础医学院, 北京 100029
2. Center of Scientific Research, Beijing University of Chinese Medicine, Beijing 100029, China ;
3. School of Preclinical Medicine, Beijing University of Chinese Medicine, Beijing 100029, China
中药活性成分是中药发挥疗效的基础,中药活性成分的研究不仅是中药质量控制的基础,更是中医药现代化的关键环节。目前,中药活性成分的研究主要采用的是“还原论”[1]“靶向技术”[2]或“血清药理学”[3]等技术,但上述技术在揭示中药活性成分对中药材或复方的关联度及贡献度等方面还存在不足。因此,本课题组提出基于小分子单克隆抗体的免疫亲和色谱特异性敲除技术研究中药物质基础的新思路与方法[4-6]。
免疫亲和色谱特异性敲除技术原理类似于“基因敲除”技术[7],可通过对比药物中某一特定成分敲除前后的功效变化,从而阐释该成分与整体药效的相关性,可用于解析药物的活性成分与该药物功效的关联度、贡献度大小及活性成分与其他成分之间相互作用关系等问题。利用中药活性成分的单克隆抗体制备免疫亲和色谱柱,可以特异性地从药材或复方中敲除该化合物,且“原样”保留其余成分。这种高特异性、高灵敏度的化合物分离纯化技术是目前其他色谱技术难以实现的,这为中药物质基础的研究提供了更加科学便捷的技术支持[8-10]。
甘草酸(glycyrrhizic acid,GA)是甘草中最重要的活性成分之一[11-13],具有免疫调节、抗炎、抗病毒、抗癌、抑菌、解毒、保护心血管、保护脑损伤及保护肝脏[14-19]等作用。本实验利用抗GA单克隆抗体(monoclonal antibodies,mAbs)[20-22]制备了GA特异性敲除免疫亲和色谱柱(immunoaffinity chromatography,IAC),考察GA-IAC柱特异性敲除GA的各项参数。本实验通过特异性敲除实验验证栀子苷能作为GA-IAC柱的内标物质;通过测定GA-IAC柱的最大载样量,考察了GA-IAC柱能否用于甘草提取液的敲除实验;通过考察GA-IAC柱的精密度及稳定性等参数,检验GA-IAC柱特异性敲除GA方法的稳定性及可靠性。上述参数的测定,为GA特异性敲除技术的建立提供科学依据,也为今后明确GA的药效及作用机制,阐释甘草的物质基础,揭示中药多成分间的相互作用以及复方的配伍机制研究提供新思路。
1 仪器与材料CPA225D电子天平,赛多利斯科学仪器(北京)有限公司;Agilent 1260 Infinity LC高效液相色谱仪,德国Agilent Technologies;色谱柱:Reliasi1 C18(250 mm×4.6 mm,5μm),型号:2108055,美国Orochem公司;中压色谱柱(20 cm×2.5 cm),型号:7374521,美国Bio-rad公司;QYC-200恒温振荡摇床,上海福玛实验设备有限公司;EL×800酶标仪,美国伯腾仪器有限公司。
对照品GA(批号13083101,质量分数≥98%)、栀子苷(批号110749-200714,质量分数≥98%),成都曼斯特生物科技有限公司;CNBr活化Sepharose 4B凝胶,批号10223816,瑞士Amersham Biosciences;乙腈,批号1401-7,色谱纯,德国Merck;BCA蛋白浓度测定试剂盒(批号20510203),北京索莱宝科技有限公司;去离子水,北京中医药大学逸夫科研楼;其他化学试剂(分析纯)均购于北京化工厂。
2 方法与结果 2.1 色谱条件Agilent 1260色谱仪,DAD检测器;色谱柱为Reliasi1 C18(250 mm×4.6 mm,5μm);流动相为1%醋酸铵水溶液(醋酸-水1:99,0.06 mol/L醋酸铵)-乙腈;体积流量1 mL/min;检测波长254 nm;进样量10μL;柱温30℃;梯度洗脱:0~12 min,6%~22%乙腈;12~25 min,22%~25%乙腈;25~45 min,25%~40%乙腈;45~50 min,40%~6%乙腈;50~57 min,6%乙腈。
2.2 样品溶液的配制配制GA的对照品溶液作为上样液,并以一定质量浓度栀子苷溶液作为内标物质,用于GA的质量浓度标准曲线测定,以及GA特异性敲除实验。
精密称定10.0 mg GA,去离子水溶解,5 mL量瓶定容,制成2.00 mg/mL对照品母液。精密称定5.0 mg栀子苷,去离子水溶解,5 mL量瓶定容,制成1.00 mg/mL对照品母液。利用GA对照品母液配制1.75、1.50、1.25、1.00、0.50、0.25、0.10、0.05 mg/mL GA对照品溶液(去离子水稀释,含250μg/mL栀子苷)。
2.3 GA标准曲线绘制用栀子苷作为测定的内标物质,在相同的色谱条件下,对上述已配制好的对照品溶液进行测定,以GA的质量浓度为横坐标(X),以GA的吸收面积与栀子苷的吸收面积的比值为纵坐标(Y)得线性回归方程GA Y=445.62 X+55.104,R2=0.999 8,线性范围57.5~1 750μg/mL,保留时间40.47 min,检测限(LOD)为57.5μg/mL。结果表明GA的测定具有较宽的线性范围,且线性关系良好。
2.4 偶联率测定通过BCA(Bicinchonininc acid)法计算蛋白质的量,在96孔板中加入PBS稀释的牛血清白蛋白(BSA)对照品梯度工作液及待测蛋白样品溶液,加入BCA工作液,酶标仪562 nm波长扫描吸光度(A)值,测定蛋白质量浓度,计算抗GA抗体(GA-mAbs)与Sepharose 4BTM凝胶的偶联率及偶联比,计算公式为偶联率=(偶联前抗体量-偶联后抗体量)/偶联前抗体量,偶联比=(偶联前抗体量-偶联后抗体量)/琼脂糖凝胶体积。
2.5 GA免疫亲和色谱柱的制备称取12 g CNBr活化的Sepharose 4BTM凝胶,用100 mL HCl(1 mol/L,pH 3)溶胀,搅拌0.5 h。用2 000 mL的HCl(1 mol/mL,pH 3)溶液冲洗柱子,再以5倍柱体积去离子水平衡柱子。称取400 mg GA-mAb冻干粉溶解于1 mL的0.1 mol/L NaHCO3(pH 8.3,含0.5 mol/L NaCl)溶液,将抗体溶液加入溶胀好的凝胶中,再将凝胶转移至锥形瓶中,37℃,120 r/min,摇床振荡孵育2 h。振荡后溶液转移至20 cm×2.5 cm的中压色谱柱内,以5倍柱体积0.1 mol/L NaHCO3(pH 8.3,含0.5 mol/L NaCl)溶液冲洗凝胶至A值为0,测定流出液蛋白量,计算偶联率。再用3倍柱体积去离子水平衡色谱柱。将色谱柱中凝胶转移至0.1 mol/L Tris-HCl(pH 8.0,不含NaCl)溶液中,37℃,50 r/min,摇床振荡孵育2 h,将凝胶转移回中压色谱柱中,以3倍柱体积去离子水平衡凝胶,再用5倍柱体积的0.1 mol/L NaAc-HAc(pH 4,含0.5 mol/L NaCl)溶液及5倍柱体积的0.1 mol/L Tris-HCl(pH 8.0,含NaCl)溶液交替冲洗凝胶,后去离子水平衡中压色谱柱,再用0.01 mol/L PBS封存,4℃保存备用。测得偶联后(未结合)的抗体量为100.4 mg,计算抗GA-mAbs与琼脂糖凝胶偶联率74.9%,偶联比为5.99:1,表明Sepharose 4BTM凝胶对抗GA-mAbs有较强的结合能力。
2.6 GA-IAC参数考察 2.6.1 特异性敲除实验精确量取1 mL质量浓度为500μg/mL(含250μg/mL栀子苷内标)的GA对照品溶液,室温条件下将样品进样到GA-IAC内,孵育15 min,以去离子水为敲除液,收集5倍柱体积(250 mL)敲除液,以甘氨酸盐酸缓冲液(pH 2.7,含0.5 mol/L NaCl)为洗脱液,收集5倍柱体积(250 mL)洗脱液,再用去离子水平衡GA-IAC,至pH值恢复中性,放入4℃保存。将收集到的敲除液和洗脱液分别用旋转蒸发仪浓缩、蒸干,1 mL纯甲醇复溶,收集复溶液,0.22μm微孔滤膜滤过复溶液,HPLC测定敲除液与洗脱液中化学成分种类及其量。
偶联在Sepharose 4BTM凝胶上的抗GA-mAbs,能特异性吸附样品中的GA,而其他成分则随着流动相离开柱子。当进样500μg/mL(含250μg/mL栀子苷内标)GA对照品溶液(图 1-A)流经GA-IAC柱后,HPLC法测定敲除液(图 1-B)中栀子苷质量浓度为259.0μg/mL,回收率为103.6%,未测到GA;洗脱液(图 1-C)中GA质量浓度为312.1μg/mL,且未测到栀子苷成分。敲除液与洗脱液HPLC结果显示GA-IAC柱对栀子苷无特异性吸附,可选择其作为内标物质。
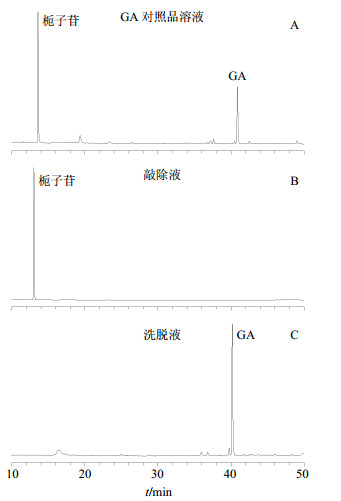
|
图 1 GA特异性敲除研究结果 Fig.1 Specific knock out of GA by HPLC |
2.6.2 最大载样量与敲除率考察
考察制备的GA-IAC柱最大载样量,为之后利用GA-IAC柱敲除GA的上样量限定范围。精确量取1 mL质量浓度不同的GA对照品溶液(1.75、1.50、1.25 mg/mL,含250μg/mL栀子苷内标),将GA样品进样到GA-IAC柱内,以去离子水为敲除液,以甘氨酸盐酸缓冲液(pH 2.7,含0.5 mol/L NaCl)为洗脱液,分别收集5倍柱体积敲除液与洗脱液,再用去离子水平衡色谱柱至pH值为7。将收集到的敲除液和洗脱液分别蒸干,1 mL纯甲醇复溶,收集复溶液,0.22μm微孔滤膜滤过复溶液,HPLC测定敲除部分与洗脱部分中GA的量,测得GA-IAC柱对GA的回收率与敲除量。其中,敲除量表示GA-IAC柱从上样溶液中吸附GA的量,即GA-IAC柱的载样量。
通过HPLC法测定GA-IAC柱敲除3个不同质量浓度的GA对照品溶液,测得GA-IAC柱的最大载样量及回收率如表 1所示。GA-IAC柱的最大载样量=每克葡聚糖凝胶载样量平均值×葡聚糖凝胶用量(12 g),测得最大载样量为110.51μg/g×12 g=1.326 12 mg,表明GA-IAC柱特异性吸附GA效果好,GA-mAbs活性高。
|
|
表 1 GA-IAC柱的载样量与敲除率 Table 1 Knock out efficiency and capacity of IAC column for GA |
2.6.3 精密度与准确性试验
考察GA-IAC柱的精密度与准确度,验证GA-IAC柱特异性敲除GA方法的科学性。精确量取1 mL不同质量浓度的GA对照品溶液(1.75、1.50、1.25 mg/mL,含250μg/mL栀子苷),将3种质量浓度GA样品连续3 d进样到GA-IAC柱内,每个质量浓度样品进样3次,分别收集敲除液和洗脱液,旋转蒸发仪蒸干,1 mL纯甲醇复溶,收集复溶液,0.22μm微孔滤膜滤过复溶液,HPLC检测敲除液中GA的量,计算日内及日间GA质量浓度的总RSD和相对误差(RE),并用以评价GA-IAC柱敲除GA的日内及日间精密度和准确度。计算GA质量浓度的总RSD和RE,结果如表 2所示,测得GA质量浓度的总RSD值为0.65%,RE值为0.37%,符合方法的要求。
|
|
表 2 GA-IAC柱精密度与准确度考察 Table 2 Assay accuracy and precision of GA-IAC column |
2.6.4 重复性与稳定性试验
测定GA-IAC柱在相同敲除、洗脱条件,以及相同实验环境(包括温度、湿度等)下,对GA的特异性敲除的效果随时间变化的规律,考察该方法的重复性与稳定性。
同一条件下测定第1、2、4、8、16、32天时间点的GA-IAC柱敲除GA的敲除率。取1 mL(1.5 mg/mL,含250μg/mL栀子苷内标)GA样品,流经GA-IAC柱,收集敲除液及洗脱液,蒸干后甲醇复溶,HPLC测定敲除液及洗脱液中GA质量浓度,计算RSD值,验证GA-IAC柱特异性敲除GA的重复性与稳定性。
测定在第1、2、4、8、16、32天时间点的GA-IAC柱敲除GA(1.5 mg/mL,含250μg/mL栀子苷)样品的敲除率,测得GA-IAC敲除结果见表 3,在32 d内,GA-IAC柱敲除率的RSD值为1.37%,表明制备的GA-IAC柱具有较好的重复性与稳定性。
|
|
表 3 GA-IAC柱重复性与稳定性试验 Table 3 Repeatability and stability of GA-IAC column |
3 讨论
甘草作为最常用的中药之一,对于其化学成分及药理活性的研究早已开展的十分透彻,但是过往的研究往往割裂了活性成分GA与甘草饮片或复方的关联度,不能论证GA在中药或复方整体中的关联性与贡献度大小。因此,本实验制备出能特异性敲除GA的免疫亲和色谱柱,为GA的药理活性研究提供新的方法。
本实验重点在于考察所制备的GA-IAC柱的各项参数。实验结果表明GA-IAC柱对GA具有很强的特异性吸附能力,其最大载样量能达到1.326 11 mg,进一步研究可用于敲除甘草提取液中的GA成分。通过分析GA-IAC柱的精密度及准确度实验结果,表明利用GA-IAC柱特异性敲除GA的方法是有效可行的。本实验考察GA-IAC柱的稳定性,实验结果显示GA-IAC柱在32 d内GA敲除率的RSD值为1.37%,表明偶联在琼脂糖凝胶上的抗GA-mAb在此时间段内活性较好,GA-IAC柱对GA的特异性吸附效果良好,该方法具有较好的重复性与稳定性。上述实验结果表明本实验成功制备了可用于特异性敲除GA的IAC。且在前期研究中本课题组进行GA-IAC敲除甘草提取液中GA的研究[19],实验结果表明,GA-IAC能敲除甘草提取液中的GA,且敲出率可达到100%,表明GA-IAC能应用于甘草提取液中GA的敲除研究。
前期研究中发现,利用去离子水作为敲除液,甘氨酸盐酸缓冲液(pH 3)作为洗脱液,能取得较好的敲除洗脱效果[20]。偶联在葡聚糖凝胶上的抗GA-mAb作为一种蛋白质,敲除液和洗脱液对抗体活性有十分重要的影响,从而对GA-IAC柱的敲除效果产生巨大的影响。本实验选择去离子水及甘氨酸盐酸(pH 3),其对抗体活性影响较小,在较长时间内对色谱柱的敲除效率无不良影响,且去离子水作敲除液可直接用于后续GA细胞实验或动物药理学实验当中,无须复杂的有机溶剂处理过程。也有文献报道[23]采用5 mmol/L PBS(含50 mmol/mL NaCl,pH 7)作为敲除液,20 mmol/L PBS(含30%甲醇,500 mmol/L NaCl,pH 7)作为洗脱液。但对比本实验制备的GA-IAC柱,在对GA的敲除效率,色谱柱的载样量,色谱柱的稳定性等方面,本实验制备的GA-IAC柱明显高于文献结果。且本实验制备的色谱柱的操作更便捷、无污染,适合用于更进一步研究GA的药理药效学实验中,这都表明本实验制备的GA-IAC柱具有更加独特的应用优势。
作为一种研究GA药理活性的新途径,利用GA-IAC特异性敲除GA的方法还有需要改进的方面,如色谱柱对有机试剂的耐受性,抗GA-mAb活性的保存,GA-IAC柱的最佳使用条件等方面,都需要对其进行进一步的优化考察。
| [1] | 李梢, 王永炎. 医学研究中系统论与还原论的关联关系[J]. 北京中医药大学学报 , 2005, 28 (5) :1–5. |
| [2] | 肖震宇, 何少忠, 彭卫卫. 中药靶向治疗肿瘤的基础与临床研究进展[J]. 中国药房 , 2011, 22 (23) :2204–2206. |
| [3] | 李芳, 李辉. 血清药理学在中药药效学中的研究进展[J]. 安徽农业科学 , 2013, 41 (32) :12607–12609. |
| [4] | 赵琰, 屈会化, 王庆国. 利用单克隆抗体特异性敲除技术解析中药药效物质基础的新方法[J]. 中国中药杂志 , 2013, 38 (17) :2906–2910. |
| [5] | 屈会化, 赵琰, 王庆国. 基于中药活性小分子单克隆抗体的复方配伍机理研究新思路[J]. 中国中西医结合杂志 , 2012, 32 (10) :1416–1419. |
| [6] | 屈会化, 赵琰, 王庆国. 中药小分子单克隆抗体技术平台的构建[J]. 中草药 , 2014, 45 (7) :895–899. |
| [7] | 陶果, 信吉阁, 肖晶, 等. 基因敲除技术最新研究进展及其应用[J]. 安徽农业科学 , 2013, 41 (29) :11605–11608. |
| [8] | 谢彬彬.葛根素单克隆抗体免疫亲和色谱柱的制备[D].北京:北京中医药大学, 2012. |
| [9] | 何洲.绿原酸与清开灵注射液过敏反应相关性的研究[D].北京:北京中医药大学, 2011. |
| [10] | 孔靓, 李宝才, 向诚. 中药有效成分组的研究进展[J]. 中草药 , 2015, 46 (22) :3289–3296. |
| [11] | 中国药典[S].一部. 2015. |
| [12] | Zheng Q Y, Ye M. Chemical analysis of Chinese herbal medicine Gan-ao (licorice)[J]. J Chromatogr A , 2009, 1216 (11) :1954–1969. DOI:10.1016/j.chroma.2008.07.072 |
| [13] | Farag M A, Porzel A, Wessjohann L A. Comparative metabolite profiling and fingerprinting of medicinal licorice roots using a multiplex approach of GC-MS, LC-MS and 1D NMR techniques[J]. Phytochemistry , 2012, 76 :60–72. DOI:10.1016/j.phytochem.2011.12.010 |
| [14] | 张明发, 沈雅琴. 甘草酸及其衍生物的抗炎和抗变态反应研究进展[J]. 现代药物与临床 , 2011, 26 (5) :359–364. |
| [15] | Rackova L. Mechanisn of anti-inflanmamry action of liquorice extract and glycyrrhizin[J]. Nat Prod Res , 2007, 21 (14) :1234–1241. DOI:10.1080/14786410701371280 |
| [16] | Yamazaki S, Morita T, Endo H, et al. Isoliquiritigenin suppresses pulmonary metastasis of mouse renal cell carcinoma[J]. Cancer Lett , 2002, 183 (1) :23–30. DOI:10.1016/S0304-3835(02)00113-1 |
| [17] | Lee C K, Park K K, Lin S S, et al. Effects of the licorice extract against tumor growth and cisplatin-induced toxicity in a mouse xenograft model of colon cancer[J]. Biol Pharm Bull , 2007, 30 (11) :2191–2195. DOI:10.1248/bpb.30.2191 |
| [18] | Kang J S, Yoon Y D, Kang I J C, et al. Glabrid in an isoflavan from licorice root inhibits educable nitric-xide synihase expreslion and inproves survival of mice in experinental model of septic shock[J]. J Pharmacol Exp Ther , 2005, 312 (3) :1187–1194. |
| [19] | 张明发, 金玉洁, 沈雅琴. 甘草酸保护脑损伤及改善记忆功能的药理作用研究进展[J]. 药物评价研究 , 2013, 36 (1) :59–63. |
| [20] | Zhang Y, Qu H H, Zeng W H, et al. Development of an enzyme-linked immunosorbent assay and immunoaffinity chromatography for glycyrrhizic acid using an anti-glycyrrhizic acid monoclonal antibody[J]. J Sep Sci , 2015, 38 (13) :2363–2370. DOI:10.1002/jssc.v38.13 |
| [21] | 张越, 屈会化, 吴婷婷, 等. 甘草酸单克隆抗体的制备与鉴定[J]. 药物分析杂志 , 2013, 33 (5) :770–774. |
| [22] | 张越.甘草酸、柚皮苷单克隆抗体的制备及其酶联免疫分析方法的建立[D].北京:北京中医药大学, 2013. |
| [23] | Xu J S, Tanaka H, Shoyama Y. One-step immunochromatographic separation and ELISA quantification of glycyrrhizin from traditional Chinese medicines[J]. J Chromatogr B , 2007, 850 (1/2) :53–58. |
 2016, Vol. 47
2016, Vol. 47


