2. 中国中医科学院西苑医院, 中药药理北京市重点实验室, 北京 100091
2. Beijing Key Laboratory of Pharmacology of Chinese Materia Medica, Xiyuan Hospital, China Academy of Chinese Medical Sciences, Beijing 100091, China
乌头类生物碱为乌头属中药的主要活性成分和毒性成分,属于二萜类生物碱,根据其结构可分为单酯型生物碱、双酯型生物碱和脂型生物碱[1-2]。乌头属中药中主要有效成分为剧毒的双酯型生物碱,如乌头碱(aconitine)、次乌头碱(hypaconitine)、中乌头碱(mesaconitine)。中医临床使用炮制的方法使中药材减毒增效,在炮制过程中,双酯型生物碱可以水解去掉1个酯基,转化成单酯型乌头生物碱,如苯甲酰乌头原碱(benzoylaconine)、苯甲酰次乌头原碱(benzoylhypaconine)和苯甲酰新乌头原碱(benzoylmesaconine),或继续水解去掉2个酰基转化为乌头原碱。炮制水解使得乌头属中药的毒性大大降低,但其药理活性亦随之减弱或消失[3-5]。因此,本实验对双酯型和单酯型生物碱的代表成分进行研究。
四级杆-飞行时间(Q-TOF)串联质谱具有选择性强、灵敏度高的特点,能得到数据完整且高品质的质谱图,可以测得化合物的精确质量(质量误差小于百万分之二),可以利用该特点在复杂的样品中提取出高专属性的成分进行定性或定量分析[6-8]。乌头类生物碱的质谱裂解途经研究已经有部分报道[9-11],但这些研究中多采用电喷雾串联质谱的方法,相较于四级杆-飞行时间串联质谱得到的碎片相对分子质量不够精确,对水解产物质谱裂解规律的阐释也不够深入。本研究采用高灵敏度HPLC-Q-TOF-MS对6种乌头类生物碱(图 1和表 1)的质谱裂解规律进行深入的探讨,在正离子模式下,乌头类生物碱的主要裂解途径是连续丢失CH3OH与H2O。双酯型生物碱也可以在C-8位置断裂,失去CH3COOH分子形成明显的特征碎片离子,与单酯型生物碱有明显区分。此发现为生物样品中乌头类生物碱的快速定性和定量鉴别提供依据。
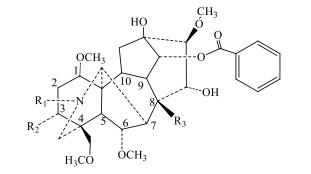
|
图 1 两类乌头类生物碱的母核结构 Fig.1 Nucleus structure of two kinds of aconitine-type alkaloids |
|
|
表 1 类乌头类生物碱的结构 Table 1 Structures of two kinds of aconitine-type alkaloids |
1 仪器与试剂
Agilent 1200 series高效液相色谱仪(美国Agilent公司),配备二元泵、在线脱气机、自动进样器、柱温箱、PDA检测器以及在线分析软件等;Agilent 6250 series Q-TOF质谱仪(美国Agilent公司);乙腈、甲醇均为色谱纯,购于美国Fisher公司;甲酸为分析纯,购于J. T. BAKER公司;纯净水购于中国娃哈哈有限公司。对照品乌头碱(批号110720-200410,质量分数为98%)、乌头次碱(批号110798-201308,质量分数为98.6%)、中乌头碱(批号110799-201307,质量分数为98.3%)、苯甲酰乌头原碱(批号111794-200901,质量分数为98.6%)、苯甲酰次乌头原碱(批号111796-200901,质量分数为99.5%)、苯甲酰中乌头原碱(批号111795-201303,质量分数为96.3%)均购自中国食品药品检定研究院。
2 方法 2.1 样品溶液的制备取乌头碱、乌头次碱、中乌头碱、苯甲酰乌头原碱、苯甲酰次乌头原碱、苯甲酰中乌头原碱对照品适量,用甲醇溶解配制成质量浓度分别为10 μg/mL的混合溶液。
2.2 LC-Q-TOF-MS实验条件雾化气和干燥气均为氮气,碰撞气为氦气。采集模式为正离子,毛细管电压为3 500 eV,雾化温度为350 ℃,干燥气为10.0 L/min,雾化气为206.85 kPa。质谱扫描范围为m/z 80~1 000,数据储存模式为centroid。离子源采用双ESI喷雾,质谱采集数据通过2个已知的标准品[Hexakis (1H, 1H, 3H-tetrafluoropropoxy) phosphazine和7H-嘌呤,对应m/z 922.009 80和121.050 9]进行实时矫正。参比液通过Agilent isocratic泵以0.01 mL/min的速度喷入质谱。Auto MS/MS实验采用CID碰撞的方
液相色谱为美国Agilent 1200 HPLC系统,液相分离采用RP色谱柱(Atlantis,T3,150 mm×2.1 mm,3 μm,Waters,IELAND),流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B),梯度洗脱:0~30 min,12%~30% B,30 min停止,以12% B平衡5 min。体积流量为0.25 mL/min,柱温35 ℃,进样体积为5 μL。
3 结果正离子模式下,LC-MS检测的6种生物碱的总离子流图如图 2所示。初步对6种生物碱的质谱裂解途径进行总结,由于母核中甲氧基和羟基较多,因此这类成分最常见的质谱碎裂途径就是不断失去CH3OH与H2O。乌头碱等双酯型乌头类生物碱与苯甲酰乌头原碱等单酯型乌头类生物碱之间结构上的主要区别就是在C-8位上相差1个乙酰基,这使得两类生物碱在质谱裂解途径上呈现出明显的区分[12-13]。本实验以中乌头碱与苯甲酰乌头原碱为例进行阐释。
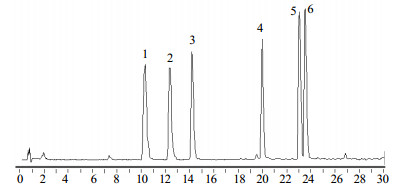
|
图 2 LC-MS检测6种生物碱的总离子流图 Fig.2 TfC of six aconitine-type alkaloids determined by iC-Mp |
中乌头碱的分子离子峰[M+H]+为m/z 632.306 5(+3.96×10−6)。如图 3-A所示,离子强度最高的碎片离子为m/z 572.291 5,由[M+H]+ 失去1分子CH3COOH生成。低峰度的碎片离子m/z 582.276 3是由乌头碱失去1分子CH3OH与H2O形成的。质谱中较高峰度的离子主要来自于碎片离子m/z 572.291 5,失去1分子水可形成碎片离子m/z 554.276 8,失去1分子CH3OH则形成碎片离子m/z 540.266 4。而m/z 540.266 4失去1分子水可形成碎片离子m/z 522.256 5,也可失去CO形成碎片离子m/z 512.269 5,其继续失去1分子CH3OH则生成碎片m/z 480.239 7。如图 3-B所示,中质量区的碎片m/z 354.172 3是由碎片离子m/z 572.291 5失去侧链苯甲酸与甲醇形成。低质量区的碎片m/z 105.034 9为乌头碱侧链苯甲酰的碎片离子,而乌头碱上的氮原子,可发生连续断裂生成碎片m/z 44.051 2。
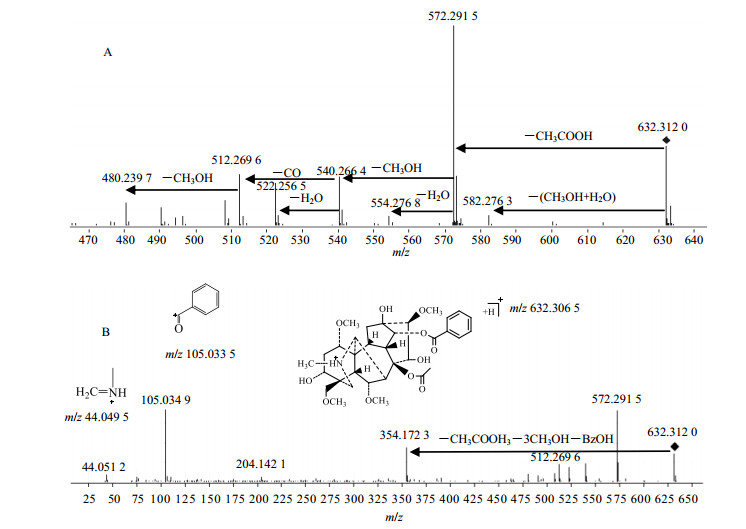
|
图 3 中乌头碱的MS/MS质谱图 Fig.3 MS/MS spectra of mesaconitine |
苯甲酰乌头碱的分子离子峰[M+H]+为m/z 604.313 2 (+2.65×10−6),如图 4-A所示,离子强度最高的碎片离子m/z 554.278 5由[M+H]+失去1分子CH3OH与H2O生成。由于结构上的差异,单酯型生物碱的MS/MS质谱图中没有失去CH3COOH的碎片,但在双酯型生物碱的质谱中这种碎片丰度最高,并因此产生一系列丰度较高的碎片,这是两种类型生物碱的重要区别。苯甲酰乌头碱的碎片主要来自于失去CH3OH与H2O。准分子离子失去1分子H2O生成碎片m/z 586.303 0,也可失去1分子CH3OH生成碎片m/z 572.285 2。碎片m/z 572.285 2失去1分子CH3OH生成碎片m/z 540.259 8,失去1分子H2O生成碎片554.278 5,继续失去1分子CH3OH形成碎片离子m/z 522.254 7。如图 4-B所示,低m/z区的碎片与中乌头碱的裂解途径相同,主要是苯甲酰侧链和氮原子的质谱裂解。低质量区的碎片m/z 105.035 1为侧链苯甲酰的碎片离子,而苯甲酰乌头碱上的氮原子,发生连续断裂生成碎片m/z 58.060 3。
与中乌头碱的质谱裂解不同,苯甲酰乌头碱并未出现失去苯甲酰侧链后生成的碎片离子,其在中等质量的m/z 300~400区域并未出现明显碎片,而中乌头碱则出现失去苯甲酸等的高峰度碎片,其他的4种生物碱也出现了相同情况,2类生物碱呈现出明显的区别。这说明双酯型生物碱更容易失去苯甲酰侧链而形成稳定的碎片离子,这也是2种生物碱的又一重要区别。此外,由于中乌头碱的N原子上连有甲基,经过连续的碎裂,在质谱中可产生m/z 44.051 2的碎片离子峰,见图 3-B,而苯甲酰乌头碱的N原子上连有乙基,经过连续的碎裂,在质谱中可产生m/z 58.066 3的碎片离子峰,见图 4-B,这种裂解途径可以在结构鉴定中判断氮原子上的取代基,为未知生物碱结构的判定提供参考。6种乌头类生物碱的主要碎片归纳见表 2。
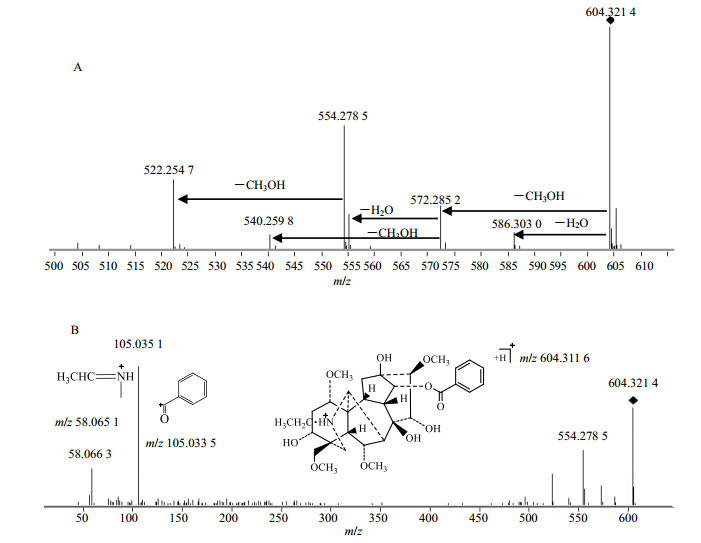
|
图 4 苯甲酰乌头原碱的MS/MS质谱图 Fig.4 MS/MS spectra of benzoylaconine |
|
|
表 2 2种乌头类生物碱的主要碎片离子 Table 2 Main fragment ions of two kinds of aconitine-type alkaloids |
4 讨论
本研究利用高效液相色谱对6种乌头类生物碱实现了较好的分离,并进一步通过高分辨的飞行时间质谱得到其分子离子和碎片离子的准确结构信息。利用以上实验结论并结合之前的文献报道,较为详尽地解析了6种乌头类生物碱的质谱裂解规律。以CH3COOH分子中性丢失的裂解途径区分双酯型与单酯型乌头类生物碱,同时可通过低质量区离子碎片推断N原子上连接基团的类型,从而为未知生物碱的结构判定提供依据。本研究对乌头类生物碱质谱裂解规律的总结,为利用质谱裂解方式初步确定乌头类生物碱的结构类型、利用LC-MS研究药材炮制过程中乌头类双酯型生物碱水解转化规律、乌头类生物碱在体内代谢规律的解析以及对其他天然药物中同类生物碱的质谱研究提供参考。
| [1] | 刘文龙, 刘志强, 宋凤瑞, 等. 乌头类双酯型生物碱组分转化为单酯型水解型及脂型生物碱组分的研究[J]. 高等学校化学学报 , 2011, 32 (3) :717–720. |
| [2] | 谭鹏, 邓欣祺, 李飞, 等. 乌头碱电喷雾质谱裂解机制的研究[J]. 中国测试 , 2014, 40 (1) :43–46. |
| [3] | 孙兰, 周海燕, 赵润怀, 等. HPLC法同时测定附子中6种单酯和双酯型生物碱[J]. 中草药 , 2009, 40 (1) :131–134. |
| [4] | 刘芳, 于向红, 李飞, 等. HPLC测定附子及其炮制品中3种双酯型生物碱的含量[J]. 中国中药杂志 , 2006, 31 (14) :1160–1162. |
| [5] | 贾雪岩, 林华, 沈玉巧, 等. 附子新型炮制品中乌头类生物碱测定及其强心作用研究[J]. 药物评价研究 , 2016, 39 (2) :224–229. |
| [6] | 张小龙, 吴先富, 王昆, 等. HPLC-QTOF-MS法测定风湿骨痛胶囊中9个乌头类生物碱的含量[J]. 药物分析杂志 , 2015, 35 (3) :414–419. |
| [7] | 张小平, 蒋可志, 吕惠卿, 等. HPLC-QTOF-MS鉴定条叶榕根茎乙酸乙酯提取物中的主要化学成分[J]. 质谱学报 , 2015, 36 (4) :310–320. |
| [8] | Sun M Q, Liu J X, Lin C R, et al. Alkaloid profiling of the traditional Chinese medicine Rhizoma corydalis using high performance liquid chromatography-tandem quadrupole time-of-flight mass spectrometry[J]. Acta Pharm Sin B , 2014, 4 (3) :208–216. DOI:10.1016/j.apsb.2014.04.003 |
| [9] | 陈玉娟, 王会堂, 凡炼炼. 乌头碱的质谱裂解行为分析[J]. 科技创新导报 , 2010 (21) :7–8. |
| [10] | 陈苹苹, 赵宁, 徐秀玲, 等. 液相色谱-电喷雾串联质谱法分析新乌头碱在大鼠尿液中的代谢产物[J]. 药学学报 , 2010, 45 (8) :1043–1047. |
| [11] | 李坤平, 高崇凯, 李卫民. 牡荆苷和异鼠李素-3-O-β-芸香糖苷的电喷雾飞行时间质谱研究[J]. 中国中药杂志 , 2011, 36 (2) :180–184. |
| [12] | 彭蜀莹, 沈建华, 叶阳. 4种百部生物碱的质谱行为研究[J]. 分析化学研究报告 , 2006, 30 (4) :497–502. |
| [13] | 刘淑莹, 宋凤瑞, 刘志强. 中药质谱分析[M]. 北京: 科学出版社, 2012 . |
 2016, Vol. 47
2016, Vol. 47

