2. 河北医科大学药学院 天然药物化学教研室, 河北 石家庄 050017
2. College of Pharmaceutical Sciences, Hebei Medical University, Shijiazhuang 050017, China
天然产物是自然界的生物在千百万年的进化过程中通过自然选择合成以及保留下来的结构各异的次生代谢产物,这些次生代谢产物由于结构的多样性而具有多种多样的生物活性。天然产物对人类最大的贡献之一就是成为药物,在人类历史上,天然药物一直是人们防病治病的主要手段。天然产物具有结构多样性、生物活性多样性和类药性而成为新药开发研究的重点,临床上应用的许多药物都直接或间接来源于天然产物,天然产物在新药开发、绿色生物农药研制、保健功能食品和天然化妆品开发中扮演了非常重要的角色[1-7]。
对天然产物的研究一直是科学家们特别关注的领域,尤其是天然产物的结构鉴定更被视为其中最为关键、困难的工作之一。天然产物数量巨大、结构类型繁多,特别是立体化学结构的测定尤为困难。早期研究中,天然产物的结构确定主要是通过各种化学反应如制备衍生物、化学降解甚至全合成方法对照等手段来完成,最初一个复杂化合物的结构鉴定往往需要花费十几年、几十年甚至上百年的努力。随着科学技术的迅猛发展,对天然产物结构的研究手段与方法也发生了巨大变化,从最早的化学法为主导发展成为以仪器分析即波谱分析为主导,特别是近30年来,现代波谱技术的应用更是促使天然产物的研究速度大为提升[8]。
本文在天然药物化学史话系列文章[9-17]的基础上对“四大光谱”分析技术即红外光谱(infrared spectroscopy,IR)、紫外光谱(ultraviolet spectroscopy,UV)、质谱(mass spectrometry,MS)、核磁共振波谱(nuclear magnetic resonance spectroscopy,NMR)等技术的应用历史特别是对MNR技术进行回顾与总结,并对其发展前景进行展望。
1 天然产物结构研究历史简介20世纪前半叶,天然产物的结构鉴定主要还是依靠化学手段,包括一系列官能团的化学反应、化学降解、制备衍生物、化学转换甚至全合成对照等,这些方法不仅费时耗力,而且对样品量需求很大,还要求研究者有相当深厚的有机化学知识与技能,因此被视为一项极其复杂且富有挑战性的艰苦工作。如吗啡(morphine,1)和马钱子碱(士的宁,strychnine,2),从分离得到单体到结构确定分别花费118年和127年,耗费了几代人的心血,整个结构研究过程跌宕起伏,仅仅为了对吗啡的结构进行研究,英国著名化学家、诺贝尔化学奖获得者Robinson就发表了50余篇研究论文[18-19]。1937年我国著名药物化学家赵承嘏教授从防己科植物粉防己Stephania tetrandra S. Moore中分离得到防己诺林碱(fangchinoline),其化学结构直到20年后的1958年才由我国著名科学家庄长恭教授、邢其毅教授用化学方法确定。在20世纪60年代NMR技术应用以前,鉴定天然产物的结构主要依靠化学家渊博的化学知识和丰富的想象力,这期间的代表当属美国有机化学大师Woodward推测出的土霉素(oxytetracycline,3)和青霉素(penicillin,4)的结构。但是由于天然产物结构的复杂性,以及当时仪器技术水平和结构鉴定手段的局限性,科学家有时还会得出错误的结论,如1927年和1928年诺贝尔化学奖获得者德国化学家Wieland与Windaus推测出的胆固醇(cholesterol,5)结构,在1932年就被X射线衍射证明是不正确的[20-21]。
进入20世纪后半叶,由于MS和NMR的普遍应用,在天然产物结构鉴定中UV、IR、MS和NMR(以下简称“四大光谱”)的联用技术越来越成熟,四大光谱法逐渐取代了化学法,大大加快了结构鉴定的速度。如从夹竹桃科植物萝芙木Rauvolfia verticillata Lour. Baill.根部得到的一种结构非常复杂的生物碱利血平(reserpine,6),1952年分离获得纯品,1955年就确定了其结构,1956年完成了其全合成,总共历时仅有4年[22-23]。20世纪80年代以后,软离子场解吸质谱(field desorption mass spectrometry,FDMS)的应用和高分辨率核磁共振技术的发展,特别是二维核磁技术的应用,使天然产物的结构鉴定发生了颠覆性的技术革命。从此以后,四大光谱已经成为实验室的常规手段,结构鉴定也不再是“令人却步”的工作。化合物1~6的结构见图 1。
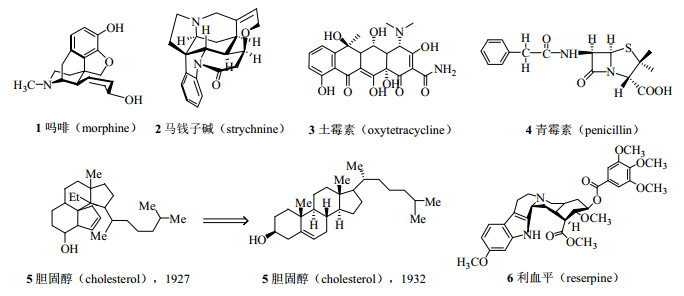
|
图 1 具有历史意义的部分天然产物的化学结构 Fig.1 Chemical structures of morphine and other natural products with historical significance |
严格地说,把UV、IR、MS、和NMR统称为四大光谱并不严格,其实UV、IR属于光谱,NMR属于波谱,MS是物质粒子的质量谱,但在我国早年习惯称之为四大光谱,为方便起见,如今很多教科书和文献杂志还在延续习惯叫法,把它们统称为“四大光谱”。鉴于NMR在结构鉴定中的作用越来越重要,甚至不可或缺,本文将对其进行重点介绍。
2 四大光谱的应用历史介绍 2.1 UV1666年英国科学家牛顿(Isaac Newton)证明一束白光可分解为一系列不同颜色的可见光,并用“光谱(spectrum)”一词来描述这一现象,从此科学家开始对光谱进行了深入研究。紫外光是德国科学家Ritter于1801年发现。紫外光谱法(一般主要是指200~400 nm的近紫外区)真正用于化合物结构研究始于20世纪30年代,特别是在对于甾体化合物、维生素D(vitamin D,VD)等含有共轭双烯键、α,β-不饱和羰基(醛、酮、酸、酯)及芳香环化合物的结构研究中应用特别广泛。著名化学家、诺贝尔奖获得者Woodward(图 2)于1940年左右的早期工作就集中在利用UV来阐明天然产物分子的结构上,他通过大量的实验数据,在1941—1942年总结出了Woodward规则(Woodward rules),即著名的酮规则(Ketone rules),用来计算含有α,β-不饱和羰基化合物发色团(chromophores)的紫外光最大吸收波长(absorption maximum,λmax)[24-25],后经Fieser进行了补充[26],形成了Woodward-Fieser规则(Woodward-Fieser rules);后来斯科特又发展了芳香羰基化合物最大吸收波长的计算规则即Scott规则(Scott rules)。这些经验规则可以对分子结构的鉴定提供帮助,通过测定化合物的λmax,推断出化合物中官能团和取代基的情况,改变了沿用已久的冗长繁琐的传统化学分析方法,例如可以先计算孕甾酮(progesteron,7)的λmax,再利用UV测定得到的λmax来推断化合物8和9的结构(图 3);罗藻毒素(karlotoxins)是从引起赤潮的剧毒卡罗藻Karlodinum veneficum中分离得到的一类毒性化合物,根据卡罗藻毒素的λmax将其划分为两大类:KmTx-1(10,图 4)和KmTx-2(11,图 4),其中KmTx-1的λmax为225 nm,而KmTx-2的λmax为235 nm,后者就是由于末端共轭二烯的氯取代导致了KmTx-2家族化合物λmax发生了红移[27-28]。

|
图 2 Robert Burns Woodward教授 Fig.2 Prof. Robert Burns Woodward |
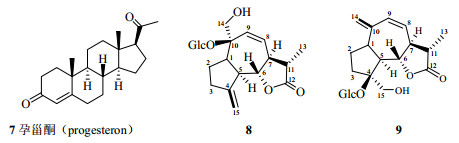
|
图 3 化合物7~9的化学结构 Fig.3 Chemical structures of compounds 7—9 |
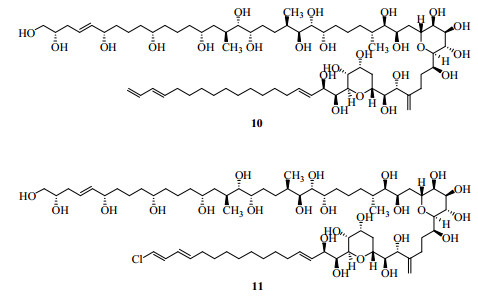
|
图 4 化合物10、11的化学结构 Fig.4 Chemical structures of compounds 10 and 11 |
UV具有测定快速、操作方便简单,谱图简单、易识别、干扰峰少的特点。一般情况下,可以根据化合物的UV光谱中吸收峰的位置、峰形或λmax和强度来推测化合物的共轭体系,如推测其可能含有的功能团(发色团和助色团),判断结构上共轭体系中取代基的位置、种类和数目,甚至可以区分化合物的构型、构象和同分异构等,是测定含有共轭双键、α,β-不饱和羰基(醛、酮、酸、酯)及芳香环化合物结构的一种重要手段。虽然UV可以反映分子结构中发色团和助色团的特征信息,但特征性还是不尽人意,如若分子结构中含有多个独立的共轭体系会产生吸收峰的叠加,会对推断整个分子的结构造成混乱,因此只能作为结构鉴定的一个辅助手段。但因为UV的灵敏度和准确度高,因此在微量定量分析上应用更广。
紫外分光光度计在有机分析的四大光谱仪器中相对价廉,虽然目前很少将其用于复杂天然产物的结构分析,但如果在一些复杂化合物结构测定工作中应用恰当,特别是在不同的诊断试剂的帮助下,也能迅速准确得出较多待测化合物的结构信息。如在天然产物黄酮类(flavonoids)的基本骨架类型、羟基的取代类型以及蒽醌类(anthraquinones)、香豆素类(coumarins)化合物的结构测定中,通过测定其UV光谱以及加入某种诊断试剂后的UV光谱,比较峰形和吸收波长的变化,就可推断出分子的结构类型、取代基的类型和取代位置、数目以及排列方式;UV也可用来区别甾体类化合物(steroids)[29],如甲型强心苷(A cardiac glycosides)和乙型强心苷(B cardiac glycosides)。
UV在复杂天然产物结构确定中最典型的成功应用实例是利血平(reserpine,6)的结构鉴定。1952年成功分离得到利血平单体,通过UV解析分析出其分子中含有吲哚(indole)环和没食子酸(gallic acid)衍生物2个共轭体系;通过化学法水解后得到利血平酸和3, 4, 5-三甲氧基苯甲酸;利血平酸经LiAlH4还原后得到利血平醇;将合成的利血平醇与3, 4, 5-三甲氧基苯甲酸的UV光谱叠加得到的谱线和利血平的紫外吸收曲线基本吻合,从而确定了利血平的基本结构单元,加速了利血平分子结构的确定。利血平分子结构阐明1年后Woodward即完成了其全合成[24-25]。另外,UV在维生素和抗菌素等一系列天然产物结构解析中也曾起过重要作用,如VA1、VA2、VB1、VB12以及青霉素(penicillin)、链霉素(streptomycin)、土霉素(oxytetracycline)等[30]。
2.2 IR在牛顿之后,科学家对光的认识逐渐从可见光区扩展到红外和紫外区。1800年英国科学家Herschel将来自太阳的辐射构成一幅与牛顿所测大致相同的光谱,然后将一支温度计通过不同颜色的光,并且用另外一支不在光谱中的温度计作为参考,发现当温度计从光谱的紫色末端向红色末端移动时,温度计的读数逐渐上升。当温度计移动到红色末端之外的区域时,温度计上的读数达到最高。Herschel认为在可见光区域红色末端之外还有看不见的其他辐射区域存在,由于这种射线存在的区域在可见光区末端以外而被称为红外线(infrared ray)。1881年英国科学家Abney和Festing第一次将红外线用于分子结构的研究。1889年瑞典科学家Angstrem首次证实尽管CO和CO2都是由碳原子和氧原子组成,但因为是不同的气体分子所以具有不同的红外光谱图,这个实验最根本的意义在于它表明了红外吸收产生的根源是分子而不是原子,也就是说红外吸收是因为分子中原子间化学键的因素才产生,最终在此基础上建立了分子光谱学。有机化合物用不同波长的红外线照射,分子吸收红外线后引起化学键的振动或转动能级跃迁而形成的光谱称为IR。红外光谱仪的研制可追溯到20世纪初期。20世纪40年代开始研究双光束红外光谱仪,1950年美国Perkin-Elmer公司开始商业化生产名为Perkin-Elmer 21的双光束红外光谱仪,此仪器的出现促进了红外光谱仪的普及。现代红外光谱议是以傅里叶变换为基础的仪器,傅里叶红外光谱仪具有快速、高信噪比和高分辨率等特点,它的产生也是一次革命性的技术飞跃。
IR主要是通过测定分子结构中化学键的振动频率来推测化合物中所含有的官能团,确定化合物的主要结构类型,例如芳香族、脂肪族、饱和与不饱和以及环的大小,也可区别甲型强心苷和乙型强心苷等。有时IR还能提供关于化合物精细结构的一些信息,如直链、支链、链长、结构异构以及官能团之间的关系等。由于一个官能团会有多种振动方式,在IR中产生多组相应的吸收峰,即特征峰之外的相关吸收峰,相关峰的存在是官能团存在与否的有力佐证。习惯上,将IR图分为特征区(4 000~1 330 cm-1)与指纹区(1 330~400 cm-1),其中指纹区是单键振动和因变形振动产生的复杂光谱区,当分子结构稍有不同时,该区的吸收就有细微的差异,对于区别结构类似的化合物很有帮助。指纹区的主要价值在于表示整个分子的特征,因而适用于与标准图谱或已知物图谱的对照,以得出未知物与已知物是否相同的准确结论,任何2个化合物的指纹区特征都是不相同的,因此在核对和确认化合物时非常有用,根据特征峰的有无,确定官能团存在与否时否定比肯定更可靠。哥伦比亚大学中西香尔(Nakanishi Koji,图 5)教授对IR应用于天然产物结构鉴定颇有造诣,曾经编写过多部关于红外光谱分析的专著,在20世纪50~70年代IR为天然产物的结构鉴定起到很好的推广示范作用[31-35]。

|
图 5 中西香尔教授 Fig.5 Prof. Koji Nakanishi |
根据IR分析的三大要素,即吸收峰的位置、强度、峰形,解析IR的一般程序是先特征,后指纹;先强峰,后次强峰;先粗查,后细找;先否定,后肯定;最后寻找解析一组相关峰。20世纪50年代Woodward在合成降压药利血平的论文中,所附IR谱图达30张之多,并对IR做过这样的评价:“不管反应所得的化合物纯度多么差,可生成预期产物的希望多么渺茫,如果用IR做常规的检测,往往会对重大的发现提供某些线索,这是其他方法难以胜任的。”这道出了IR在结构确认中的重要性。
但是在IR中,如果在特征吸收峰处可能的官能团有2~3种,对未知化合物结构进行推断时有较大不确定性,如果再有样品的浓度、纯度和仪器的影响,目前在结构鉴定工作中IR已基本成为NMR结构解析的辅助工具,更多的是在未知化合物结构解析出来后,用IR加以佐证,使在鉴定未知化合物时错误率降至最低。例如在推测青蒿素(artemisinin,12,图 6)的结构时,除用NMR和MS解析外,还通过IR中在831、881、1 115 cm-1处有特征吸收峰,进一步佐证过氧桥的存在。又如在1978年,美国科学家Moore等从瓦胡岛的Kahala海滩浅水层的门林氏藻属蓝藻Majuscula sp.中首次分离得到了一个手性不饱和脂肪酸(13,图 6),通过IR数据在970 cm-1处有特征吸收峰从而确定了其双键为反式构型[36]。
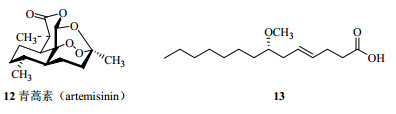
|
图 6 青蒿素和化合物13的化学结构 Fig.6 Chemical structures of artemisinin and compound 13 |
2.3 MS
MS技术是天然产物结构研究的重要手段之一。质谱仪是利用物理学科中的电磁学原理,通过测定分子或分子裂解成若干碎片的质核比(m/z)来推测分子的结构,不同结构的分子会裂解成不同的碎片。MS的最大优点是灵敏度高、需要样品量极少——只要微克级甚至纳克级的样品即可得到分析结果,而且能够给出众多碎片,分析这些碎片离子可获得化合物的相对分子质量以及结构特征、裂解规律和由单分子分解形成的某些离子间相互关系等信息。MS是目前常用的能给出准确相对分子质量甚至确定分子式的技术手段,特别是用于判断结构中是否含有杂原子、推算不饱和度进而判断化合物中含有双键、三键和环的数量以及结构的对称性等,这在天然产物的结构分析中非常重要。
1898年Wien发现带正电荷的离子束在磁场中发生偏转;1918年Dempster发现采用电子轰击技术可使分子离子化;1919年Aston研制出了第一台速度聚焦质谱仪;在20世纪40年代以前MS还主要用于同位素的研究。1942年美国CEC(Consolidated Engineering Corporation)公司推出第一台商用质谱仪[37-38],当时主要应用在石油精炼和橡胶工业领域。1954年英国帝国化学工业的Beynon[39]在Nature发表文章阐明MS可用于已知化合物的定性分析;1962年Biemann[40]发表了一篇关于MS在有机化学中应用的文章,从此引发众多科学家的研究兴趣,MS技术得到了突飞猛进的发展。1965年MS开始用于天然产物吲哚生物碱的结构分析[41-42],如对生物碱cassipourine(14,图 7)的结构鉴定[43]。20世纪60年代末70年代初,科学家开始使用MS对甾体化合物结构进行研究,这大大加快了甾体结构鉴定的速度,例如应用MS阐明麦角甾-4, 6, 8, 22-四烯-3-酮(4, 6, 8, 22-ergostatetraen-3-one,15,图 7)的化学结构。这期间美国普渡大学(Purdue University)的Cooks教授(图 8)和McLaughlin教授发表了大量关于天然产物MS研究的文章[44]。Cooks教授是世界最著名的专门从事MS基础研究和质谱仪研发、应用的科学家,美国艺术与科学学院(American Academy of Arts and Science)院士,早在1985年就获得了质谱学领域的最高荣誉Thomson奖,2002年曾经获得过诺贝尔化学奖提名。我国20世纪80年代中国医学科学院北京协和医学院药用植物研究所丛浦珠教授编写了我国第一部天然产物MS专著[45]。
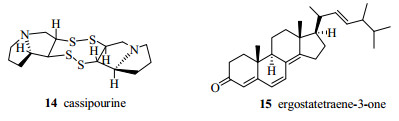
|
图 7 化合物14和15的结构 Fig.7 Chemical structures of compounds 14 and 15 |

|
图 8 R. Graham Cooks教授 Fig.8 Prof. R. Graham Cooks |
20世纪80年代以后,MS技术又得到了飞速发展,1981年Barber等[46]开发出快速原子轰击电离(fast atom bombardment,FAB-MS)技术,较好地解决了易分解、难挥发、中低等极性化合物的质谱测定,大大提高了MS的应用范围,成为天然产物结构鉴定中常用的离子化手段。1984年梁晓天[47]根据MS信息确定了从民间治疗支气管炎的中药猫眼草Euphorbia lunulata Bge.中分离的新化合物猫眼草素(maoyancaosu)的化学结构(17,图 9),而非之前确定的结构(16,图 9),就是根据MS中碎片离子M-CH2OH,否定了化合物16的可能。这期间美国康奈尔大学(Cornell University)的McLafferty还开发了MS联用技术[48]。后逐步发展了许多软离子技术,如场致电离(field ionization,FI)、场解吸电离、SI-MS(second ion mass spectrometry)、基质辅助激光解析电离(matrix-assisted laser desorption ionization,MALDI)、电喷雾质谱技术(electrospray ionization MS,ESI-MS)等,更多的质谱技术得到了实际应用。
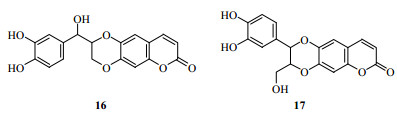
|
图 9 化合物16和17的化学结构 Fig.9 Chemical structures of compounds 16 and 17 |
电子轰击质谱(EI-MS)是天然化合物结构测定中应用最多的MS方法,易出现分子离子峰且重现性好,可以用于测定相对分子质量、分子式、碎片离子的元素组成和分子的裂解方式等,其中裂解碎片离子峰在不少情况下对推断化合物的分子骨架很有用,可以确定某些特定类型化合物分子结构片段连接顺序。例如齐墩果酸(oleanolic acid)[49],由于其分子在C12-C13位存在双键,在EI-MS中的优势裂解方式是RDA裂解(retro Diels-Alder fragmentation),而RDA裂解会产生2个关键的碎片离子峰,一个是以A、B环为骨架的碎片离子峰m/z 208,另一个是以D、E环为骨架的碎片离子峰m/z 248(通常为基峰或强峰),这2个离子可称为互补离子,二者之和为相对分子质量,因此当该化合物的A环和(或)D、E环上有取代基时,上述2种离子的质量数会根据取代基的质量数发生有规律的变化,即如果D或E环上连有1个羟基,那么相应于m/z 248的离子就是m/z 264,这对于推断齐墩果酸类三萜骨架取代基的位置很有用。不仅仅是齐墩果酸,含C12-C13双键的所有五环三萜及其类似物都有这个规律[50],如乌苏酸(ursolic acid)是齐墩果酸的同分异构体,也含C12-C13双键,二者的EI-MS几乎完全一致,但是当C-11存在羰基同时C12-C13位存在双键时,除了RDA裂解,还存在麦氏重排(McLafferty rearrangement)[51]。在黄酮类化合物中也有同样的RDA裂解,产生2个分别以A、B环为骨架的碎片离子A1(m/z 120)和B1(m/z 102),这2个离子也可称为互补离子,二者之和即为黄酮母核的相对分子质量。此外,还可以根据黄酮类化合物A、B环碎片离子的质量推测A、B环上的取代情况,例如A1 m/z 136增加的16个质量单位,说明在A环上有1个羟基取代,同理,如果A环碎片离子增加了32个质量单位则说明在A环上有2个羟基取代,增加30个质量单位说明在A环上有1个甲氧基或羟甲基取代,在B环上也是一样。蒽醌、香豆素、甾体化合物等都有明确的裂解规律可循(图 10)[52-54]。
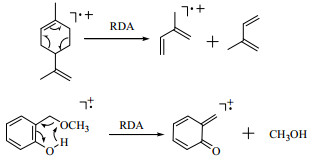
|
图 10 RDA裂解 Fig.10 Retro Diels-Alder fragmentation |
2.4 NMR
NMR是一种基于具有自旋性质的原子核在核外磁场作用下吸收射频辐射而产生能级跃迁的谱学技术。1946年美国物理学家Bloch和Purcell因分别首次独立观测到NMR信号而共同获得1952年的诺贝尔物理奖。第一台核磁共振仪(Varian公司)于1952年问世,当时的分辨率仅有30 MHz。1959年发现偶合常数(coupling constant)取决于邻位氢的二面夹角,1963年发表了计算偶合常数和邻位氢的二面夹角关系的Karplus公式[55]。1962年第一台220 MHz的超导核磁共振仪问世。1965年美国科学家Overhauser(图 11)发现了NOE(nuclear overhauser effect)并应用于化合物的构象研究。1966年发展起来的脉冲傅里叶变换(fourier transform)技术被应用到NMR领域,使信号采集由频域变为时域,大大提高了检测灵敏度,同时这种方法可以利用不同的脉冲组合来得到所需要的分子信息。1969年第一台90 MHz的傅里叶变换核磁共振仪(Bruker公司)被商业化生产。1971年Jeener提出具有2个独立时间变量的二维核磁共振概念,Ernst(图 11)等首次成功实现二维核磁共振实验,从此NMR技术进入了一个新时代。20世纪70年代中期,13C-NMR成了结构鉴定的常规分析方法。1979年观测到了碳氢相关二维核磁共振谱(HMQC)和二维NOE谱(NOESY)[56-58]。1981年NMR技术被应用于医疗诊断。1986年观测到了碳氢远程相关二维核磁共振谱[59-60]。1987年600 MHz的超导核磁共振仪问世(Varian公司)。1991年瑞士苏黎世大学(University of Zurich)科学家Ernst由于对二维核磁共振的贡献获得了在NMR领域的第2个诺贝尔奖。二维核磁共振谱是将化学位移、偶合常数等核磁共振参数展开在二维平面上,这样在一维谱中重叠在一个频率坐标轴上的信号分别在2个独立的频率坐标轴上展开,不仅减少了谱线的拥挤和重叠,而且提供了自旋核之间相互作用的信息,对推断一维核磁共振谱图中难以解析的复杂天然产物的结构具有重要作用。1992年750 MHz的超导核磁共振仪被用于结构鉴定。目前,NMR已形成为一门有完整理论体系的新学科,NMR被誉为有机物的指纹,它的应用使天然产物的结构鉴定进入了全新时代,尤其适用于不能获得单晶的化合物或液态化合物的构型、构象的结构分析。

|
图 11 Albert W. Overhauser (左)和Richard R. Ernst (右)教授 Fig.11 Prof. Albert W. Overhause (left) and Prof. Richard R. Ernst (right) |
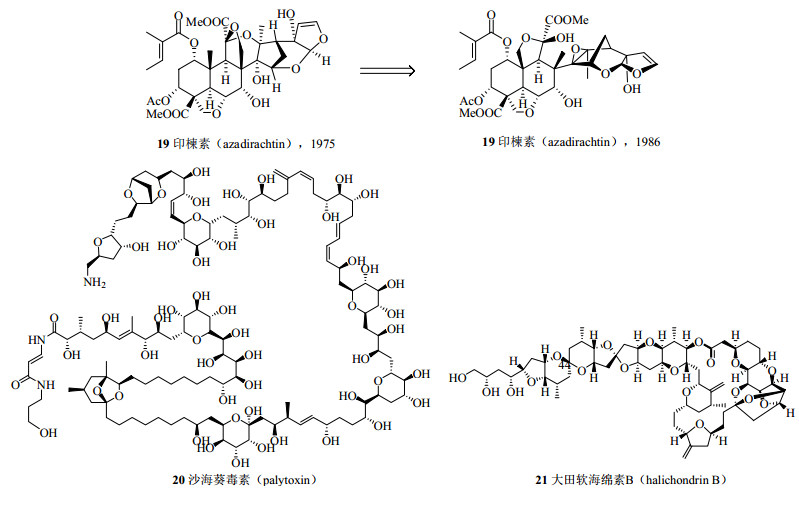
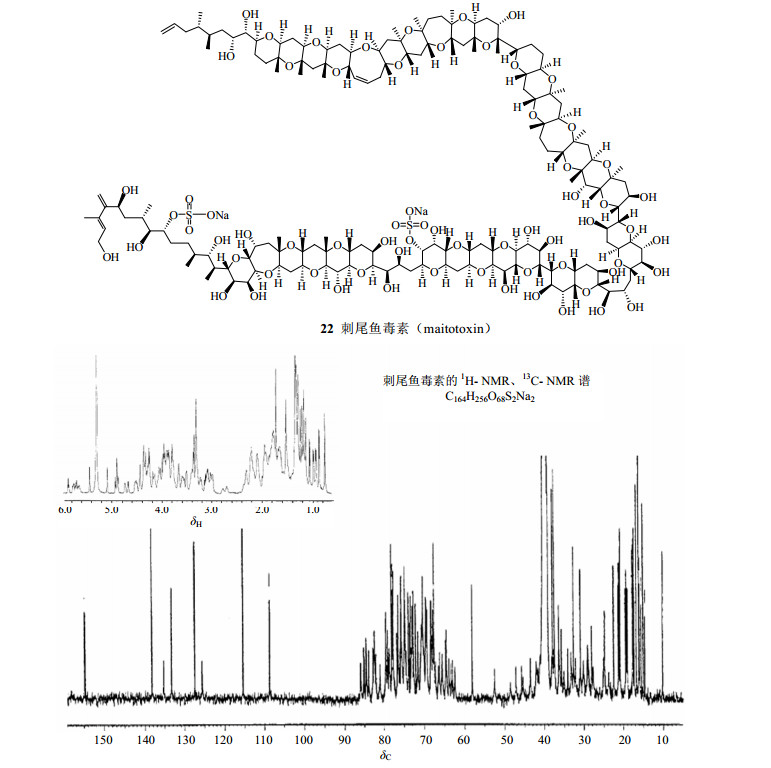
20世纪60年代中西香尔教授利用NMR研究紫杉宁(taxinine)的立体结构和确定银杏内酯(ginkgolide,18,图 12)结构,代表了当时应用NMR进行复杂天然产物结构鉴定的最高水平[61]。银杏内酯虽然相对分子质量并不太大,但其具有非常紧凑而奇特的碳骨架结构,碳骨架上碳原子高度官能团化,还有自然界很少出现的叔丁基、11个手性中心、2个季碳、6个五元环。20世纪70年代NMR用于结构确定的代表作是1975年印楝素(azadirachtin,19,图 13)的结构鉴定,尽管该结构在1986年被证实有一个环的环化位置出现了错误[62-63]。代表 20世纪80年代NMR技术应用最高水平当属从岩沙海葵Palythoa toxicus中分离得到的一个复杂的超级长链聚醚化合物岩沙海葵毒素(palytoxin,PTX,20,图 13)的结构鉴定,其相对分子质量高达2 677,分子式为C129H221O54N3,耗费10年时间于1981年底完成了其分子结构的测定,1982年平田义正(Yoshimasa Hirata)小组和美国的Moor小组同时报道了其立体构型[64-67],这是光谱技术和化学方法相结合进行结构鉴定的经典实例。另一个典型范例是1985年日本科学家上村大浦(Daisuke Uemura)和平田义正确定了大田软海绵素B(halichondrin B,21,图 13)的结构[68]。1992年日本科学家安元健(Takeshi Yasumoto)和村田道雄(Michio Murata)对刺尾鱼毒素(maitotoxin,MTX,22,图 14)结构鉴定的完成无疑代表了NMR在天然产物结构鉴定中的最高水平[69],MTX的分子式为C164H256O68S2Na2,相对分子质量高达3 422,是目前发现的最复杂的天然化合物。
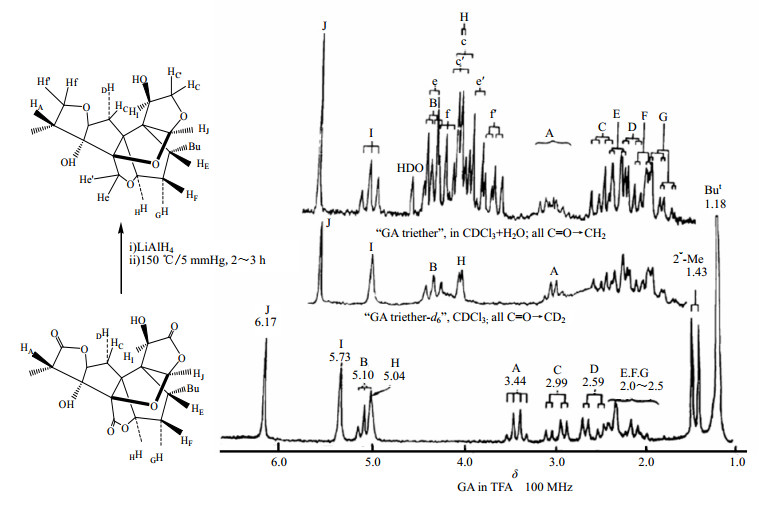
|
图 12 银杏内酯(18)的化学结构及其1H-NMR谱 Fig.12 Chemical structure and its 1H-NMR spectrum of ginkgolide (18) |
|
图 13 化合物19~21的化学结构 Fig.13 Chemical structures of compounds 19—21 |
|
图 14 刺尾鱼毒素的化学结构及其1H-NMR、13C-NMR谱 Fig.14 Chemical structure of maitotoxin and its 1H-NMR and 13C-NMR spectra |
现在800、900和950 MHz的核磁共振仪已经可以用于生物大分子的结构分析。20世纪80年代以后,瑞士科学家Wüthrich发展了一套将NMR技术应用于测定生物大分子结构领域的思路,并发明了一套系统方法,即将每一个NMR信号与生物大分子的氢质子一一对应起来,把这种方法叫做“序列指认”,为NMR研究生物大分子奠定了基础。1985年利用Wüthrich的方法确定了第一个蛋白质的结构。2002年诺贝尔化学奖的一半就授予Wüthrich,以表彰他用多维NMR波谱学在测定溶液中蛋白质结构的三维构象方面的开创性贡献。
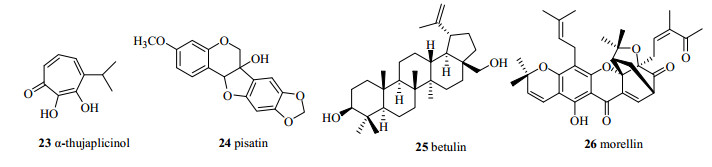
科学界认为对NMR在天然产物结构鉴定中的应用主要分为3个阶段:在20世纪60年代主要应用氢谱[70],1961年第一次完成天然产物α-thujaplicinol(23,图 15)NMR信号归属[71],次年完成了植物抗毒素pisatin(24,图 15)的NMR信号归属[72],1963年根据甲基的远程偶合确定了白桦脂醇(betulin,25,图 15)中甲基的相对立体构型并修正了由X-衍射确定的morellin(26,图 15)的结构[73-74];20世纪70年代出现碳谱[75];20世纪80年代发展了二维谱[76-77],特别是碳氢相关谱和碳氢远程相关谱的应用,给复杂天然产物化学的结构研究带来了革命性的发展[78-80]。
|
图 15 化合物23~26的化学结构 Fig.15 Chemical structures of compounds 23—26 |
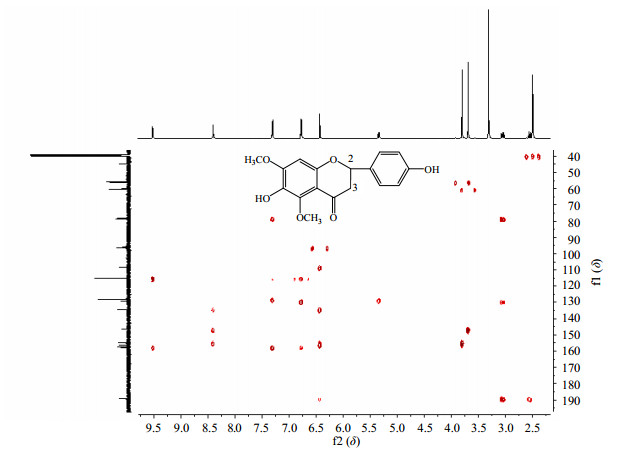
1H-NMR对于结构鉴定提供的信息主要有①吸收峰的组数,对一级图谱而言,能清楚表明分子中化学环境不同的质子有几组。②积分曲线高度说明各基团的质子数之比。③确定活泼氢的数目,在非极性溶剂如氘代氯仿中活泼氢的信号往往看不到,换成极性溶剂如氘代丙酮和氘代二甲基亚砜就能看到。④质子的化学位移值(d),说明分子中的不同的质子情况。⑤峰的分裂个数及偶合常数(J),主要说明各不同的质子之间的连接关系,最常利用二面夹角和J的关系确定相对构型[81-84]。⑥利用端基质子的J和端基碳的d判断苷键构型(α或β),但并非适用所有的糖,主要是用来确定吡喃醛糖(aldopyranosides)的苷键构型,有时还需要借助13C-NMR谱数据分析。⑦氢-氢相关谱(1H-1H COSY)可以把相互有偶合关系的质子关联起来。⑧HMQC)[85]、1H检测的异核多量子相干实验(1H detected heteronuclear muliple quantum coherence)或碳-氢异核单量子关系(heteronuclear singular quantum correlation, HSQC)、1H检测的异核单量子相干实验(1H detected heteronuclear single quantum coherence)[86]可以把分子中各个碳原子上的质子直接归属起来,而碳-氢远程相关谱(heteronuclear multiple bond correlation,HMBC)[77]可以把因为有杂原子或季碳原子而断开的质子链(有时相邻质子间二面夹角等于或接近90°时,J等于零也可能导致断链)相互连接起来完成化合物的平面结构,如一个黄酮分子(图 16)、一个倍半萜分子(图 17)的HMBC。再利用NOESY(nuclear Overhauser effect spectroscopy)或ROESY(rotating frame Overhause effect spectroscopy)[87-89]确定各个质子在三维空间上的分布(图 18)。⑨利用NOE效应,不仅可以用来确定分子中某些基团的位置、立体构型,还可以确定糖与糖及糖苷链与苷元的连接位置,是研究立体构型和优势构象的重要方法。有些情况下,还可以利用NOE差谱来帮助推断化合物的结构,特别是由于分子中含较多季碳原子或杂原子相连而用碳氢远程偶合无法判断时,可借助NOE差谱来完成碎片的连接。从举例化合物的HMBC图谱可以看出,HMBC是所有图谱中最为复杂的,分析起来也最为困难,但HMBC才能把因为有杂原子或季碳原子而断开的质子链相互关联起来,所以在天然产物结构鉴定中尤为重要。建议分析HMBC图谱最好从最强的甲基信号开始。
|
图 16 一个黄酮的化学结构及其HMBC谱 Fig.16 Chemical structure and HMBC spectrum of a flavonoid |
|
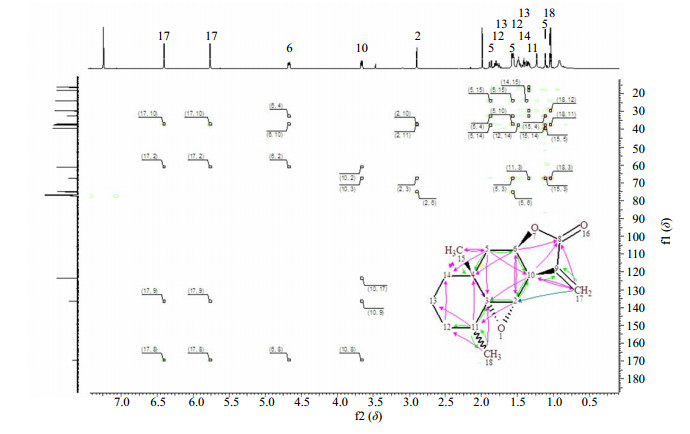
图 17 一个倍半萜的化学结构及其HMBC谱 Fig.17 Chemical structure and HMBC spectrum of a sesquiterpene |
|
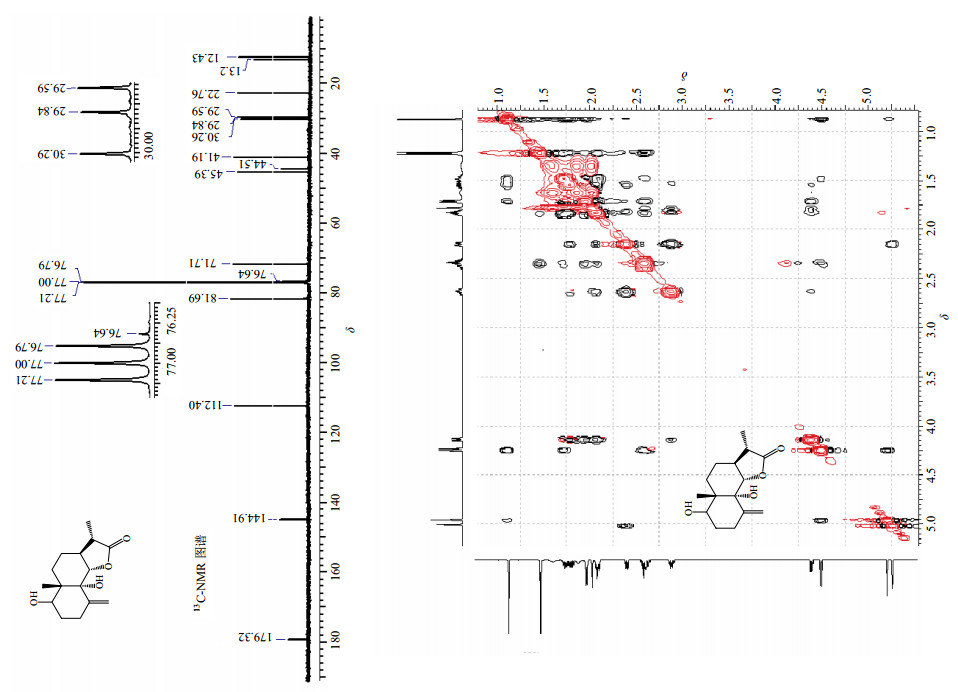
图 18 一个倍半萜的化学结构及其13C-NMR谱与NOESY谱 Fig.18 Chemical structure of a sesquiterpene and its 13C-NMR and NOESY spectra |
13C-NMR谱提供的最重要的信息也是化学位移。根据化学位移数据可以判断碳原子是sp2杂化还是sp3杂化、确定碳原子级数、准确测定驰豫时间、帮助指认碳原子以及确定是否连有杂原子,如果是羰基碳,还可初步判断羰基的类型即酮羰基还是醛羰基或是酯基上的羰基碳。碳原子的d范围非常大,甚至可超过2×10-4,而且碳原子对所处的化学环境比质子更敏感,如碳原子处于不同的构型和构象中,在碳谱中很少有信号完全重叠(图 18)。对于季碳原子的判断,碳谱比氢谱更具有优势。但是13C-NMR也有缺点,如灵敏度较低(在同等实验条件下是1H-NMR的1/6 000)、信噪比差等。在解析时不要遗漏季碳的谱线,因为季碳信号非常弱,此外还需注意区分杂质峰、溶剂峰[90]。
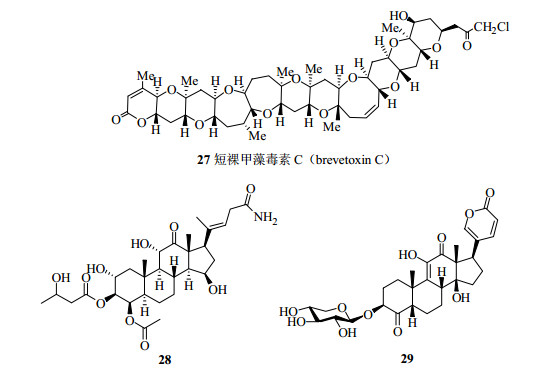
尽管核磁共振仪的灵敏度还远远不如质谱仪的灵敏度高[91],但现在使用微量探头(microprobe)或超低温微量探头测定0.5 mg以下微量样品的结构鉴定已经不成问题[92-93]。如1992年出现了3 mm样品管,样品用量由600μL降至140μL,并且灵敏度(S/N)增加;1995年利用一维和二维NMR技术用800μg样品完成复杂结构短裸甲藻毒素C(brevetoxin C,27,图 19)的氢谱和碳谱数据的归属[94];2000年发展的低温探头进一步增加约3.5倍的灵敏度,现在1 mm的样品管需要样品量已经降到nmol级别[95]。例如用毛细管NMR法(capillary NMR,CapNMR)测定2个从昆虫中得到的甾体化合物(28、29,图 19)的结构仅需40 nmol的样品[95],测定马钱子碱的HMBC谱仅需15 nmol(5.4μg)的样品。
|
图 19 Brevetoxin C以及化合物28和29的化学结构 Fig.19 Chemical structures of brevetoxin C and compounds 28 and 29 |
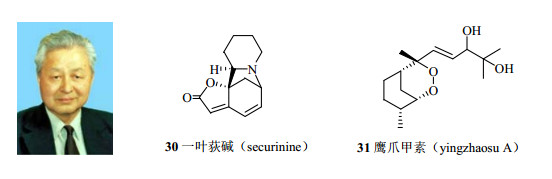
从20世纪60、70年代,我国科学家在核磁技术研究与应用中也做出过重要贡献。中科院院士、药物化学家梁晓天(图 20)是我国核磁共振技术的开拓者,曾编写过《核磁共振光谱解释简编》(1964年)和《核磁共振高分辨氢谱的解析和应用》(1976年)2本专著,对于在我国推广和普及NMR技术起到非常重要的作用。梁晓天院士先后完成了一叶荻碱(securinine,30,图 20)、川楝素(toosendanin)、鹤草酚(agrimophol)、鹰爪甲素(yingzhaosu A,31,图 20)、鹰爪乙素(yingzhaosu B)、创新霉素(creatmycin)、亮菌甲素(armillarisin A)、芍药新苷(lactiflorin)、杜鹃素(farrerol)以及一些二萜生物碱类等数十个复杂天然产物的结构鉴定。鹰爪甲素(31)中的过氧桥对于青蒿素的结构鉴定起到一定的启发作用,尽管有关鹰爪甲素结构的论文比青蒿素结构的论文发表得略晚。
|
图 20 梁晓天院士以及一叶荻碱、鹰爪甲素的化学结构 Fig.20 Chemical structures of securinine and yingzhaosu A identified by Academician Liang Xiao-tian |
2.5 结构鉴定中的错误修正
虽然“四大光谱”技术经日臻完善,但在结构鉴定中也时有错误发生,尤其在海洋天然产物的立体结构的确定中,有文献总结了近年被修正的天然产物的结构[21, 96-98],如2001年上村大浦从日本海绵Pseudoceratina purpurea中分离得到的zamamistatin(32,图 21),用二维核磁技术确定了平面结构并用Mosher法确定了其立体构型[99],2006年该结构得到了修正[100]。
从专业文献查阅以及笔者曾经研究的课题看,天然产物结构确定中的错误比较集中在11 (15→1)重排紫杉烷类化合物的结构,这类化合物最初都是被当作最常见的正常6/8/6环系紫杉烷类化合物。
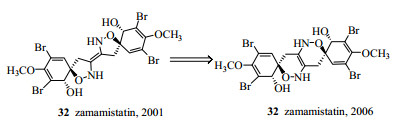
|
图 21 Zamamistatin的化学结构 Fig.21 Chemical structure of zamamistatin |
Brevifoliol(33,图 22)是分离得到的第一个具有这种骨架的紫杉烷类二萜,最初将其结构误定为6/8/6环系,1993年才更正为5/7/6环[101-102],事实上这种新的紫杉烷骨架早在1992年就被中国吴大刚和日本京都大学的富士熏(Fuji K.)2个研究小组同时分离得到,但因为吴大刚以中文发表研究论文所以未引起人们的注意[103-104],后来一大批该类化合物都是通过和文献比较来确定结构,再后来具有这种重排骨架的紫杉烷越来越多地被分离出来,直到从日本红豆杉中得到的taxuspine A(34,图 22),正确确定了11 (15→1)重排紫杉烷的结构[104]并第一个用英文发表后,研究者才开始重新对比这类化合物和正常的6/8/6环系紫杉烷类化合物波谱,发现这两个骨架的化合物1H-NMR谱基本一致,13C-NMR谱的差别主要在C-1和C-15上,实际上在11 (15→1)骨架的紫杉烷中C-1比正常6/8/6环系紫杉烷类化合物明显向低场位,导致一批此类化合物的结构被修正[105-106],出现这种错误的根本原因是没有做或没有做好HMBC谱。在HMBC谱中,11 (15→1)骨架的紫杉烷中看不到16、17位甲基上质子和C-11的远程偶合,而这个远程偶合在正常6/8/6环系紫杉烷类化合物很明显;相反,在11 (15→1)骨架的紫杉烷中可以看到H-14和C-11的远程偶合,而这个偶合在正常6/8/6环系紫杉烷类化合物却是看不到的[106]。
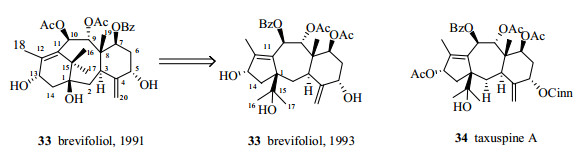
|
图 22 化合物33和34的化学结构 Fig.22 Chemical structures of compounds 33 and 34 |
3 结语
随着“四大光谱”技术在结构鉴定中的应用越来越普及、越来越重要,化学鉴定法已经基本处于辅助角色。光谱鉴定法在天然产物结构鉴定中的突出优势就是样品用量少,一般2~3 mg即可,省时、简便;除MS外,其他方法无样品消耗,可回收再利用;高分辨MS还可以准确地确定化合物的分子式。特别是核磁共振仪,可以长时间处于待机工作状态,随时可以测定结构,而且操作简便无需培训。需要注意的是,光谱法推断结构中的“一致性”非常重要:四大光谱要相互佐证、相互支持、相互吻合,如出现不一致或矛盾,说明推出的结构一定存在问题。
测定天然产物的绝对构型(absolute configuration)的可靠的方法还是X射线衍射法(X-ray diffraction)但是X射线衍射法需要单晶,对于不易结晶或量很少的天然产物来说有很大的局限性。20世纪50年代,旋光色散光谱法(optical rotatory dispersion,ORD)和圆二色谱(circular dichroism,CD)广泛用于天然产物绝对构型研究。1961年Djerassi[107-108]收集大量甾体化合物的数据归纳出了“八区律(Octet rules)”。20世纪60年代,中西香尔提出“CD激子手性法(exciton chirality CD method,ECCD)”确定化合物的绝对构型[109]。但是这些方法需要专门的技术以及复杂的计算,都不如四大光谱法应用简便。现在NMR技术不仅可以确定天然产物的相对构型(relative configuration)[110],还可以确定它们的绝对构型,如采用Mosher法测定仲醇类化合物的手性[111-113]。
近30年来,现代结构解析方法(NMR、MS、IR、UV、ORD、CD、X-ray),尤其是二维NMR技术的应用,如1H-1H COSY、HMQC、HMBC、NOESY等,都促使天然产物化学的研究速度大大加快。除了1991年诺贝尔化学奖获得者Ernst对二维NMR技术应用研究的贡献,还有如村田(Murata)创立的根据邻位的偶合常数决定构型的方法(Murata’s method of J-based configurational assignment),岸义人(Yoshito Kishi)创立的核磁数据库(Kishi’s NMR database method)、Mosher酯衍生物分析法(Mosher ester analysis)、Rychnovsky’s acetonide method等。目前,鉴定技术的进步也使得待确定结构的化合物样品需要量越来越小,几毫克、几微克就能够完成[78, 82, 114-116]。
特别值得一提的是近年来发展起来三维NMR(3D-NMR)、固相NMR[112]和气相核磁共振[113]以及碳-碳偶合、碳-氢偶合常数[117-120]计算机辅助数据处理[121-122]等技术已经应用到结构鉴定中,对于一些结构特别复杂的天然产物的结构鉴定,还有一些比较特殊的核磁共振技术偶尔也被应用[123-125]。低温超导探头的应用也将NMR的灵敏度大大提高,可使原来需要几天的实验缩短为几个小时[126-128]。800 MHz以上的超高场超导核磁共振仪将在生命科学研究领域特别是蛋白质的结构测定中发挥越来越重要的作用。美国科学家首次利用NMR技术测定分子间的相互作用、活性分子和受体结构的构象并提出用NMR技术研究药物构-效关系(SAR)的概念,将为小分子药物的结构优化和新药研发带来更大的帮助[129-131]。近20年来,新的NMR技术在不断被发明及应用,在将来天然产物的结构鉴定水平还会迈上一个新的台阶。
天然产物对人类最大的贡献就是作为药物为人类所用,自从有人类历史以来,天然产物一直是人类防病治病的主要来源。天然产物作为化学和生物学之间的天然通道,是大自然经过漫长的筛选和进化选择出来的,可作为药物半合成的前体物、药物化学合成的模板以及为药物设计提供新的思路[15]。天然产物的结构与功能研究将对新药发现、生命科学的认识、探索药物作用机制都具有重要科学意义。
| [1] | Li J W H, Vederas J C. Drug discovery and natural products: end of an era or an endless frontier?[J]. Science , 2009, 325 (5937) :161–165. DOI:10.1126/science.1168243 |
| [2] | Mohr J T, Krout M R, Stoltz1 B M. Natural products as inspiration for the development of asymmetric catalysis[J]. Nature , 2008, 455 (7211) :323–332. DOI:10.1038/nature07370 |
| [3] | Clardy J, Walsh C. Lessons from natural molecules[J]. Nature , 2004, 432 (7019) :829–837. DOI:10.1038/nature03194 |
| [4] | Paterson I, Anderson E A. The renaissance of natural products as drug candidates[J]. Science , 2005, 310 (5747) :451–453. DOI:10.1126/science.1116364 |
| [5] | Altmann K H, Gertsch J. Anticancer drugs from nature-natural products as a unique source of new microtubule-stabilizing agents[J]. Nat Prod Rep , 2007, 24 (2) :327–357. DOI:10.1039/B515619J |
| [6] | Saklani A, Kutty S K. Plant-derived compounds in clinical trials[J]. Drug Discov Today , 2008, 13 (3/4) :161–171. |
| [7] | Cordell G A. Natural products in drug discovery-Creating a new vision[J]. Phytochem Rev , 2002, 1 (3) :261–273. DOI:10.1023/A:1026094701495 |
| [8] | 史清文, 李力更, 霍长虹, 等. 天然药物化学学科的发展以及与相关学科的关系[J]. 中草药 , 2011, 42 (8) :1457–1463. |
| [9] | 史清文. 天然药物化学史话:紫杉醇[J]. 中草药 , 2011, 42 (10) :1878–1884. |
| [10] | 郭瑞霞, 李骘, 李力更, 等. 天然药物化学史话:银杏内酯[J]. 中草药 , 2013, 44 (6) :641–645. |
| [11] | 李骘, 刘诣, 李力更, 等. 天然药物化学史话:岩沙海葵毒素的全合成[J]. 中草药 , 2013, 44 (18) :2630–2633. |
| [12] | 郭瑞霞, 李力更, 王磊, 等. 天然药物化学史话:河豚毒素[J]. 中草药 , 2014, 45 (9) :1330–1335. |
| [13] | 郭瑞霞, 李力更, 付炎, 等. 天然药物化学史话:奎宁的发现、化学结构以及全合成[J]. 中草药 , 2014, 45 (19) :2737–2742. |
| [14] | 付炎, 李力更, 王于方, 等. 天然药物化学史话:维生素B12[J]. 中草药 , 2015, 46 (9) :1259–1264. |
| [15] | 郭瑞霞, 李力更, 王于方, 等. 天然药物化学史话:天然产物化学研究的魅力[J]. 中草药 , 2015, 46 (14) :2019–2033. |
| [16] | 郭瑞霞, 李力更, 王于方, 等. 天然药物化学史话:甾体化合物[J]. 中草药 , 2016, 47 (8) :1251–1264. |
| [17] | 王思明, 王于方, 李勇, 等. 天然药物化学史话:来自海洋的药物[J]. 中草药 , 2016, 47 (10) :1629–1642. |
| [18] | Todd L. Robert Robinson (1886-1975)[J]. Nat Prod Rep , 1987, 4 (1) :3–11. |
| [19] | Bentley K W. Sir Robert Robinson-his contribution to alkaloid chemistry[J]. Nat Prod Rep , 1987, 4 (1) :3–23. |
| [20] | Bernal J D. Properties and structures of crystalline vitamins[J]. Nature , 1932, 129 (3263) :721–732. |
| [21] | Nicolaou K C, Snyder S A. Chasing molecules that were never there: Misassigned natural products and the role of chemical synthesis in modern structure elucidation[J]. Angew Chem Int Ed , 2005, 44 (14) :1012–1044. |
| [22] | Muller J M, Schlittler E, Bein H J. Reserpine, the sedative principle from Rauwolfia serpentina B[J]. Experientia , 1952, 8 (9) :338–342. DOI:10.1007/BF02174406 |
| [23] | Woodward R B, Bader F E, Bickel H, et al. The total synthesis of reserpine[J]. J Am Chem Soc , 1956, 78 (11) :2023–2025. |
| [24] | Woodward R B. Structure and the absorption spectra ofα, β-unsaturated ketones[J]. J Am Chem Soc , 1941, 63 (4) :1123–1126. DOI:10.1021/ja01849a066 |
| [25] | Woodward R B. Structure and absorption spectra IV: Further observations on alpha, beta-unsaturated ketones[J]. J Am Chem Soc , 1942, 64 (1) :76–77. DOI:10.1021/ja01253a019 |
| [26] | Fieser L F, Fieser M, Rajagopalan S. Absorption spectroscopy and the structure of the diosterols[J]. J Org Chem , 1948, 13 (6) :800–806. DOI:10.1021/jo01164a003 |
| [27] | Peng J, Place A R, Yoshida W, et al. Structure and absolute configuration of karlotoxin-2, an ichthyotoxin from the marine dinoflagellate Karlodinium veneficum[J]. J Am Chem Soc , 2010, 132 (10) :3277–3279. DOI:10.1021/ja9091853 |
| [28] | Van Wagoner R M, Deeds J R, Satake M, et al. Isolation and characterization of karlotoxin 1, a new amphipathic toxin from Karlodimiun veneficum[J]. Tetrahedron Lett , 2008, 49 (45) :6457–6461. DOI:10.1016/j.tetlet.2008.08.103 |
| [29] | Kirk D N. Steroids: physical methods[J]. Nat Prod Rep , 1989, 6 (4) :394–404. |
| [30] | 范康年. 谱学导论[M]. 北京: 高等教育出版社, 2001 . |
| [31] | Roberts G, Gallagher B S, Jones R N. Infrared Absorption Spectra of Steroids[M].Vol. 2. New York: Interscience, 1958 . |
| [32] | Dobriner K, Katzenellenbogen E R, Jones R N. Infrared Absorption Spectra of Steroids [M].Vol. 1. New York: Interscience, 1953 . |
| [33] | 谢晶曦. 红外光谱在有机化学和药物化学中的应用[M]. 北京: 科学出版社, 1987 . |
| [34] | 中西香尔, Solomon P H.红外光谱分析100例[M].王绪明译.北京:科学出版社, 1984. |
| [35] | Cozzolino D. Near infrared spectroscopy in natural products analysis[J]. Planta Med , 2009, 75 (7) :746–756. DOI:10.1055/s-0028-1112220 |
| [36] | Cardellina J H, Dalietos D, Marner F J, et al. (?)-trans-7 (S)-Methoxytetradec-4-enoic acid and related amides from the marine cyanophyte Lyngbya majuscula[J]. Phytochemistry , 1978, 17 (12) :2091–2095. DOI:10.1016/S0031-9422(00)89287-0 |
| [37] | Washburn H W, Wiley H F, Rock S M. The mass spectrometer as an analytical tool[J]. Ind Eng Chem Anal Ed , 1943, 15 (9) :541–547. DOI:10.1021/i560121a001 |
| [38] | Washburn H W, Wiley H F, Rock S M, et al. Mass spectrometry[J]. Ind Eng Chem Anal Ed , 1945, 17 :74–81. DOI:10.1021/i560138a003 |
| [39] | Beynon J H. Qualitative analysis of organic compounds by mass spectrometry[J]. Nature , 1954, 174 (5) :735–737. |
| [40] | Biemann K. Mass Spectrometry: Organic Chemical Applications[M]. New York: McGraw-Hill, 1962 . |
| [41] | Biemann K, Grossert J S, Hugo J M, et al. The indole alkaloids. Part IV. The structure of henningsamine[J]. J Chem Soc , 1965, 46 (1) :2814–2818. |
| [42] | Biemann K, Grossert J S, Occolowitz J, et al. The indole alkaloids. Part V. The structure of henningsoline[J]. J Chem Soc , 1965, 46 (1) :2818–2822. |
| [43] | Cooks R G, Warren F L, Williams D H. Rhizophoraceae alkaloids. Part III. Cassipourine[J]. J Chem Soc , 1967, 47 (1) :286–288. |
| [44] | Kondrat R W, Cooks R G, McLaughlin J L. Alkaloids in whole plant material: Direct analysis by kinetic energy spectrometry[J]. Science , 1978, 199 (4332) :978–979. DOI:10.1126/science.199.4332.978 |
| [45] | 丛浦珠. 质谱学在天然有机化学中的应用[M]. 北京: 科学出版社, 1987 . |
| [46] | Barber M, Bordoli R S, Sedgwick R D, et al. Fast atom bombardment of solids (FAB): a new ion source for mass spectrometry[J]. J Chem Soc Chem Commun , 1981, 103 (21) :325–327. |
| [47] | 梁晓天. 质谱在天然产物研究中的应用举例[J]. 分析测试通报 , 1988, 7 (6) :1–5. |
| [48] | McLafferty F W. Tandem mass spectrometry[J]. Science , 1981, 214 (4518) :280–287. DOI:10.1126/science.7280693 |
| [49] | Pollier J, Goossens A. Oleanolic acid[J]. Phytochemistry , 2012, 77 (5) :10–15. |
| [50] | Xu R, Fazio G C, Matsuda S P T. On the origins of triterpenoid skeletal diversity[J]. Phytochemistry , 2004, 65 (3) :261–291. DOI:10.1016/j.phytochem.2003.11.014 |
| [51] | McLafferty F W. Mass spectrometric analysis. molecular rearrangement[J]. Anal Chem , 1959, 31 (1) :82–87. DOI:10.1021/ac60145a015 |
| [52] | Biemann K. The application of mass spectrometry in organic chemistry: determination of the structure of natural products[J]. Angew Chem Int Ed , 1962, 1 (2) :98–111. DOI:10.1002/(ISSN)1521-3773 |
| [53] | Grossert J S. A retrospective view of mass spectrometry and natural products-sixty years of progress, with a focus on contributions by R. Graham Cooks[J]. Int J Mass Spectrom , 2001, 212 (1/3) :65–79. |
| [54] | McLafferty F W. A century of progress in molecular mass spectrometry[J]. Annu Rev Anal Chem , 2011, 4 (4) :1–22. |
| [55] | Karplus M. Vicinal proton coupling in nuclear magnetic resonance[J]. J Am Chem Soc , 1963, 85 (18) :2870–2871. DOI:10.1021/ja00901a059 |
| [56] | Muller L. Sensitivity enhanced detection of weak nuclei using heteronuclear multiple quantum coherence[J]. J Am Chem Soc , 1979, 101 (16) :4481–4484. DOI:10.1021/ja00510a007 |
| [57] | Jeener J, Meier B H, Bachman P, et al. Investigation of exchange processes by two-dimensional NMR spectroscopy[J]. J Chem Phys , 1979, 71 (11) :4546–4553. DOI:10.1063/1.438208 |
| [58] | Morris G, Freeman R. Enhancement of nuclear magnetic resonance signals by polarization transfer[J]. J Am Chem Soc , 1979, 101 (3) :760–762. DOI:10.1021/ja00497a058 |
| [59] | Bax A, Aszalos A, Dinya Z, et al. Structure elucidation of the antibiotic desertomycin through the use of new two-dimensional NMR techniques[J]. J Am Chem Soc , 1986, 108 :8056–8063. DOI:10.1021/ja00285a029 |
| [60] | Bax A, Summers M F. 1H and 13C assignments from sensitivity-enhanced detection of heteronuclear multiple-bond connectivity by 2D multiple quantum NMR[J]. J Am Chem Soc , 1986, 108 (8) :2093–2094. DOI:10.1021/ja00268a061 |
| [61] | Nakanishib K. Terpene trilactones from Gingko biloba: From ancient times to the 21st century[J]. Bioorg Med Chem , 2005, 13 (17) :4987–5000. DOI:10.1016/j.bmc.2005.06.014 |
| [62] | Broughton H B, Ley S V. X-Ray crystallographic structure determination of detigloyldihydroazadirachtin and reassignment of the structure of the limonoid insect antifeedant azadirachtin[J]. J Chem Soc Chem Commun , 1986, 1 (1) :46–47. |
| [63] | Jauch J. Total synthesis of azadirachtin-finally completed after 22 years[J]. Angew Chem Int Ed , 2008, 47 (1) :34–37. DOI:10.1002/(ISSN)1521-3773 |
| [64] | Uemura D, Ueda K, Hirata Y, et al. Further studies on palytoxin. II. structure of palytoxin[J]. Tetrahedron Lett , 1981, 22 (29) :2781–2784. DOI:10.1016/S0040-4039(01)90551-9 |
| [65] | Crews P, Moore R E, Naylor S, et al. Progress in The Chemistry of Organic Natural Products[M]. New York: Springer, 1985 . |
| [66] | Moore R E, Bartolini G. Structure of palytoxin[J]. J Am Chem Soc , 1981, 103 (9) :2491–2494. DOI:10.1021/ja00399a093 |
| [67] | Cha J K, Christ W J, Finan J M, et al. Stereochemistry of palytoxin. Part 4. Complete structure[J]. J Am Chem Soc , 1982, 104 (25) :7369–7371. DOI:10.1021/ja00389a101 |
| [68] | Uemura D, Takahashi K, Yamamoto T, et al. Norhalichondrin A: An antitumor polyether macrolide from a marine sponge[J]. J Am Chem Soc , 1985, 107 (16) :4796–4798. DOI:10.1021/ja00302a042 |
| [69] | Murata M, Iwashita T, Yokoyama A, et al. Partial structures of maitotoxin, the most potent marine toxin from the dinoflagellate Gambierdiscus toxicus[J]. J Am Chem Soc , 1992, 114 (16) :6594–6596. DOI:10.1021/ja00042a070 |
| [70] | Trehan I R, Monder C, Bose A K. NMR spectral studies. V. Classification of steroid alcohols by NMR spectroscopy[J]. Tetrahedron Lett , 1968, 9 (1) :67–69. DOI:10.1016/S0040-4039(01)98728-3 |
| [71] | Zavarin E, Anderson A B, Smith R M. Occurrence of (?)-thujaplicinol in the heartwood of Cupressus pygmaea[J]. J Org Chem , 1961, 26 (1) :173–176. DOI:10.1021/jo01060a041 |
| [72] | Perrin D D, Perrin D R. Nuclear magnetic resonance (NMR) spectrum of pisatin[J]. J Am Chem Soc , 1962, 84 (10) :1922–1925. DOI:10.1021/ja00869a031 |
| [73] | Lehn J M, Vystreil A. Nuclear magnetic resonance (NMR) of natural products. VI. Triterpenes derived from betulin[J]. Tetrahedron , 1963, 19 :1733–1745. DOI:10.1016/S0040-4020(01)99248-8 |
| [74] | Kartha G, Ramachandran G N, Bhat H B, et al. Constitution of morellin[J]. Tetrahedron Lett , 1963, 4 (7) :459–472. DOI:10.1016/S0040-4039(01)90656-2 |
| [75] | Eggert H, VanAntwer C L, Bhacca N S, et al. Carbon-13 nuclear magnetic resonance spectra of hydroxy steroids[J]. J Org Chem , 1976, 41 (1) :71–78. DOI:10.1021/jo00863a016 |
| [76] | Ernst R R, Bodenhausen G, Wokaun A. Principles of Nuclear Magnetic Resonance in One-and Two-Dimensions[M]. London: Oxford University Press, 1987 . |
| [77] | Bax A, Summers M F. Proton and carbon-13 assignments from sensitivity-enhanced detection of heteronuclear multiple-bond connectivity by 2D multiple quantum NMR[J]. J Am Chem Soc , 1986, 108 (8) :2093–2094. DOI:10.1021/ja00268a061 |
| [78] | Bifulco G, Dambruoso P, Gomez-Paloma L, et al. Determination of relative configuration in organic compounds by NMR spectroscopy and computational methods[J]. Chem Rev , 2007, 107 (9) :3744–3779. DOI:10.1021/cr030733c |
| [79] | Fukushi E. Advanced NMR approaches for a detailed structure analysis of natural products[J]. Biosc Biotechnol Biochem , 2006, 70 (8) :1803–1812. DOI:10.1271/bbb.50663 |
| [80] | Topcu G, Ulubelen A. Structure elucidation of organic compounds from natural sources using 1D and 2D NMR techniques[J]. Cheminform , 2007, 34 :834–836. |
| [81] | Karplus M. Vicinal proton coupling in nuclear magnetic resonance[J]. J Am Chem Soc , 1963, 85 (18) :2870–2871. DOI:10.1021/ja00901a059 |
| [82] | Matsumori N, Kaneno D, Murata M, et al. Stereochemical determination of acyclic structures based on carbon-proton spin-coupling constants. A method of configuration analysis for natural products[J]. J Org Chem , 1999, 64 (3) :866–876. DOI:10.1021/jo981810k |
| [83] | Sugahara K, Kitamura Y, Murata M, et al. Prorocentrol, a polyoxy linear carbon chain compound isolated from the toxic Dinoflagellate Prorocentrum hoffmannianum[J]. J Org Chem , 2011, 76 (9) :3131–3138. DOI:10.1021/jo102585k |
| [84] | Poza J J, Jiménez C, Rodríguez J. J-based analysis and DFT-NMR assignments of natural complex Molecules: application to 3β, 7-dihydroxy-5, 6-epoxycholestanes[J]. Europ J Org Chem , 2008, 23 :3960–3969. |
| [85] | Bax A, Subramanian S. Sensitivity-enhanced four-dimensional hetero nuclear shift correlation NMR spectroscopy[J]. J Magn Res , 1986, 67 :565–569. |
| [86] | Willker W, Leibfritz D, Kerssebaum R, et al. Gradient selection in inverse heteronuclear correlation spectroscopy[J]. Magn Reson Chem , 1993, 31 (3) :287–292. DOI:10.1002/(ISSN)1097-458X |
| [87] | Parella T, Sanchez-Frrando F, Virgili A. Quick recording of pure absorption 2D TOSCY, ROESY, and NOESY spectra using pulsed field gradients[J]. J Magn Reson , 1997, 125 (1) :145–148. DOI:10.1006/jmre.1996.1069 |
| [88] | States D J, Haberkorn R A, Ruben D J. A two-dimensional nuclear Overhauser experiment with pure absorption phase in four quadrants[J]. J Magn Reson , 1982, 48 (2) :286–292. |
| [89] | Wagner R, Berger S. Gradient-selected NOESY. A fourfold reduction of measurement time for the NOESY experiment[J]. J Magn Reson , 1996, 123 (1) :119–121. DOI:10.1006/jmra.1996.0222 |
| [90] | Gottlieb H E, Kotlyar V, Nudelman A. NMR chemical shifts of common laboratory solvents as trace impurities[J]. J Org Chem , 1997, 62 (21) :7512–7515. DOI:10.1021/jo971176v |
| [91] | Victoria M, Elipe S. Advantages and disadvantages of nuclear magnetic resonance spectroscopy as a hyphenated technique[J]. Anal Chim Acta , 2003, 497 (1/2) :1–25. |
| [92] | Lacey M E, Subramanian S, Olson D L, et al. High-resolution NMR spectroscopy of sample volumes from 1 nL to 10μL[J]. Chem Rev , 1999, 99 (10) :3133–3152. DOI:10.1021/cr980140f |
| [93] | Schroeder F C, Gronquist M. Extending the scope of NMR spectroscopy with microcoil probes[J]. Angew Chem Int Ed , 2006, 45 (43) :7122–7131. DOI:10.1002/(ISSN)1521-3773 |
| [94] | Crouch R C, Martin G E, Dickey R W, et al. Brevetoxin-3: Total assignment of the 1H and 13C NMR spectra at the submicromole level[J]. Tetrahedron , 1995, 51 (33) :8409–8422. |
| [95] | Brey W W, Edison A S, Nast R E, et al. Non-destructive testing with mobile NMR[J]. J Magn Reson , 2006, 179 (2) :290–293. DOI:10.1016/j.jmr.2005.12.008 |
| [96] | Suyama T L, Gerwick W H, McPhail K L. Survey of marine natural product structure revisions: A synergy of spectroscopy and chemical synthesis[J]. Bioorg Med Chem , 2011, 19 (22) :6675–6701. DOI:10.1016/j.bmc.2011.06.011 |
| [97] | Maier M E. Structural revisions of natural products by total synthesis[J]. Nat Prod Rep , 2009, 26 (10) :1105–1124. |
| [98] | Elyashberg M, Williams A J, Blinov K. Structural revisions of natural products by computer-assisted structure elucidation (CASE) systems[J]. Nat Prod Rep , 2010, 27 (9) :1296–1328. DOI:10.1039/c002332a |
| [99] | Takada N, Watanabe R, Suenaga K, et al. Zamamistatin, a significant antibacterial bromotyrosine derivative, from the Okinawan sponge Pseudoceratina purpurea[J]. Tetrahedron Lett , 2001, 42 (31) :5265–5267. DOI:10.1016/S0040-4039(01)00993-5 |
| [100] | Hayakawa I, Teruya T, Kigoshi H. Revised structure of zamamistatin[J]. Tetrahedron Lett , 2006, 47 (2) :155–158. DOI:10.1016/j.tetlet.2005.10.157 |
| [101] | Balza F, Tachibana S, Barrios H, et al. Brevifoliol, a taxane from Taxus brevifolia[J]. Phytochemistry , 1991, 30 :1613–1614. DOI:10.1016/0031-9422(91)84218-H |
| [102] | Appendino G, Barboni L, Gariboldi P, et al. Revised structure of brevifoliol and some baccatin VI. derivatives[J]. J Chem Soc Chem Commun , 1993, 20 :1587–1589. |
| [103] | 刘锡葵, 吴大刚, 王宗玉. 红豆杉中一类新二萜成分[J]. 科学通报 , 1992, 38 (23) :593–594. |
| [104] | Fuji K, Tanaka K, Li B. Taxchinin A, A diterpenoid from Taxus chinensis[J]. Tetrahedron Lett , 1992, 33 :7915–7916. DOI:10.1016/S0040-4039(00)74777-0 |
| [105] | 黄开胜, 梁敬钰, GunatilakaA A L. 天然紫杉烷类化合物的氢谱及若干结构的修改意见[J]. 中国药科大学学报 , 1998, 29 (4) :259–266. |
| [106] | Wang Y F, Shi Q W, Dong M, et al. Natural taxanes: developments since 1828[J]. Chem Rev , 2011, 111 (12) :7652–7709. DOI:10.1021/cr100147u |
| [107] | Djerassi C. Optical Rotatory Dispersion[M]. New York: McGraw-Hill, 1960 . |
| [108] | Djerassi C. Recent advances in the mass spectrometry of steroids[J]. Pure Appl Chem , 1978, 50 (3) :171–184. |
| [109] | Harada N, Nakanishi K. Circular Dichroic Spectroscopy Exciton Coupling in Organic Stereochemistry[M]. Mill Valley: University Science Books, 1983 . |
| [110] | Seco J M, Quinoa E, Riguera R. The assignment of absolute configuration by NMR[J]. Chem Rev , 2004, 104 (1) :117–118. |
| [111] | Dale J A, Mosher H S. Dale J A, Mosher H S. Nuclear magnetic resonance enantiomer regents. Configurational correlations via nuclear magnetic resonance chemical shifts of diastereomeric mandelate, O-methylmandelate, andα-methoxy-α-trifluoromethylphenylacetate (MTPA) esters[J]. J Am Chem Soc , 1973, 95 (2) :512–519. DOI:10.1021/ja00783a034 |
| [112] | Barjat H, Morris G A, Swanson A G. A three-dimensional DOSY-HMQC experiment for the high-resolution analysis of complex mixtures[J]. J Mag Reson , 1998, 131 (1) :131–138. DOI:10.1006/jmre.1997.1332 |
| [113] | Schwalbe H, Bielecki A. Recent advances in high-resolution solid-state NMR spectroscopy[J]. Angew Chem Int Ed , 2001, 40 (11) :2045–2050. DOI:10.1002/(ISSN)1521-3773 |
| [114] | Rychnovsky S D, Rogers B, Yang G. Analysis of two carbon-13 NMR correlations for determining the stereochemistry of 1, 3-diol acetonides[J]. J Org Chem , 1993, 58 (13) :3511–3515. DOI:10.1021/jo00065a011 |
| [115] | Marquez B L, Gerwick W H, Williamson R T. Survey of NMR experiments for the determination of nJ (C, H) heteronuclear coupling constants in small molecules[J]. Magn Reson Chem , 2001, 39 (9) :499–530. DOI:10.1002/(ISSN)1097-458X |
| [116] | Riccio R, Bifulco G, Cimino P, et al. Stereochemical analysis of natural products. Approaches relying on the combination of NMR spectroscopy and computational methods[J]. Pure Appl Chem , 2003, 75 (2/3) :295–308. |
| [117] | Wu J, Bondo P B, Vuorinen T, et al. 13C-13C Spin coupling constants in aldoses enriched with 13C at the terminal hydroxymethyl carbon: effect of coupling pathway structure on JCC in carbohydrates[J]. J Am Chem Soc , 1992, 114 (9) :3499–3505. DOI:10.1021/ja00035a051 |
| [118] | Lesage A, Bardet M, Emsley L. Through-bond carbon-carbon connectivities in disordered solids by NMR[J]. J Am Chem Soc , 1999, 121 (47) :10987–10993. DOI:10.1021/ja992272b |
| [119] | Ferreira M J P, Branta A J C, Rodrigues G V, et al. Automatic identification of terpenoid skeletons through 13C nuclear magnetic resonance data disfunctionalization[J]. Anal Chim Acta , 2001, 429 (1) :151–170. DOI:10.1016/S0003-2670(00)01268-X |
| [120] | Hansen P O. Carbon-hydrogen spin-spin coupling constants[J]. Prog NMR Spectrose , 1981, 14 (4) :175–296. DOI:10.1016/0079-6565(81)80001-5 |
| [121] | Kjellerg A, Nishida T, Weitraub A, et al. NMR spectroscopy of 13C-enriched polysaccharides: Application of 13C-13C TOCSY to sugars of different configuration[J]. Magn Reson Chem , 1998, 36 (2) :128–131. DOI:10.1002/(ISSN)1097-458X |
| [122] | Elyashberg M E, Blinov K A, Williams A J, et al. Application of a new expert system for the structure elucidation of natural products from their 1D and 2D NMR data[J]. J Nat Prod , 2002, 65 (7) :693–703. |
| [123] | Kan Y, Uemura D, Hirata Y, et al. Complete NMR signal assignment of palytoxin and N-acetylpalytoxin[J]. Tetrahedron Lett , 2001, 42 (18) :3197–3202. DOI:10.1016/S0040-4039(01)00407-5 |
| [124] | Martin G E, Hadden C E. Long-range 1H-15N heteronuclear shift correlation at natural abundance[J]. J Nat Prod , 2000, 63 (4) :543–585. DOI:10.1021/np9903191 |
| [125] | Krishnamurthy V V, Russell D J, Hadden C E, et al. 2J, 3J-HMBC: a new long-range heteronuclear shift correlation technique capble of differentiating 2JCH from 3JCH correlations to protonated carbons[J]. J Magn Reson , 2000, 146 (1) :232–239. DOI:10.1006/jmre.2000.2141 |
| [126] | Molinski T F. Microscale methodology for structure elucidation of natural products[J]. Curr Opin Biotechnol , 2010, 21 (6) :819–826. DOI:10.1016/j.copbio.2010.09.003 |
| [127] | Fellenberg M, Coksezen A, Meyer B. Characterization of picomole amounts of oligosaccharides from glycoproteins by 1H NMR spectroscopy[J]. Angew Chem Int Ed Engl , 2010, 49 (14) :2630–2633. DOI:10.1002/anie.v49:14 |
| [128] | Dalisay D S, Morinaka B I, Skepper C K, et al. A tetrachloro polyketide hexahydro-1H-isoindolone, muironolide A, from the marine sponge Phorbas sp. natural products at the nanomole scale[J]. J Am Chem Soc , 2009, 131 (22) :7552–7553. DOI:10.1021/ja9024929 |
| [129] | Medek A, Hajduk P J, Mack J, et al. The use of differential chemical shifts for determing the binding site location and orientation of protein-bound ligands[J]. J Am Chem Soc , 2000, 122 (6) :1241–1242. DOI:10.1021/ja993921m |
| [130] | Jimenez-Barbero J, Canales A, Northcote P T, et al. NMR determination of the bioactive conformation of peloruside A bound to microtubules[J]. J Am Chem Soc , 2006, 128 (27) :8757–8765. DOI:10.1021/ja0580237 |
| [131] | Tugarinov V, Sprangers R, Kay L E. Probing side-chain dynamics in the proteasome by relaxation violated coherence transfer NMR spectroscopy[J]. J Am Chem Soc , 2007, 129 (6) :1743–1750. DOI:10.1021/ja067827z |
 2016, Vol. 47
2016, Vol. 47


