毛茛科植物乌头Aconitum carmichaeli Debx. 为常用药用植物,除野生外,在四川、陕西等地均有栽培。其干燥母根为川乌,具有祛风除湿、温经止痛等功效;其子根为附子,为知名的川产道地药材,具有回阳救逆、补火助阳、散寒止痛等功效[1]。随着附子需求量的日益增大,乌头的种植面积也不断加大,并引种到多地。四川省江油市作为乌头的道地产区,近几年加大了种植规模,提高了附子及川乌的产量。笔者在对江油地区的栽培乌头调查中,发现乌头极易感染各种严重的病害,严重影响了附子、川乌药材的质量及产量。在诸多病害中,霜霉病是乌头栽培过程中极易发生的一种流行范围很广、危害面积大的严重病害,文献中对该病也有报道[2-6]。乌头染病后,叶背会慢慢覆盖一层灰褐色霉层,随后整株的叶片逐渐枯萎、干枯、死亡,所以在当地霜霉病也被称作“灰苗子病”。霜霉病染病周期长,侵染范围广,对该地区乌头的产量及品质造成严重的影响。余永年[2]将患霜霉病乌头叶子上发现的病原菌鉴定为霜霉属乌头霜霉Peronospora aconiti Yu,首次从形态上明确了乌头霜霉病病原菌的分类学地位,但未见进一步形态学研究的相关报道。通过查阅文献,在国内外也未见对该病原菌的准确鉴定和分析,这不利于病害的传播机制、病株的诊断和病害防治研究。
近年来的研究表明,以DNA为基础的核酸分析技术可以用来鉴定物种以及评价种属间的系统关系,尤其是核糖体DNA内转录间隔区(ribosomal DNA internal transcribed spacer,rDNA-ITS)。该区的编码区序列具有很强的保守性,在非转录区科、属、种水平上又有很高的变异性。真菌种类繁多,仅从形态学角度鉴定,需要经验丰富的工作经验和较长的检验时间。真菌的rDNA-ITS区段在属间及同属不同种间存在着广泛的多态性,对此序列的检测有助于分析其遗传关系,已广泛地应用于真菌分类鉴定和分子检测系统中[7-11]。28 S rDNA D1/D2区近年来也成为真菌分类鉴定的热门区域,乾义柯等[12]利用形态学鉴定和28 S rDNA D1/D2区序列对新疆甜菜的霜霉病病原菌进行了分析;刘建利[13]利用28 S rDNA D1/D2区和ITS rDNA序列来鉴定甜瓜白粉病病原菌。基于真菌rDNA区的序列分析,能够快速准确地反映其生物亲缘关系和分类情况,具有方便、高效的的优点。目前,国内外尚未见有关乌头霜霉Peronospora aconite rDNA-ITS序列和28 S rDNA D1/D2序列分析的相关报道。为此,本研究对乌头霜霉菌病原菌rDNA-ITS和28 S rDNA D1/D2序列进行测定和分析,以期从分子生物学的角度明确该病原菌rDNA-ITS序列和28 S rDNA D1/D2序列,明确其系统发育地位,为病害的传播机制研究、早期诊断和防治提供科学依据。
1 材料和方法 1.1 材料 1.1.1 病原菌来源乌头霜霉病病原菌采自于四川省江油市普照村雅安三九优质无公害附子GAP生产基地的乌头患病植株的叶面。先将患病的叶片带回实验室,对病原物进行形态学研究,结合文献报道[3]的形态学特征,明确病株的症状属于霜霉病,病原菌的形态学符合文献报道特征后,再采用无菌毛刷刷下分生孢子的方法[14],从新鲜的病叶上轻扫下病菌分生孢子及菌丝,−86 ℃冰箱冷冻保存备用。
1.1.2 主要仪器和试剂全自动样品快速研磨仪(上海净信科技部),Leica DM2000型光学显微镜,CT15RE高速冷冻离心机(日本Hitachi公司),T100 PCR扩增仪(美国Bio-Rad公司),MK2000-2干式恒温器(杭州奥盛仪器公司),GelDox XR+凝胶成像系统(美国BIO-Rad公司),ND2000核酸蛋白检测仪(美国Thermo公司)。OMEGA真菌DNA提取试剂盒、Taq DNA聚合酶、dNTPs、标准相对分子质量2 000、PCR产物回收试剂盒均购于成都海牧生物技术有限公司;其他生化试剂均为国产分析纯试剂。
1.2 病原菌形态观察将采集到的病叶用无菌水冲洗已有的病菌霉层,放入18~22 ℃的保湿箱。等待叶背重新长出浓密菌丝后,用无菌毛刷刷下霉层到载玻片上制成水装片观察病原菌孢子囊形态;采用透明胶带粘贴法[15],将小块透明胶带贴在菌丝生长的叶面上,而后取下放在载玻片上,滴一滴甘油乳酸加上盖玻片观察病原菌孢囊梗形态。
1.3 真菌基因组DNA的提取用无菌毛刷从枯黄的患病乌头叶背上刷下菌丝霉层到离心管中称质量,用全自动样品快速研磨仪低温充分研磨,采用OMEGA真菌DNA提取试剂盒进行基因组DNA提取。具体DNA提取步骤参照OMEGA真菌DNA提取试剂盒提取手册上的说明。核酸蛋白检测仪测定DNA浓度及其A260/A280值,涡旋混匀后,取5 μL DNA上清在0.8%琼脂糖凝胶电泳检测。
1.4 病原菌PCR扩增采用真菌核糖体内转录间隔区(ITS)通用引物ITS1/ITS4以及NL1/NL4[12](均由上海生工生物工程股份有限公司合成)对病原菌DNA进行PCR扩增。
1.4.1 引物序列ITS1(5’-TCCGTAGGTGAACCTG- CGG-3’)、ITS4(5’-TCCTCCGCTTATTGATATGC-3’)、 NL1(5’-TCCGTAGGTGAACCTGCGG-3’)、NL4(5’-TCCTCCGCTTATTGATATGC-3’)。
1.4.2 反应体系总体积为25 μL,1单位的Taq酶、10×buffer 2.5 μL、dNTP(各2.5 mmol/L)4 μL,10 μmol/L的正反向引物各1 μL、DNA模板1 μL,最后补加灭菌双蒸水到25 μL。
1.4.3 反应条件94 ℃预变性4 min,94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1 min,共35个循环,最后72 ℃延伸10 min。取5 μL PCR产物用2%琼脂糖凝胶电泳检测。
1.5 序列测定将所得PCR产物进行条带分析比对、切胶回收,采用天根通用型DNA纯化试剂盒回收法。所得产物委托上海市Invitrogen生物技术公司测序。测序结果采用Contig Express软件进行正反碱基比对,并进行拼接。
1.6 序列分析将测得的乌头霜霉病病原菌的ITS-DNA序列和28 S rDNA序列提交到NCBI数据库获得登录号,并进行Blast比对。运用MEGA 5.1中邻位相连法(neighbor joining,NJ)法构建系统进化树,应用自展法(bootstrap)检验系统进化树,自展数据集为1 000次。其他参考序列均从GenBank中获得。
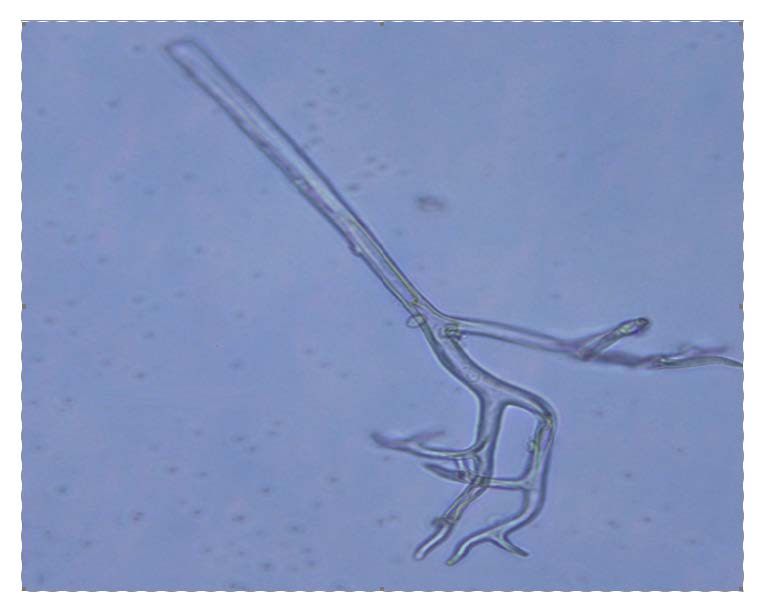
2 结果与分析 2.1 乌头霜霉病病原菌显微形态用无菌毛刷刷下霉层到载玻片上制成水装片在显微镜下观察到病原菌椭圆形的孢子囊,淡褐色,直径为20~30 μm(图 1)。在显微镜下观察到霜霉病原菌的无色孢囊梗,长为200~450 μm,主干占总长的1/2,分支呈二叉式锐角状分叉数次,分枝较为对称,小枝较为细长而且顶端尖锐(图 2)。本实验研究对象与余永年[2]报道的一致,病原菌为寄生于乌头植株的霜霉科霜霉属乌头霜霉Peronospora aconiti Yu。

|
图 1 病原菌孢子囊显微图 Fig.1 Micrograph of pathogen sporangia |
|
图 2 病原菌孢囊梗显微图 Fig.2 Micrograph of pathogen sporangiophore |
2.2 基因组DNA的提取
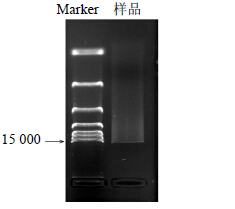
试剂盒法对病菌孢子进行基因组DNA提取,琼脂糖凝胶电泳检测,其DNA条带呈带状,有拖尾现象,相对分子质量约为15 000(图 3)。用ND2000核酸蛋白检测仪测得DNA质量浓度为94 ng/μL,紫外吸收A260 nm/A280 nm值为1.78,纯度较高,满足后续PCR操作的质量要求。
|
图 3 病原菌基因组DNA电泳图 Fig.3 Gel electrophoresis of pathogen genomic DNA |

|
图 4 PCR扩增产物电泳图 Fig.4 Gel electrophoresis of PCR products |
2.3 病原菌DNA PCR扩增
取基因组DNA 1 μL为模板,分别以引物ITS 1/4和NL1/4进行扩增得到条带,得到PCR产物,产物条带大小分别约为870 bp和740 bp(图 4)。切胶回收测序得到rDNA-ITS区PCR产物序列长度为892 bp,28 S D1/D2区PCR产物长度为741 bp。序列长度与电泳条带一致。
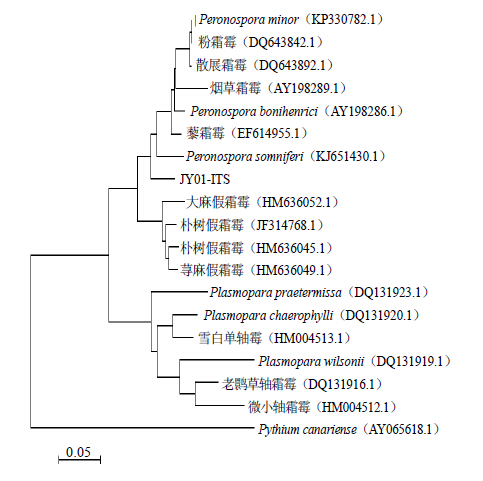
2.4 病原菌rDNA-ITS序列分析以Voglmayr[16]公布的Peronospora属真菌P. aparines的rDNA序列序列为参考,对病原菌rDNA-ITS 序列信息(图 5)进行了界定。该序列ITS1-5.8S-ITS2总长度为796 bp,其中ITS1序列长度为219 bp,5.8 S序列长度为156 bp,ITS2序列长度为421 bp。提交序列到NCBI数据库得到登录号KU161589。用BLAST在数据库中搜索同源性序列,发现乌头病原菌乌头霜霉rDNA-ITS序列与同属P. aparines(登录号 KM058095)、P. pulveracea(登录号 FJ384778.1)的相似度最高,均为94%。将病原菌rDNA-ITS序列命名为JY01-ITS,以腐霉科腐霉属Pythium canariense(登录号 AY065618.1)ITS区序列为外群菌株序列,同时选下载霜霉科下不同属rDNA-ITS序列登录号,采用NJ法构建系统进化树(图 6)。由图 6可见,所有序列主要聚成3个分支,乌头霜霉病病原菌rDNA-ITS序列在自举值95%水平与霜霉属内病菌聚成一支,结合病原菌形态学特征,鉴定此病原菌为霜霉属病菌。

|
图 5 乌头霜霉病病原菌rDNA-ITS序列 Fig.5 rDNA-ITS Sequence of Aconitum downy mildew pathogen |
|
图 6 基于rDNA-ITS序列分析的系统发育树 Fig.6 Phylogenetic tree based on rDNA-ITS sequence analysis |
2.5 病原菌28 S D1/D2区序列分析
病原菌28 S D1/D2区序列(图 7)共长741 bp,将序列提交到NCBI数据库,得到登录号KU161590。用BLAST在数据库中搜索同源性序列,发现乌头霜霉28 S D1/D2区序列与同属P. pulveracea(登录号KM058100)、P. ficariae(登录号KM058095)、P. bulbocapni(登录号KM058092)的相似度最高,高度达到97%。将病原菌28 S D1/D2区序列命名为JY01-28 S D1/D2,以腐霉科腐霉属Pythium canariense(登录号HQ665069.1)28 S序列为外群菌株序列,同时下载霜霉科下不同属28 S序列构建系统进化树(图 8)。如图 8可见,乌头霜霉病病原菌28 S D1/D2区序列在自举值93%水平与其他霜霉属病菌聚成一支,与rDNA-ITS序列分析结果一致。

|
图 7 乌头霜霉病病原菌28 S D1/D2区序列 Fig.7 28 S D1/D2 sequence of Aconitum downy mildew pathogen |

|
图 8 基于28 S rDNA D1/D2区域序列分析的系统发育树 Fig.8 Phylogenetic tree based on 28 S rDNA D1/D2 sequence analysis |
3 讨论
乌头霜霉病是危害乌头植株的常见的严重病害,对药材附子、川乌的产量和品质有极大影响。通常在3月份上旬,乌头幼苗就开始发病,幼苗叶片呈现出反卷变厚,叶背开始出现灰色霉层;4~5月份,随着气温和相对湿度升高,病害危害乌头达到最盛。病叶开始变得脆硬,叶背密被一层厚厚的灰褐色霉层,严重的会导致整个植株的枯死;6月份,栽培地乌头植株成熟,准备采收,加上气温升高,不利于病菌的萌发传播。余永年[2]在研究中根据病原菌有性阶段、无性阶段的形态特征以及寄主范围,将乌头霜霉病病原菌命名为乌头霜霉Peronospora aconiti Yu,并对其卵孢子进行了报道[17]。根据病原菌菌丝的特点,对DNA提取方法进行了优化提取,用真菌通用引物ITS1/4和卵菌纲通用引物NL1/4对基因组DNA进行PCR扩增,测序得到该病原菌的核酸保守序列。研究首次得到了乌头霜霉的rDNA-ITS区域和28 S D1/D2区域的序列,并对序列进行了BLAST比对。结果显示,乌头霜霉病病原菌rDNA-ITS与NCBI数据库中序列相似度最高的为霜霉属,相似度为94%;与28 S D1/D2区域序列相似度最高的同rDNA-ITS序列分析一致也为霜霉属,相似度达97%。与二者相似度最高的均为同属的P. pulveracea(登录号KM058100)。
本实验利用分子生物学手段首次对乌头霜霉病病原菌进行了研究,测定了该病原菌的rDNA-ITS区域和28 S D1/D2区域的序列,测序结果表明,利用分子生物学手段所得出的该病原菌的分类学地位与形态学研究结论一致。为了进一步了解各地区的乌头霜霉病病原菌的遗传差异,研究还将继续选取不同发病地区的霜霉病病原菌进行遗传差异分析,并及时监测其生理小种分化,为乌头霜霉病的检测和防治提供理论基础。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | 余永年. 霜霉一新种[J]. 植物病理学报 , 1979, 9 (2) :127–130. |
| [3] | 陶家凤, 秦芸. 四川的霜霉菌[J]. 四川农业学报 , 1987, 2 (1) :13–22. |
| [4] | 唐莉, 梁丽娟, 叶华智, 等. 附子常见病害的调查研究[J]. 现代中药研究与实践 , 2004, 6 (18) :29–32. |
| [5] | 陈小红, 叶华智, 严吉明, 等. 四川药用植物病害调查与病原鉴定I主要栽培药用植物病害[J]. 西南农业学报 , 2006, 19 (1) :58–62. |
| [6] | 中国医学科学院药用植物资源开发研究所. 中国药用植物栽培学[M]. 北京: 农业出版社, 1991 . |
| [7] | Carling D E. Hyphal anastomosis reaction, rDNA-internal transcribed spacer, and virulence levels among subsets of Rhizoctonia solani anastomosis group-2(AG-2) and AG-B1[J]. Phytopathology , 2002, 92 :43–50. |
| [8] | 刘春来, 文景芝, 杨明秀, 等. rDNA-ITS在植物病原真菌分子检测中的应用[J]. 东北农业大学学报 , 2007, 38 (1) :101–106. |
| [9] | 郝剑瑾, 程舟, 梁洪卉, 等. 基于rDNA ITS序列探讨我国冬虫夏草的遗传分化及分布格局[J]. 中草药 , 2009, 40 (1) :112–116. |
| [10] | Suga H T, Hasegawa H, Mitsui K, et al. Phylogenetic analysis of the phytopathogenic fungus Fusarium solani based on the rDNA-ITS region[J]. Mycol Res , 2000, 104 (10) :1175–1183. |
| [11] | 王娜, 马雅军, 代光辉, 等. 黄瓜霜霉病和白粉病病原菌的rDNA-ITS序列分析[J]. 西北农林科技大学学报:自然科学版 , 2007, 35 (10) :155–158. |
| [12] | 乾义柯, 张祥林, 克衣木, 等. 甜菜霜霉病菌形态鉴定及28 S rDNA序列分析[J]. 新疆农业科学 , 2012, 49 (2) :249–254. |
| [13] | 刘建利. 利用28 S rDNA D1/D2区和ITS rDNA序列鉴定甜瓜白粉病病原菌[J]. 植物保护学报 , 2011, 38 (1) :47–51. |
| [14] | 甘丽萍, 王生荣. 12种白粉菌种间RAPD亲缘关系研究[J]. 西北农林科技大学学报:自然科学版 , 2006, 34 (8) :133–138. |
| [15] | 方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998 . |
| [16] | Voglmayr H. Phylogenetic relationships of Peronospora and related genera based on nuclear ribosomal ITS sequences[J]. Mycol Res , 2003, 107 (10) :1132–1142. |
| [17] | 余永年, 王燕林. 乌头霜霉卵孢子的发现[J]. 真菌学报 , 1984, 3 (4) :189–191. |
 2016, Vol. 47
2016, Vol. 47


