2. 湖南中医药大学, 湖南 长沙 410208 ;
3. 湖南省农业科学院, 湖南 长沙 410000 ;
4. 南京中医药大学药学院, 江苏 南京 210000
2. Hunan University of Traditional Chinese Medicine, Changsha 410208, China ;
3. Hunan Academy of Agricultural Sciences, Changsha 410000, China ;
4. College of pharmacy Nanjing University of Chinese Medicine, Nanjing 210000, China
灰毡毛忍冬Lonicera macranthoides Hand.-Mazz. 来源于忍冬科,为中药材山银花来源之一,具有清热解毒、凉散风热的功效,临床上广泛用于治疗痈肿疔疮、喉痹、丹毒、热毒血痢、风热感冒、温热发病,也可作为提取绿原酸或挥发油的原料,广泛用于制药、香料、化妆品、保健食品、保健饮料等领域,具有较高的经济价值[1]。2009年甲型H1N1流感疫情发生后,金银花成了市场上的热销品种,价格不断上升,灰毡毛忍冬作为商品“金银花”的主流品种之一,已广泛应用于中药制剂中,值得进一步开发。
从1999年开始以灰毡毛忍冬的自然变异株为接穗,通过多年嫁接筛选试验,初步培育出了花蕾期长,花冠不展开的无性系“湘蕾金银花”品种。该品种具有根系发达,对环境适应性强,花蕾簇生,花蕾期长,花冠不展开,花蕾颜色均一,气味芬香,产量高,抗病虫害能力强等优良的农艺学性状和特点,且性状稳定。其4年生苗每株年产干花2~3 kg,每公顷年产干花13~20 kg,是灰毡毛忍冬常规品种的2倍,为山东省和河南省金银花产量的3~4倍。
中药材的适宜采收直接影响着中药材的产量和质量,是中药材生产中的关键技术之一。花类药材一般在花蕾膨大即将开放期或花初开期采收,这时花中水分少、香气足,加工出来的药材外观质量佳,有效成分量高。通过实地调查研究发现,灰毡毛忍冬的自然变异株—“湘蕾金银花”品种具有花蕾期长,花冠不展开,花蕾簇生、整齐、颜色均一的特点,可一次性采摘。该特性为药材的采收提供了充裕的时间,既确保了药材的颜色和质量,也减少了采收的人力、物力,大大降低了劳动成本,节约了资金。因此,对湘蕾灰毡毛忍冬蕾期延长机制的研究意义重大。本课题组利用分子生物学技术分析常规型灰毡毛忍冬植株与“湘蕾金银花”MADS-box基因的差异,发现4条存在明显差异并属于MADS-box基因家族,现成功从灰毡毛忍冬总RNA中克隆得到可能参与控制蕾期延长的基因(LmAGL15)。运用生物信息学的方法对该序列进行同源性分析、理化性质分析,预测LmAGL15编码蛋白。通过功能分析确定该基因功能。LmAGL15活性在一定程度上影响灰毡毛忍冬的蕾期长短[2-3]。
实时荧光定量PCR(qRT-PCR)技术具有高灵敏、高保真、高特异、高重现和高通量等特点,被广泛应用于基因表达的分析。但在数据处理过程中,结果往往会受到不同变量的影响,与目标基因特异性表达的真实值存在一定的差异,因此,选用稳定表达的基因作为内参基因进行校正和标准化对准确分析实验结果非常关键。本研究克隆了灰毡毛忍冬18 S rRNA、Ubiquilin、Actin和Efl-β基因的片段,同时通过分析灰毡毛忍冬不同部位(叶、茎和花蕾)及花蕾发育不同时期基因表达稳定性分析,筛选出最佳内参基因,为灰毡毛忍冬的基因表达研究奠定方法学基础。利用所选内参基因,通过转基因技术将这些功能基因转入其他品种的灰毡毛忍冬、金银花或其他药用、食用、切花、香精香料原料等植株中,培育出花蕾期长或花冠不展开的新优良品种打下前期基础。
1 材料与仪器 1.1 材料样品采自湖南中医药大学药用植物园,经湖南中医药大学药用植物教研室主任周日宝教授鉴定为湘蕾型和常规型灰毡毛忍冬Lonicera macranthoides Hand. -Mazz,各植株均保存茎、叶、花蕾各部位,−80 ℃保存备用。
1.2 试剂及仪器Rever Tra Ace® qPCR RT Kit,批号FSQ-101,TOYOBO;SYBR® Premix Ex TaqTM(Perfect Real Time),批号DRR041A,TaKaRa;DNA Marker DL2000购自全式金公司;其余未注明出处的药品、试剂均为国外或国内生产的分析纯级产品。电泳仪,北京君意东方电泳设备公司;GeneQuant核酸定量仪(Pharmacia Biotech公司,英国);Real-time PCR扩增仪(Stepone Thermal Cycler),Applied Biosystem;微量移液器,德国Eppendorf公司;Tanon凝胶成像分析系统,上海天能公司;恒温水浴锅,上海跃进实验仪器有限公司;微波炉,LG;Aquapro超级纯水仪,艾科浦公司;制冰机FM130,GRANT;北京六一仪器厂。
2 方法 2.1 内参基因的选择及特异性引物设计、检测选择4个常用内参基因18 S rRNA、Ubiquilin、Actin和Efl-β,其中Ubiquilin、Actin和Efl-β 3个基因采用CodeHop方法设计简并引物(表 1),18 S rRNA则根据GenBank已登录的相关序列,用Primer 4.0软件设计引物。得到18 S rRNA引物序列,正向引物5’-AGGCGCGCAAATTACCCAATCC-3’,反向引物5’-GCCCTCCAATTGTTCCTCGTTAAG-3’,引物长度118 bp。以灰毡毛忍冬花蕾组织反转录得到的cDNA为模板克隆基因,然后再根据测序结果设计引物。使用Taq DNA 聚合酶(TIANGEN ET108-02)扩增18 S rRNA、Ubiquilin、Actin和Efl-β的基因片段,纯化回收后连入克隆用细菌,进行测序检测,通过NCBI Blast比对确认序列的正确性。利用正确的内参基因片段设计定量PCR引物(表 2),进行定量PCR反应[2-3]。
|
|
表 1 灰毡毛忍冬候选内参基因的简并引物序列 Table 1 Degenerate primer sequence of candidate reference genes of L.macranthoids |
|
|
表 2 内参基因定量PCR引物序列 Table 2 Primer sequence of quantitative PCR |
2.2 RNA提取
取0.1 g灰毡毛忍冬加入到预冷的研钵中,加入Trizol 1 mL,液氮研磨组织;将研碎的组织转移到1.5 mL离心管中,室温静置5 min;12 000 r/min离心5 min后,取上清到一个新的离心管中;加入0.2 mL氯仿,剧烈震荡混匀30 s。室温静置10 min;4 ℃,12 000 r/min离心10 min,将上层水相移至另一离心管中,加入等体积的异丙醇,充分混匀,室温静置10 min;4 ℃,12 000 r/min,离心10 min,用75%乙醇洗2遍,之后用20 μL灭菌双蒸水溶解RNA。用GeneQuant核酸定量仪对总RNA在260、280、230 nm测定吸光度(A260、A280、A230)及浓度。1.2%的琼脂糖凝胶电泳检测RNA的纯度和完整性。
2.3 RNA反转录合成cDNAcDNA合成按照TIANScript Ⅱ RT Kit(KR107)试剂盒明书要求进行,将灰毡毛忍冬不同部位及花蕾不同时期的样品RNA反转录合成cDNA,用于PCR扩增。
2.4 内参基因及LmAGL15基因的qRT-PCR扩增采用Real-time PCR扩增仪(Stepone Thermal Cycler)进行扩增。qRT-PCR反应总体系:SYBR Premix Ex TaqTM(2×)10 μL,Primer F(10 μmol/L)1 μL,Primer R(10 μmol/L)1 μL,Cdna 1 μL,用ddH2O补齐20 μL。实时荧光定量反应程序为95 ℃预变性4 min,94 ℃变性1 min,55 ℃退火45 s,72 ℃延伸55 s并收集荧光,38个循环,55~94 ℃生成熔解曲线。每个样品重复4次。同时用qRT-PCR定量分析引物,生成熔解曲线,熔解曲线为单峰时用于后续分析[4]。
2.5 标准曲线的绘制及基因扩增效率以cDNA第一链作为模板,依次稀释6个梯度,每个梯度稀释10倍,即cDNA初始模板浓度分别为1、0.1、0.01、1×10−3、1×10−4、1×10−5 μmol/L。根据荧光定量PCR结果,以测得的Ct值为纵坐标,cDNA初始模板浓度对数值为横坐标,绘制标准曲线。利用公式E=10−1/slope-1(slope为标准曲线斜率)计算基因的扩增效率[3]。
2.6 数据处理根据4个内参基因及在灰毡毛忍冬组织材料中的相对表达量,分别应用Genorm(ver.3.0)和NormFinder(ver.0.9)程序对4个候选内参基因的表达稳定性进行分析,筛选合适的内参基因[5-6]。
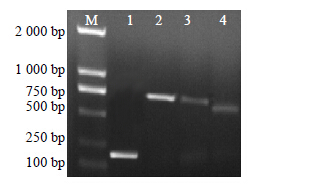
3 结果与分析 3.1 克隆内参基因片段18 S rRNA、Ubiquilin、Actin和Efl-β等常用作内参基因,灰毡毛忍冬中没有相应的序列报道。根据近缘物种基因序列设计引物,克隆18 S rRNA、Ubiquilin、Actin和Efl-β 4个基因的部分片段。从图 1可以看出每对引物扩增产物没有引物二聚体及非特异条带,均能扩增出清晰的特异性条带,表明各内参基因引物均能特异地扩增相应片段,可以用于实时荧光定量PCR分析。且测序结果显示各基因片段的长度分别是118、234、236、134 bp,与预期的长度基本一致。利用NCBI数据库对测序结果进行同源性搜索(表 3),由比对结果可知,克隆片段与不同物种相应基因序列同源性高于70%,即所得克隆为目标基因[3]。
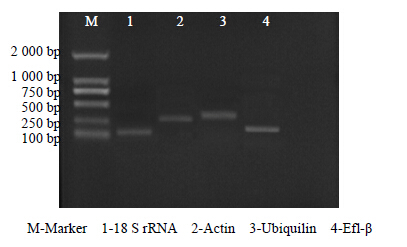
|
图 1 4种内参基因的PCR扩增产物 Fig.1 PCR products of ten reference genes |
|
|
表 3 内参基因片段BLAST比对部分结果 Table 3 Partial BLAST results of reference gene fragments |
3.2 内参基因荧光定量PCR的效率及qRT-PCR分析
18 S rRNA、Ubiquilin、Actin和Efl-β的标准曲线参数、扩增效率和熔解温度见表 4。4个内参基因均统一模板质量浓度为400 ng/μL;斜率为−3.300±0.150,在−3.0~−3.5;相关系数均大于0.99,高于定量PCR反应要求的0.98;扩增效率(99.900±2.909)%。4个内参基因的斜率、相关系数和扩增效率都很接近,且均在合理范围内。
|
|
表 4 4个内参基因扩增效率、标准曲线参数和熔解温度 Table 4 Standard curve parameters,amplification efficiency,and solution temperature of four reference genes |
由图 2可知选择的4个内参基因在不同的生物部位呈现的熔解曲线为显著的单一峰,表明所设计的内参基因引物都能扩增出各内参基因的相应产物,因此表明qRT-PCR的分析结果是准确可靠的。
Ct的大小反映了对应基因的表达丰度高低,Ct值越大对应基因丰度越低。叶、茎和花蕾中,Ubiquilin基因的Ct平均值最大(表 5),即其表达丰度低于其他3个基因。且茎中Actin基因的Ct为20.480高于叶/花蕾的14.025/15.693 0(6/5个循环),可知茎片与叶/花蕾中Actin基因。花蕾发育不同时期内参基因Ct值及熔解温度见表 6。
|
|
表 5 叶、茎和花蕾内参基因Ct和熔解温度平均值 Table 5 Ct and average melting temperature of reference genes in leaves,stems,and buds |
|
|
表 6 花蕾不同发育时期内参基因Ct和溶解温度的平均值 Table 6 Ct and average melting temperature of reference genes in different development periods of buds |
3.3 内参基因稳定性评价
利用Normfinder和Genorm 2种方法综合分析内参基因的稳定性,通过生成基因表达稳定值(M)来筛选内参基因,M值越大,内参基因越不稳定,M值越小,内参基因越稳定。此方法简化了内参基因的分析过程。灰毡毛忍冬叶、茎及花蕾中,表达稳定性M值分析结果见图 3、4。Normfinder和Genorm的基因稳定性M值排序基本一致,18 S rRNA的稳定性最高,Ubiquilin的稳定性最低。
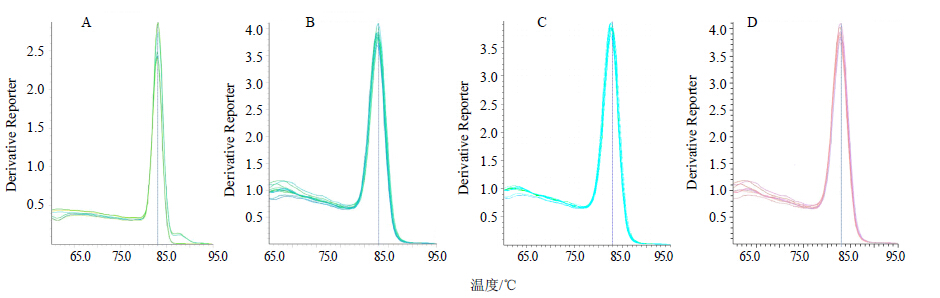
|
图 2 灰毡毛忍冬组织中18 S rRNA (A)、Actin (B)、Ubiquilin (C) 和Efl-β (D) 的qRT-PCR熔解曲线 Fig.2 qRT-PCR melting curves of 18 S rRNA (A),Actin (B),Ubiquilin (C),and Efl-β (D) in tissues of L. macranthoides |
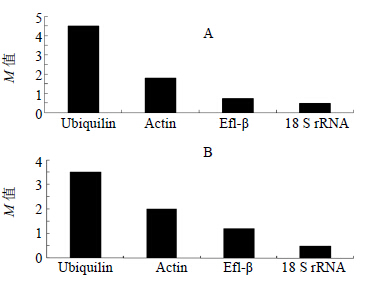
|
图 3 NormFinder软件 (A) 和GeNorm软件 (B) 分析候选内参基因在灰毡毛忍冬不同部位组织中的表达稳定性 Fig.3 Expression stability of candidate reference genes in different parts of L. macranthoides by NormFinder (A) and GeNorm (B) |
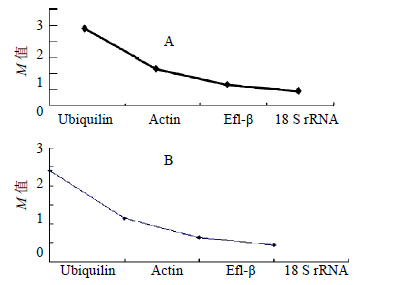
|
图 4 NormFinder软件 (A) 和GeNorm软件 (B) 分析候选内参基因在灰毡毛忍冬花蕾不同时期的表达稳定性 Fig.4 Expression stability of candidate reference genes during different bud stage of L. macranthoides by NormFinder (A) and GeNorm (B) |
3.4 LmAGL15的时空表达分析
LmAGL15基因定量PCR,不同部位及花蕾不同时期样本cDNA模板均统一模板质量浓度为365 ng/μL,扩增标准曲线的斜率是−3.097,相关系数0.998,均处于合理范围内。LmAGL15的熔解度曲线为单峰,叶、茎和花蕾不同发育时期(5、10、15、20 d)的峰值均接近于80 ℃,表明PCR扩增特异性良好。且在相同的反应体系中,茎和花蕾的Ct值分别为26.645和26.465,小于叶片(32.633),可见LmAGL15基因在茎和花蕾组织的表达丰度较高。比对不同花蕾时期LmAGL15基因的表达丰度,20 d的Ct值(36.936)最大,均大于花蕾其他发育时期。表明花蕾发育后期,LmAGL15基因的表达丰度明显降低。
根据内参基因筛选结果以18 S rRNA作为内参基因,分析LmAGL15基因在不同部位及不同时期的表达情况(图 5~8)。结果表明LmAGL15基因在叶片中相对表达量最低,茎中次之、花蕾中最高。且花蕾发育过程中,5~15 d LmAGL15基因的相对表达量较稳定,20 d 明显降低。5 d LmAGL15的相对表达量较高,可能是由于花蕾发育后期受物质动员过程影响,LmAGL15参与的代谢过程活跃引起的。
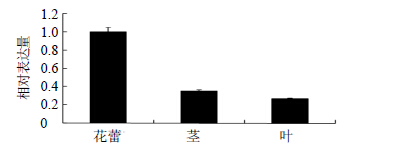
|
图 5 叶、茎、花蕾中LmAGL15表达的变化 Fig.5 Expression change of LmAGL15 gene in leaves,stems,and buds |
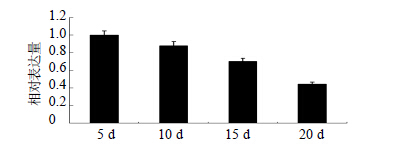
|
图 6 花蕾不同发育时期LmAGL15表达的变化 Fig.6 Expression change of LmAGL15 gene in different bud development periods |
|
图 7 灰毡毛忍冬不同部位中LmAGL15基因的表达 Fig.7 Expression of LmAGL15 genes in different parts of L. macranthoides |

|
图 8 灰毡毛忍冬花蕾不同时期LmAGL15基因的表达 Fig.8 Expression of LhAGL15 genesin different parts of Loniceramacranthoides Hand. -Mazz. after agarwood formation |
4 讨论
筛选内参基因是基因差异表达分析的基础工作。通常分析多个内参基因的稳定性以及表达丰度,再选择稳定性最好、表达丰度稳定的作为内参基因。常以内参基因表达量作为分母,目标基因与之比较,用比值的变化趋势来表示目标基因的表达量变化规律。但是内参基因的使用仍然具有局限性,不同的实验条件和处理背景都会影响内参基因的稳定性及表达量分析的结果。本研究中的LmAGL15基因在叶片、茎和花蕾中表达稳定性略低于在花蕾的不同发育时期。可见,适宜的内参基因需要根据具体情况选择[7-9]。
本实验研究的4个基因为研究较多的传统内参基因,通过对内参基因(18 S rRNA、Ubiquilin、Actin、Efl-β)进行荧光定量PCR稳定性分析,结果表明,18 S rRNA在灰毡毛忍冬不同部位以及花蕾不同发育时期中表达均最稳定,Actin虽然在苹果不同组织的基因表达分析中表现也较稳定,但表达丰度偏低。因此,18 S rRNA为灰毡毛忍冬最适内参基因[10-13]。当然在追踪基因表达的微小变化时,单独使用一个内参基因往往不能得到准确的定量结果,这时可以同时列出2个或几个内参基因进行内参校正。
同时,本研究中叶、茎和花蕾相对LmAGL15表达量具有一定的差异,可能与LmAGL15基因与生长生殖的功能有关。报道AGL15同源基因均在非胚性器官根、茎和叶中的表达量极低而在花蕾等生殖器官中具有相对较高表达量,LmAGL15基因表达量的结果和在油菜中的表达模式分析结果相似。因此通过LmAGL15基因在花蕾发育过程中的表达模式分析,表明了其参与灰毡毛忍冬花蕾发育过程并发挥着一定作用[14-17]。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | 汪冶, 肖聪颖, 梅树模, 等. 湘蕾金银花最佳采收时间和干燥方法的研究[J]. 时珍国医国药 , 2008, 19 (3) :100–101. |
| [3] | 汪冶, 黄云. 湘蕾金银花的选育及推广初报[J]. 中药材 , 2004, 27 (12) :896–897. |
| [4] | 蒋晓梅, 张新全, 严海东, 等. 柳枝程根组织实时定量PCR分析中内参基因的选择[J]. 农业生物技术学报 , 2014, 22 (1) :55–63. |
| [5] | Makapugay H C, Dhammika N N P, Soejarto D D, et al. High-performance liquid chromatographic analysis of themajor sweet principle of Luo Han Kuo fruits[J]. J Agric Food Chem , 2012, 33 :348–350. |
| [6] | Takemoto T, Arihara S, Nakajima T, et al. Studies on the constituents of Fructus Momordicae. Ⅱ. Structure of sapogenin[J]. Yakugaku Zasshi , 2015, 103 (11) :55–66. |
| [7] | Matsumoto K, Kasai R, Ohtani K, et al. Minorcucurbitane glycosides from fruits of Momordica grosvenori (Cucurbitaceae)[J]. Chem Pharm Bull , 2014, 38 :2030–2032. |
| [8] | Tang Q, Ma X J, Mo C M, et al. An efficient approach to finding Siraitia grosvenorii triterpene biosynthetic genes by RNA-seq and digital gene expression analysis[J]. BMC Genomics , 2011, 12 :343–346. |
| [9] | Jung J D, Park H W, Hahn Y, et al. Discovery of genes for ginsenoside biosynthesis by analysis of ginseng expressed sequence tags[J]. Plant Cell Rep , 2013, 22 (3) :224–230. |
| [10] | Zhang X, Ding L, Sandford A J. Selection of reference genes for gene expression studies in human neutrophils by real-time PCR[J]. BMC Mol Biol , 2014 . DOI:10.1186/1471-2199-6-4 |
| [11] | 张艳君, 朱志峰, 陆融. 基因表达转录分析中内参基因的选择[J]. 生物化学与生物物理进展 , 2007, 34 (5) :546–549. |
| [12] | 侯维海, 孙鹏, 陈全家, 等. 地黄实时定量PCR内参基因的筛选[J]. 中国农学通报 , 2011, 27 (17) :76–79. |
| [13] | 张艳君, 朱志峰, 陆融. 基因表达转录分析中内参基因的选择[J]. 生物化学与生物物理进展 , 2007, 34 (5) :546–550. |
| [14] | 易刚强, 蔡嘉洛, 朱贻霖, 等. 灰毡毛忍冬MADS-box基因家族AGL15基因的克隆、生物信息学和表达分析[J]. 中草药 , 2016, 47 (4) :640–647. |
| [15] | 侯志强, 王庆国. 鲜切马铃薯实时荧光定量PCR分析中内参基因的选择[J]. 安徽农业科学 , 2013, 41 (12) :5207–5210. |
| [16] | 魏永赞, 赖彪, 胡福初, 等. 用于荔枝qPCR分析的内参基因克隆及稳定性分析[J]. 华南农业大学学报 , 2012, 33 (7) :301–306. |
| [17] | 王彦杰, 董丽, 张超, 等. 牡丹实时定量PCR分析中内参基因的选择[J]. 农业生物技术学报 , 2012, 20 (5) :521–526. |
 2016, Vol. 47
2016, Vol. 47


