刺五加Eleutherococcus senticosus (Rupr. et Maxim.) Maxim. 为五加科五加属植物,是我国传统的珍贵药用植物[1]。在临床上刺五加被称之为“适应原”样药物[2],具有抗衰老、抗辐射、抗病毒、抗肿瘤等药理作用[1]。
甘油醛-3-磷酸脱氢酶(GAPDH)由4个30~40 000的亚基组成,相对分子质量为1.64×105,是糖酵解过程中的关键酶。GAPDH具有高度保守性、稳定表达的管家基因特点,因此作为内参基因广泛用于功能基因表达量的研究[3]。在刺五加中GAPDH也被广泛作为研究刺五加三萜皂苷类化合物生物合成关键酶基因的内参基因[1]。在真核生物的基因中,内含子一度被视为是无基因功能的垃圾序列,然而现有研究表明,内含子在基因的表达调控中起着重要作用[4],在基因表达调控方面,扮演着不可或缺的重要角色[5-6]。同时,启动子也是位于基因5’端上游区的一段能与RNA聚合酶和转录因子特异结合的DNA序列,决定基因转录、表达及调控的重要 顺式作用元件[7-9]。但对刺五加GAPDH基因DNA序列中内含子及启动子的克隆分析研究尚未见报道。目前有关刺五加GAPDH基因内含子结构和启动子的研究尚未见报道。本研究首次克隆并分析了刺五加GAPDH基因的DNA及启动子序列,为进一步研究该基因的表达调控和功能奠定基础。
1 材料与方法 1.1 材料与试剂刺五加采自辽宁省本溪市桓仁满族自治县,经华北理工大学生命科学学院邢朝斌教授鉴定为五加科植物刺五加Eleutherococcus senticosus (Rupr. et Maxim.) Maxim.。以新鲜嫩叶作为提取基因组DNA的试材。
Ex Taq DNA聚合酶、LA Taq DNA聚合酶、dNTP、DL5000 DNA Marker购自TaKaRa宝生物工程(大连)有限公司,新型植物基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒、pGM-T克隆试剂盒、TOP-10感受态细胞购自天根生化科技(北京)有限公司,琼脂糖购自Sigma-Aldrich公司,氨苄青霉素、IPTG、X-gal购自北京拜尔迪生物技术有限公司,其他试剂均为国产分析纯。引物由Thermo Fisher公司合成。
1.2 方法 1.2.1 刺五加GAPDH基因DNA序列的克隆按照试剂盒说明书的要求,称取0.1 g刺五加叶片,提取基因组DNA。利用1%琼脂糖凝胶电泳检测DNA完整性。
根据刺五加GAPDH基因的cDNA序列[1],应用Primer premier 5.0软件设计2对PCR扩增DNA序列的引物。引物分别为GAPDHQS、GAPDHQX、GAP11S和GAPBY3(表 1)。以提取的刺五加基因组DNA为模板进行PCR扩增,反应体系为25 μL:模板1 μL,dNTP 4 μL,10×Ex Taq Buffer 2.5 μL,上下游引物各1 μL,Ex Taq DNA酶0.2 μL,ddH2O 15.3 μL。反应条件:94 ℃预变性1 min,94 ℃变性30 s,53 ℃退火50 s,72 ℃延伸8 min,共40个循环,最后72 ℃补充延伸15 min。
|
|
表 1 引物列表 Table 1 List of primers |
1.2.2 PCR产物回收、克隆及序列测定
PCR产物经2%琼脂糖凝胶电泳后,切下目的条带,按照琼脂糖凝胶DNA回收试剂盒说明书进行回收纯化。将回收的PCR产物连接入pGM-T Vector,转化入大肠杆菌TOP-10感受态细胞中,涂布于含氨苄青霉素、IPTG、X-gal的LB平板上培养13 h。随机挑选20个阳性克隆子送往Invitrogen公司进行测序。
1.2.3 刺五加GAPDH基因启动子的克隆根据“1.2.1”项中获得的刺五加GAPDH基因的DNA序列,设计3个嵌套的反向特异下游引物GAPBY2、GAPBY1、GAPBYN0(表 1)。并利用交错式热不对称PCR(thermal asymmetric interlaced PCR,TAIL-PCR)的上游随机简并引物AD6依次与GAPBY2、GAPBY1、GAPBYN0配对进行连续3轮的TAIL-PCR扩增。第1轮TAIL-PCR扩增的反应体系为25 μL:刺五加基因组DNA 1 μL,dNTP 4 μL,2×GC Buffer I 12.5 μL,引物GAPBY2 1 μL,AD6引物2.5 μL,LA Taq DNA聚合酶0.25 μL,ddH2O 3.75 μL。反应结束后取第1轮PCR产物稀释10倍作为模板进行第2轮PCR扩增,反应体系为25 μL:模板DNA 1 μL,dNTP 4 μL,2×GC Buffer I 12.5 μL,GAPBY1引物1 μL,AD6引物2.5 μL,LA Taq DNA聚合酶0.25 μL,ddH2O 3.75 μL。最后取第2轮PCR产物稀释100倍作为模板进行第3轮PCR扩增,反应体系为25 μL:模板1 μL,dNTP 4 μL,2×GC Buffer I 12.5 μL,GAPBYN0引物1 μL,AD6引物2.5 μL,LA Taq DNA聚合酶0.25 μL,ddH2O 3.75 μL。3轮PCR的反应条件见表 2。反应结束后将TAIL-PCR产物按照“1.2.2”项中的方法电泳、回收、克隆及测序。
|
|
表 2 TAIL-PCR反应程序 Table 2 TAIL-PCR reaction process |
1.2.4 生物信息学分析
利用NCBI的Spidey(http://www.ncbi.nlm.nih.gov/spidey/)工具分析GAPDH基因结构;利用BDGP(http://www.fruitfly.org/seq_tools/splice.html)预测5’端上游转录起始位点;利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析GAPDH基因启动子的顺式作用元件。
2 结果与分析 2.1 刺五加GAPDH基因DNA序列的克隆以刺五加基因组DNA为模板,利用引物对GAPDHQS-GAPDHQX和GAP11S-GAPBY3进行PCR扩增,分别获得长为2 680、664 bp的条带(图 1),与预期长度相符。利用DNAMAN 6.0软件将2条片段序列进行拼接,获得长为2 859 bp的序列,经NCBI的BLAST比对,确定该序列为刺五加GAPDH基因DNA序列,且其中包含起始密码子ATG和终止密码子TAA,说明成功克隆得到了GAPDH基因的DNA全长序列。
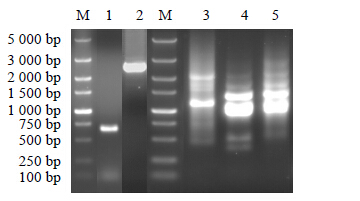
|
图 1 刺五加GAPDH基因及启动子的克隆 Fig.1 Cloning of GAPDH gene and promoter from E. senticosus |
2.2 刺五加GAPDH基因DNA序列的分析
获得的刺五加GAPDH基因全长DNA序列中共含有12个外显子和11个内含子,其中外显子的长度变化幅度为33~277 bp,内含子的长度变化幅度为81~216 bp(图 2)。该基因在表达为成熟mRNA的过程中,外显子与内含子的剪切都符合GT-AG原则,即内含子的5’端剪切位点为GT,3’端剪切位点为AG。内含子中(A+T)的量为60.78%~73.64%,(G+C)的量为26.36%~39.22%,(A+T)的量显著高于(G+C)的量,与非编码区中具有较高的AT量相符。

|
图 2 刺五加GAPDH基因的结构 Fig.2 Genomic structure of GAPDH gene in E. senticosus |
2.3 刺五加GAPDH基因启动子的克隆与生物信息学分析
利用3条嵌套式引物,经过连续3轮TAIL-PCR扩增获得长1 344 bp的片段(图 1)。比对发现,该片段的3’端序列与“2.2”项中GAPDH基因的5’端序列完全重合,与预期相符,因此确定成功克隆得到刺五加GAPDH基因的启动子序列。
刺五加GAPDH基因的转录起始位点为A(标记为+1),位于起始密码子ATG上游61 bp处,与多数基因的转录起始位点多为A的特点相符(图 3)。利用PlantCARE分析的结果表明,GAPDH的启动子中存在典型核心启动元件TATA-box 11个、CAAT-box 25个。其中TATA-box位于−349、−943、−1 013 bp等处,CAAT-box位于+14、−5、−150、−385、−847、−1 045 bp等处。另外,其中还含有多种与激素应答、逆境胁迫和光响应等元件相关(表 3),如脱落酸响应顺式作用元件(ABRE)、水杨酸响应顺式作用元件(TCA-element)、赤霉素响应元件(GARE-motif、P-box)、生长素响应元件(AuxRR-core,TGA-element)、应答光响应顺式作用元件(AE-box、ATCT-motif、Box II、G-Box、GAG-motif、I-box、Sp1、TCCC-motif等)、厌氧诱导必要的顺式作用元件(ARE)、涉及缺氧诱导的增强子功能元件(GC-motif)、干旱诱导相关的MYB结合位点(MBS)、MYBHv1结合位点(CCAAT-box)、茉莉酸甲酯响应顺式作用元件(CGTCA-motif,TGACG-motif)、真菌诱导子响应元件(Box-W1)、胚乳表达相关元件(GCN4_motif,Skn-1_motif)、醇溶蛋白代谢有关的顺式作用元件(O2-site)、防卫和胁迫响应顺式作用元件(TC-rich repeats)、昼夜节律顺式作用调控元件(circadian)等。以上诸多顺式作用元件存在于GAPDH基因启动子中,说明刺五加GAPDH基因的转录表达调控与多种因素有关。

|
图 3 刺五加GAPDH基因启动子序列 Fig.3 Promoter sequence of GAPDH gene from E. senticosus |
|
|
表 3 刺五加GAPDH基因启动子顺式作用元件分析 Table 3 Cis-acting regulatory element analysis of GAPDH gene promoter from E. senticosus |
3 讨论
本研究通过PCR和TAIL-PCR技术成功克隆得到了长为4 103 bp的刺五加GAPDH基因DNA及启动子序列,其中启动子序列长1 304 bp。编码区中存在12个外显子,11个内含子,内含子的长度变化幅度在81~216 bp,与已报道的其他物种GAPDH基因相比,刺五加的GAPDH中内含子数量偏多、长度偏长,而外显子与内含子的剪切均符合GT-AG原则,这与其他物种内含子剪切的特征相符[10]。刺五加GAPDH基因内含子中(A+T)量为60.78%~73.64%,推测刺五加GAPDH基因内含子可能在转录表达方面起重要作用[11]。
刺五加GAPDH基因的启动子除存在基本的调控元件外,还含有多种与激素应答、逆境胁迫和光响应等元件等,推测刺五加GAPDH基因的转录表达受到多种环境因素和生理条件的调控。研究表明,GAPDH基因在逆境胁迫下转录表达水平会出现明显变化[12],如水稻在水分胁迫下GAPDH基因转录表达会增强[13],推测刺五加的GAPDH基因可能参与逆境胁迫应答,在抵抗逆境胁迫方面或许存在着重要的作用。
目前有关刺五加GAPDH基因内含子结构和启动子的研究尚未见报道。本研究首次克隆并分析了刺五加GAPDH基因的DNA及启动子序列,为进一步研究该基因的表达调控和功能奠定基础。
| [1] | 邢朝斌, 吴鹏, 陈龙, 等. 刺五加GAPDH基因的克隆及序列分析[J]. 中草药 , 2012, 43 (1) :155–158. |
| [2] | 中国药典[S]. 一部. 2015. |
| [3] | Morgante C V, Guimaraes P M, Martins A C, et al. Reference genes for quantitative reverse transcription-polymerase chain reaction expression studies in wild and cultivated peanut[J]. BMC Res Notes , 2011 . DOI:10.1186/1756-0500-4-339 |
| [4] | Jungerius B J, van Laere A S, Te Pas M F, et al. The IGF2-intron3-G3072A substitution explains a major imprinted QTL effect on back fat thickness in a Meishan×European white pig intercross[J]. Genet Res , 2004, 84 (2) :95–101. |
| [5] | Lev-Maor G, Sorek R, Shomron N, et al. The birth of an alternatively spliced exon:3' splice-site selection in Alu exons[J]. Science , 2003, 300 (5623) :1288–1291. |
| [6] | Salgueiro S, Piguocchi C, Parry M A. Intron-mediated gusA expression in tritordeum and wheat resulting from particle bombardment[J]. Plant Mol Biol , 2000, 42 (4) :615–622. |
| [7] | 张伟, 刘勋成, 赵金会, 等. 水稻组蛋白脱乙酰化酶基因HDA705启动子的克隆与表达特性分析[J]. 热带亚热带植物学报 , 2014, 22 (1) :77–82. |
| [8] | 陈迪新, 李艳梅, 郭国宁, 等. 桃PG基因启动子克隆及序列分析[J]. 华北农学报 , 2014, 29 (6) :52–57. |
| [9] | 邢朝斌, 吴鹏, 修乐山, 等. 刺五加功能基因密码子偏好性的分析[J]. 中草药 , 2013, 44 (5) :598–603. |
| [10] | 张津京, 陈辉, 冯志勇, 等. 斑玉蕈甘油醛-3-磷酸脱氢酶基因克隆与序列分析[J]. 食用菌学报 , 2011, 18 (2) :5–9. |
| [11] | 杨寅桂, 娄群峰, 陈劲枫, 等. 黄瓜CSHSP70基因内含子结构分析[J]. 中国农业科学 , 2007, 40 (12) :2915–2919. |
| [12] | Park S J, Huh J W, Kim Y H, et al. Selection of internal reference genes for normalization of quantitative reverse transcription polymerase chain reaction (qRT-PCR) analysis in the canine brain and other organs[J]. Mol Biotechnol , 2013, 54 (1) :47–57. |
| [13] | Arumugam P M, Lihuang Z, Akiyama T. Molecular cloning, characterization, expression and chromosomal location of OsGAPDH, a submergence responsive gene in rice (Oryza sativa L[J]. Theor Appl Genet , 2002, 105 (1) :34–42. |
 2016, Vol. 47
2016, Vol. 47


