2. 吉首大学生物资源与环境科学学院 生物系, 湖南 吉首 416000
2. College of Biology and Environmental Sciences, Jishou University, Jishou 416000, China
绞股蓝Gynostemma pentaphyllum (Thunb.) Makino为葫芦科绞股蓝属多年生草质藤本植物,广泛分布于中国、日本、韩国和朝鲜等亚洲国家[1]。绞股蓝因能合成和积累人参皂苷类物质而被称为“南方人参”[2]。绞股蓝皂苷对炎症、肝炎、心血管疾病和癌症等多种疾病具有防治作用,是一种名贵的中药材,具有良好的应用前景和较高的经济价值[3-7]。迄今为止,已发现100种绞股蓝皂苷与人参皂苷有类似骨架的达玛烷型结构[8],其中4种绞股蓝皂苷(Gyp-3、4、8、12)与人参皂苷(Gin-Rb1、Rb3、Rd、F2)的结构完全相同[9]。与人参Panax ginseng C. A. Mey. 相比,绞股蓝不仅有更广阔的资源供给,而且栽培周期更短,因此绞股蓝是一种经济的人参替代品[8, 10]。
绞股蓝皂苷属于三萜类皂苷,三萜皂苷的生物合成是通过甲羟戊酸途径获得的,大致可分为3个步骤。首先是异戊烯基焦磷酸(IPP)经过一系列的转化生成法尼基焦磷酸(FPP),然后FPP转化成鲨烯,最后鲨烯经过环化、氧化、羟基化及糖基化作用生成三萜皂苷[11]。鲨烯合成酶(squalene synthase,SS)在三萜皂苷生物合成途径中起着重要的作用,它催化2分子的FPP缩合生成鲨烯[12-13],而鲨烯是三萜类皂苷合成的重要前体物质。研究表明,刺五加Eleutherococcus senticosus (Rupr. Maxim.) Harms SS基因的过量表达能促进三萜类皂苷的大量合成[14]。因此,SS基因是绞股蓝皂苷生物合成途径中的关键酶基因。
茉莉酸甲酯(MeJA)是一种植物特有的生长调节物质,在植物的防御反应、生长发育及次生代谢中发挥重要作用,可以调控植物抗毒素、生物碱、黄酮类物质、酚酸类及萜类等相关化合物的合成[15-16]。MeJA主要以信号分子的形式调控相关酶基因的表达,影响关键酶活性,从而影响次生产物的代谢。研究表明,MeJA对SS基因的表达具有调节作用。例如在人参不定根组织培养中,培养基中施加一定浓度的MeJA后,促进了人参SS基因的表达[17];又如在茯苓Poria cocos (Schw.) Wolf种菌培养基中施加一定浓度的MeJA后,茯苓SS基因的表达上调[18]。这些研究均是在细胞或组织培养基中施用MeJA来考察MeJA对SS基因表达的影响。然而,通过叶面喷施MeJA的效果如何还知之甚少,MeJA对绞股蓝SS基因的调节作用也未见报道。
为了研究SS及MeJA在绞股蓝皂苷合成途径中的作用,本研究对绞股蓝SS1基因(GpSS1)进行克隆、序列及表达模式分析,并通过喷施不同浓度的MeJA来观察SS基因表达的变化,旨在为揭示绞股蓝皂苷生物合成的分子调控及MeJA对GpSS1的调节机制奠定一定的工作基础,以及为生产实践中改善绞股蓝皂苷品质或提高其产量提供一定的科学理论依据。
1 材料与方法 1.1 材料绞股蓝植株Gynostemma pentaphyllum (Thunb.) Makino由吉首大学刘世彪教授鉴定并提供。供试材料种植在含有营养土的盆(5 L)中,放置在温度为(22±2)℃的生长室里培养。
1.2 方法 1.2.1 绞股蓝叶片总RNA的提取与cDNA第一链的合成参照文献的方法[19],使用EASYspin植物RNA快速提取试剂盒(北京艾德莱生物科技有限公司)提取绞股蓝叶片总RNA,用1%琼脂糖凝胶电泳检测总RNA的质量。以提取的总RNA为模板,采用Fast Quant cDNA第一链合成试剂盒(天根生化科技有限公司)将RNA反转录合成cDNA第一链。
1.2.2 GpSS1基因的克隆根据GenBank数据库中的GpSS序列(登录号为FJ906799)设计GpSS1引物,上游引物:5’-ATGGGCAGTTTTGGGGCGAT-TCT-3’,下游引物:5’-TCACATTGATTGGTTGGC-CG-3’。参照之前的方法[20]以反转录生成的cDNA第一链为模板进行PCR扩增,反应体系为50 μL:4 μL cDNA模板(200 ng),上下游引物各1 μL(20 pmol/L),8 μL dNTP(200 μmol/L),0.8 μL Ex Taq聚合酶(2.5 U)(TaKaRa),1×Buffer补足至50 μL。PCR反应条件为94 ℃预变性5 min,94 ℃变性45 s,54 ℃退火45 s,72 ℃延伸2 min,进行25个循环;最后72 ℃延伸10 min。反应结束后将PCR的全部产物进行凝胶电泳检测,利用琼脂糖凝胶DNA回收试剂盒(天根生化科技有限公司)回收PCR产物,将回收的PCR产物与pMD-18T载体(TaKaRa)连接,获得重组质粒pMD-18T-GpSS1。将重组质粒转化大肠杆菌DH5α感受态细胞(天根生化科技有限公司),筛选阳性克隆并进行菌液PCR鉴定,将鉴定正确的重组质粒进行测序。
1.2.3 GpSS1基因的序列分析GpSS1基因的核苷酸序列及其推断的氨基酸序列由NCBI BLAST程序(http://www.ncbi.nlm.nih.gov/BLAST/)鉴定。推断氨基酸序列的理化特性通过Protparam程序(http://web.expasy.org/protparam/)预测,亲水性采用ProtScale程序(http://web.expasy.org/protscale/)分析,蛋白的跨膜区采用Tmpred程序(http://www.ch.embnet.org/software/TMPRED_form.html)预测,蛋白的功能区运用MotifScan(http://myhits. isb-sib.ch/cgi-bin/motif_scan)鉴定,多重蛋白序列比对采用BioEdit软件分析。
1.2.4 GpSS1在绞股蓝营养器官中的表达分析为了检测GpSS1基因在绞股蓝不同组织部位的表达情况,利用实时荧光定量PCR检测GpSS1在绞股蓝幼叶、老叶及根状茎中的表达量。实验所用绞股蓝材料均为长势一致的二年生植株,幼叶均指植株上部尚未完成形态建成的大小基本一致的浅绿色叶片;老叶均采自植株中下部已完成形态建成的大小一致的深绿色叶片;所试根状茎样品统一选取植株地下部分较粗的、淡黄色,直径约5~6 mm的根状茎。每个样品采自3株植株作为3个生物学重复。参照“1.2.1”项的方法提取绞股蓝样品的总RNA并反转录为cDNA第一链作为实时定量PCR所需的模板。根据GpSS1核苷酸序列设计基因特异引物,上游引物为5’-ATGGGCAGTTTTGGGGCGAT-T-3’,下游引物为5’-GCGTTACGAAGCTGAGGCTG-AAG-3’,扩增长度为194 bp。绞股蓝内参基因GpGAPDH的部分序列(348 bp)参照文献方法[21],根据NCBI上公布的其他物种GAPDH蛋白序列的保守区设计引物以同源克隆的方法获得。根据该序列设计内参基因特异引物,上游引物为5’-TCACGGACAGTGGAAGCATCAT-3’,下游引物为5’-ACCCTTCAAATGAGCAGCAGC-3’,扩增长度为193 bp。实时定量PCR反应体系为20 μL:1 μL稀释10倍的cDNA第一链,上、下游引物各0.4 μL(200 nmol/L)以及10 μL 2×SYBR Premix,ddH2O补足20 μL。反应条件为95 ℃预变性15 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸20 s,进行40个循环。PCR产物的特异性通过熔解曲线分析。使用2−ΔΔCt法进行荧光定量数据的分析。
1.2.5 绞股蓝植株的MeJA处理与GpSS1基因表达的实时定量检测自2015年6月中旬开始,对绞股蓝植株的叶片分别喷施25、50和100 μmol/L的MeJA,以叶面充分润湿为准。在盆的上口、植株茎的下方覆盖一层保鲜膜避免叶面的液滴进入土中,对照喷施蒸馏水。在喷施后的6、24、48、72、96 h采集处理植株及对照的部分幼叶及老叶迅速放入液氮中速冻,然后置于−80 ℃冰箱备用。每个MeJA处理浓度下的样品及对照样品,均采自3株绞股蓝植株作为3个生物学重复,共收集54个实验样品。
参照“1.2.4”项的实时定量方法检测MeJA处理对GpSS1基因表达的影响。
1.2.6 数据的分析实验数据采用SPSS 20.0数据包进行差异显著性分析。每个数据均为3个生物学重复的平均值。3个生物学重复是指来自3株样品平行进行检测。
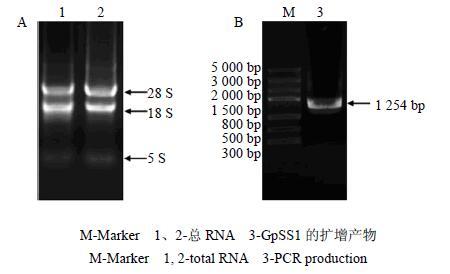
2 结果与分析 2.1 绞股蓝叶片总RNA的质量检测提取的绞股蓝叶片总RNA经1%琼脂糖凝胶电泳后,可清楚看到28、18、5 S rRNA条带(图 1-A),未见有DNA污染。用超微量分光光度计测得其A260/A280的值在1.8~2.0,表明本试验所提取的绞股蓝叶片总RNA降解少且蛋白残留少,产量及完整度较高,可用于后续试验。
|
图 1 绞股蓝叶片总RNA (A) 及GpSS1 (B) 的PCR扩增产物 Fig.1 Total RNA of G. pentaphyllum leaves (A) and PCR production of GpSS1 (B) |
2.2 绞股蓝GpSS1基因的克隆与序列分析
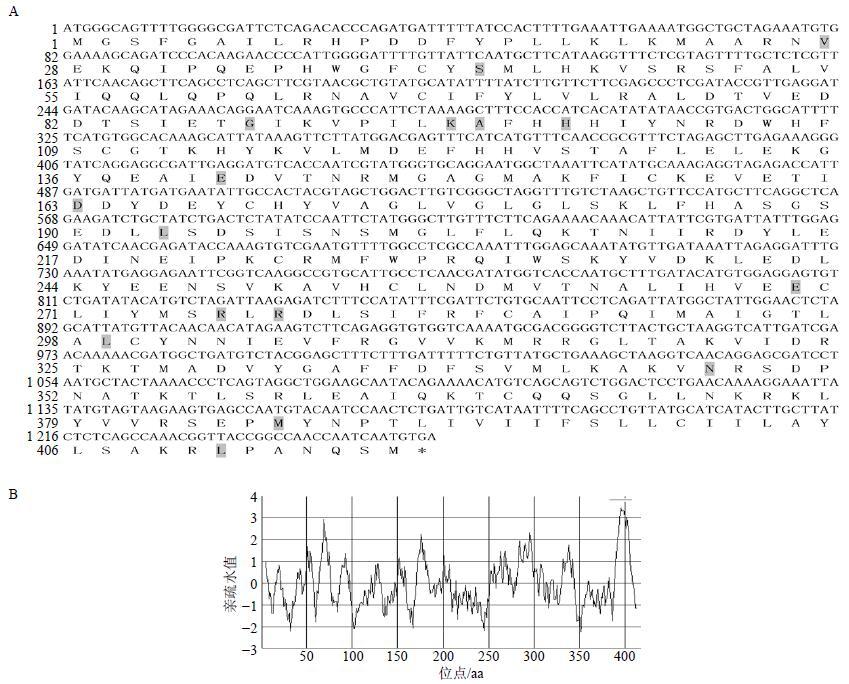
以绞股蓝叶片cDNA为模板进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳检测,获得与预期片段长度相符的特异性条带(图 1-B)。对GpSS1的序列分析得知,该基因编码区长1 254 bp(GenBank登录号:KU363976),编码417个氨基酸(图 2-A)。与GeneBank提供的绞股蓝SS(登录号:FJ906799)推断的蛋白序列相比,有16个氨基酸的不同(图 2-A)。鉴于之前未见对GpSS1基因核酸及氨基酸序列的理化分析以及所克隆的GpSS1基因与GeneBank上提供序列的差异的报道,本实验对所克隆的GpSS1基因的序列做了进一步深入的分析。
|
图 2 绞股蓝GpSS1基因的序列分析 (A) 及GpSS1蛋白的亲水性分析 (B) Fig.2 Sequence analysis of GpSS1 (A) and hydropathy plot of predicted protein (B) of G. pentaphyllum |
利用ExPASy站点的Protparam程序预测绞股蓝GpSS1蛋白的分子式为C2161H3404N574O602S28,相对分子质量为47 960,理论等电点为8.33,亲水性的总平均值为−0.032。使用在线软件ProtScale对GpSS1蛋白的亲水性进一步分析表明,其亲水性低(图 2-B),这与之前的Protparam预测结果是一致的。
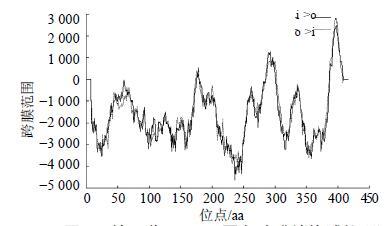
已有研究表明植物SS蛋白是内质网膜结合蛋白[22-23]。鉴于GpSS1蛋白的亲水性低,采用Tmpred软件分析了绞股蓝GpSS1蛋白序列的跨膜结构域(图 3),发现在该蛋白的C端存在3个跨膜区(171~187、285~311、390~406)。这表明GpSS1蛋白通过其C端跨膜区锚定于内质网上,而N端则伸向胞质溶液中。GpSS1蛋白跨膜区的存在也解释了Protparam和ProtScale软件分析其亲水性低的原因。
|
图 3 绞股蓝GpSS1蛋白跨膜结构域的预测 Fig.3 Prediction on transmembrane domains in GpSS1 protein of G. pentaphyllum |
将绞股蓝GpSS1推断的蛋白序列与GpSS蛋白(GenBank登录号为ACQ90302.1)、人参SS蛋白(ACZ71037.1)、甘草Glycyrrhiza uralensis Fisch. SS1蛋白(ADG36701.1)、北柴胡Bupleurum chinense DC. SS蛋白(ACX42426.1)以及拟南芥Arabidopsis thaliana L. SS蛋白(BAA06103.1)序列进行比对,发现它们都具有3个保守区A、B、C(图 4),这3个结构域被认为与SS蛋白催化活性有关[24]。序列比对还发现SS蛋白具有1个天冬氨酸富含区(DXXXD)和1个C端保守的疏水区(图 4)。前者可能是SS蛋白底物(FPP)的结合位点[25],而后者是SS蛋白在内质网上的绑定位点[26-27]。

|
图 4 SS基因氨基酸序列多重比对 Fig.4 Multiple alignments of amino acid in sequence squalene synthase |
2.3 GpSS1基因的表达模式分析
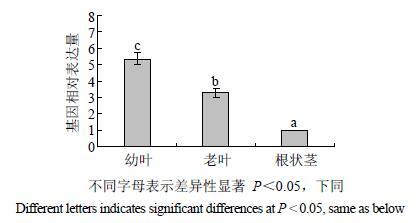
对绞股蓝幼叶、老叶及根状茎中GpSS1基因表达水平的检测结果表明,GpSS1在幼叶中的表达水平最高,在老叶中的表达水平次之,在根状茎中的表达最低(图 5)。这与人参SS基因在人参营养器官中的表达模式是基本一致的[11]。
2.4 MeJA处理对GpSS1基因表达的影响鉴于GpSS1在叶中的表达较高而在根状茎中的表达较低及取材的便利,研究不同浓度MeJA喷施绞股蓝植株后GpSS1在绞股蓝叶片中的表达情况。
结果表明,3种不同浓度的MeJA处理绞股蓝叶片后,与对照相比GpSS1基因在幼叶和老叶各个
|
图 5 GpSS1基因的组织表达模式分析 Fig.5 Tissue-specific expression pattern of GpSS1 gene |
检测时间点的表达水平均有一定的上调(图 6)。在MeJA处理后的6~96 h,GpSS1在幼叶和老叶中的表达水平均呈现出先逐渐上升后有所下降的趋势,但在幼叶中的表达高于老叶中的表达(图 6),这与GpSS1表达模式的分析结果(图 5)是一致的。在实验所设时间范围内,25 μmol/L MeJA处理下幼叶与老叶中GpSS1的表达水平均在24 h达到了峰值,而50、100 μmol/L MeJA处理下幼叶与老叶中GpSS1的表达在48 h达到最高值(图 6)。推测这种现象可能是由MeJA的浓度大小决定的。在MeJA浓度较低时,由于MeJA对GpSS1表达的刺激较弱,GpSS1的表达上调相应就会在较短的时间内完成;而当MeJA浓度较高时,其对GpSS1表达的刺激增强,GpSS1的表达上调相应会持续更久而且上调幅度也会相应增强。在三岛柴胡Bupleurum falcatum L.根组织培养基中添加较低浓度MeJA(20 μmol/L)后,BfSS基因的mRNA表达量在3 h即达到最大值[27],这与推测相符。更为重要的是,本实验发现GpSS1的表达水平并未随着MeJA的浓度增大而持续增强,MeJA处理浓度为50 μmol/L时GpSS1的表达水平上调幅度最大,依次为100和25 μmol/L浓度的MeJA(图 6)。
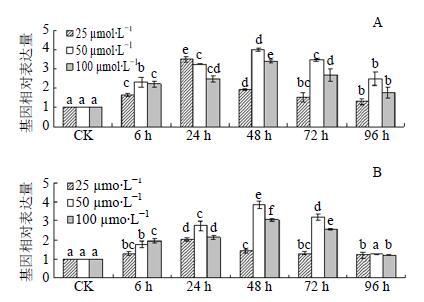
|
图 6 不同浓度MeJA处理下绞股蓝幼叶 (A) 和老叶 (B) GpSS1基因的表达分析 Fig.6 Relative expression of GpSS1 of G. pentaphyllum young leaves (A) and old leaves (B) in response to MeJA at different concentrations |
3 讨论
虽然人参等药用植物SS基因的相关研究已有一些报道[11, 15, 17-18],但植物SS同源基因的序列及表达在不同物种中会存在一定的差异。绞股蓝作为一种重要的药用植物,目前对其SS基因的研究少见报道。GenBank上虽有绞股蓝GpSS基因的序列提供,但未见对其序列及表达的进一步分析。本实验克隆的GpSS1基因编码的蛋白与GpSS蛋白有40个核苷酸及16个氨基酸的不同(图 2-A),但与酶催化活性相关的3个保守区(A、B、C)在两者之间是完全相同的(图 4),这说明SS蛋白的催化功能结构域在植物进化中是高度保守的。两者存在一定氨基酸的差异可能由种源不同导致。GpSS1也可能是绞股蓝SS基因家族的另一个成员。在人参中,SS基因就是一个多拷贝基因,已发现其基因家族的3个成员[24]。
SS基因作为三萜皂苷生物合成途径中的一个关键酶基因,其表达水平的高低会影响植物体内三萜皂苷的合成[14]。本研究发现GpSS1在叶特别是幼叶中的表达水平明显高于根状茎(图 5)。之前的研究表明,相同干质量下根状茎的皂苷含量显著高于叶[28]。因此,推测幼叶可能是绞股蓝皂苷合成的主要部位,而根状茎是其主要贮藏部位。
在植物次生代谢产物的生物合成过程中,MeJA作为一种植物生长调节剂,可以调节代谢合成相关酶的表达来影响植物次生代谢物质的合成。已有研究表明,在培养基中添加一定浓度的MeJA能够促进人参不定根、洋甘草Glycyrrhiza glabra L. 和蒺藜苜蓿Medicago truncatula Gaertn. 悬浮细胞中SS基因的表达[15, 29-31]。然而,MeJA对绞股蓝SS基因的调节作用还未见报道。本研究结果不仅证实了GpSS1的表达受MeJA的调控(图 6),而且发现GpSS1的表达水平不会随着MeJA的浓度增大而持续增强,不是100 μmol/L而是50 μmol/L的MeJA对GpSS1表达的影响最大(图 6),这说明MeJA对GpSS1的表达调节有一定的浓度效应。在京大戟Euphorbia pekinensis Rupr. 茎愈伤组织液体培养中施加不同浓度MeJA(0~200 μmol/L)诱导培养36 h后,EpSS的表达在MeJA处理浓度为100 μmol/L时上调幅度最大[32]。而在人参不定根组织培养中,当培养基中施加不同浓度的MeJA(0~20 μmol/L)后,PgSS1基因的转录水平随着MeJA浓度的增大而持续上调[17]。因此,认为MeJA对SS基因表达调节的浓度效应在不同物种中是有差异的。这些研究结果为进一步阐明MeJA对植物SS基因的表达调控及在农业生产实践中通过MeJA来改善或提高绞股蓝皂苷量提供了一定的科学理论依据。
| [1] | Liu J Q, Wang C F, Chen J C, et al. Six new triterpenoid glycosides from Gynostemma pentaphyllum[J]. Helv Chim Acta , 2009, 92 (12) :2737–2745. |
| [2] | 边古筝, 禹玉华, 郁书君, 等. 药用植物绞股蓝研究进展[J]. 农业与技术 , 2014, 34 (2) :1–5. |
| [3] | Circosta C, Pasquale R D, Occhiuto F. Cardiovascular effects of the aqueous extract of Gynostemma pentaphyllum Makino[J]. Phytomedicine , 2005, 12 (9) :638–642. |
| [4] | 李华, 史美荣, 肖娅萍. 绞股蓝种质资源遗传多样性及亲缘关系的ISSR分析[J]. 中草药 , 2015, 46 (11) :1666–1672. |
| [5] | Lu H F, Chen Y S, Yang J S, et al. Gypenosides induced G0/G1 arrest via inhibition of cyclin E and induction of apoptosis via activation of caspases-3 and-9 in human lung cancer A-549 cells[J]. In Vivo , 2008, 22 (2) :215–221. |
| [6] | 卢汝梅, 潘立卫, 韦建华, 等. 绞股蓝化学成分的研究[J]. 中草药 , 2014, 45 (19) :2757–2761. |
| [7] | 史琳, 赵红, 张璐雅, 等. 绞股蓝药理作用的研究进展[J]. 药物评价研究 , 2011, 34 (2) :125–129. |
| [8] | Subramaniyam S, Mathiyalagan R, Gyo I J, et al. Transcriptome profiling and insilico analysis of Gynostemma pentaphyllum using a next generation sequencer[J]. Plant Cell Rep , 2011, 30 (11) :2075–2083. |
| [9] | Yang Y H, Yang J, Jiang Q H. Hypolipidemic effect of gypenosides in experimentally induced hypercholesterolemic rats[J]. Lipids Health Dis , 2013, 12 (1) :109–116. |
| [10] | Choi K T. Botanical characteristics, pharmacological effects and medicinal components of Korean Panax ginseng C. A. Meyer[J]. Acta Pharmacol Sin , 2008, 29 (9) :1109–1118. |
| [11] | Niu Y Y, Luo H M, Sun C, et al. Expression profiling of the triterpene saponin biosynthesis genes FPS, SS, SE, and DS in the medicinal plant Panax notoginseng[J]. Gene , 2014, 533 (1) :295–303. |
| [12] | 王菡, 富强, 王丽思, 等. 人参皂苷生物合成的相关酶及其基因的研究进展[J]. 人参研究 , 2012, 24 (1) :40–46. |
| [13] | Han J Y, In J G, Kwon Y S, et al. Regulation of ginsenoside and phytosterol biosynthesis by RNA interferences of squalene epoxidase gene in Panax ginseng[J]. Phytochemistry , 2010, 71 (1) :36–46. |
| [14] | Seo J W, Jeong J H, Shin C G, et al. Overexpression of squalene synthase in Eleutherococcus senticosus increases phytosterol and triterpene accumulation[J]. Phytochemistry , 2005, 66 (8) :869–877. |
| [15] | Kim O T, Bang K H, Kim Y C, et al. Upregulation of ginsenoside and gene expression related to triterpene biosynthesis in ginseng hairy root cultures elicited by methyl jasmonate[J]. Plant Cell Tiss Org , 2009, 98 (1) :25–33. |
| [16] | 朱宏涛, 李江, 李元, 等. 茉莉酸甲酯对三七组培苗中总皂苷含量的影响[J]. 西部林业科学 , 2014, 43 (2) :72–78. |
| [17] | Lee M H, Jeong J H, Seo J W, et al. Enhanced triterpene and phytosterol biosynthesis in Panax ginseng overexpressing squalene synthase gene[J]. Plant Cell Physiol , 2004, 45 (8) :976–984. |
| [18] | Wang J R, Lin J F, Guo L Q, et al. Cloning and characterization of squalene synthase gene from Poria cocos and its up-regulation by methyl jasmonate[J]. World J Microb Biot , 2014, 30 (2) :613–620. |
| [19] | 赵娜, 张媛, 李秋琦, 等. 文冠果FAD2的序列与功能分析[J]. 北京林业大学学报 , 2015, 37 (2) :86–93. |
| [20] | Zhao N, Zhang Y, Li Q Q, et al. Identification and expression of a stearoyl-ACP desaturase gene responsible for oleic acid accumulation in Xanthoceras sorbifolia seeds[J]. Plant Physiol Biochem , 2015, 87 (2) :9–16. |
| [21] | Guo H H, Wang T T, Li Q Q, et al. Two novel diacylglycerol acyltransferase genes from Xanthoceras sorbifolia are responsible for its seed oil content[J]. Gene , 2013, 527 (1) :266–274. |
| [22] | Busquets A, Keim V, Closa M, et al. Arabidopsis thaliana contains a single gene encoding squalene synthase[J]. Plant Mol Biol , 2008, 67 (1/2) :25–36. |
| [23] | Masataka K, Seiko K, Akira A, et al. Accumulation of squalene in a microalga Chlamydomonas reinhardtii by genetic modification of squalene synthase and squalene epoxidase genes[J]. PLoS One , 2015, 10 (3) :1–21. |
| [24] | Kim T D, Han J Y, Huh G H, et al. Expression and functional characterization of three squalene synthase genes associated with saponin biosynthesis in Panax ginseng[J]. Plant Cell Physiol , 2011, 52 (1) :125–137. |
| [25] | Bhat W W, Lattoo S K, Razdan S, et al. Molecular cloning, bacterial expression and promoter analysis of squalene synthase from Withania somnifera (L.) Dunal[J]. Gene , 2012, 499 (1) :25–36. |
| [26] | Nguyen H T M, Neelakadan A K, Quach T N, et al. Molecular characterization of Glycine max squalene synthase genes in seed phytosterol biosynthesis[J]. Plant Physiol Biochem , 2013, 73 (6) :23–32. |
| [27] | Kim Y S, Cho J H, Park S, et al. Gene regulation patterns in triterpene biosynthetic pathway driven by overexpression of squalene synthase and methyl jasmonate elicitation in Bupleurum falcatum[J]. Planta , 2011, 233 (2) :343–355. |
| [28] | 刘世彪, 廖海民, 胡正海, 等. 绞股蓝营养器官各发育阶段结构与总皂甙含量相关性的研究[J]. 武汉植物学研究 , 2005, 23 (2) :144–148. |
| [29] | Choi D W, Jung J D, Ha Y I, et al. Analysis of transcripts in methyl jasmonate-treated ginseng hairy roots to identify genes involved in the biosynthesis of ginsenosides and other secondary metabolites[J]. Plant Cell Rep , 2005, 23 (8) :557–566. |
| [30] | Hiroaki H, Pengyu H, Kenichiro I. Up-regulation of soyasaponin biosynthesis by methyl jasmonate in cultured cells of Glycyrrhiza glabra[J]. Plant Cell Physiol , 2003, 44 (4) :404–411. |
| [31] | Suzuki H, Achnine L, Xu R, et al. A genomics approach to the early stages of saponin biosynthesis in Medicago truncatula[J]. Plant J , 2003, 32 (6) :1033–1048. |
| [32] | 张文娟, 曹小迎, 蒋继宏. 茉莉酸甲酯诱导大戟三萜类代谢的研究[J]. 广西植物 , 2015, 35 (4) :590–596. |
 2016, Vol. 47
2016, Vol. 47


