2. 大连工业大学 植物资源化学与应用研究所, 辽宁 大连 116034 ;
3. 西北农林科技大学生命科学学院 生物信息学中心, 陕西 西安 712100 ;
4. 大连工业大学 实验仪器中心, 辽宁 大连 116034 ;
5. 江苏康缘药业股份有限公司, 江苏 连云港 222001
2. Institute of Chemistry and Applications of Plant Resources, Dalian Polytechnic University, Dalian 116034, China ;
3. Biological Informatics Center, College of Life Science, Noth-west Agriculture and Forestry University, Xi'an 712100, China ;
4. Instrumental Analysis Center, Dalian Polytechnic University, Dalian 116034, China ;
5. Jiangsu Kanion Pharmaceutical Co., Ltd., Lianyungang 222001, China
痛风与嘌呤代谢紊乱和(或)尿酸排泄减少所致的高尿酸血症直接相关。痛风的西医发病机制主要有2种:尿酸排泄减少、尿酸生成过多[1]。近年来,痛风发病率逐渐升高,且逐渐呈现出年轻化趋势。西医对痛风的治疗多采用秋水仙碱、非甾体类抗炎药、肾上腺皮质激素、促尿酸排泄药、抑制尿酸生成药等治疗,虽然短期内能取得良好疗效,但易产生成瘾性、肝肾毒性和毒副作用。由此可见。化学药治疗痛风副作用多。而中药在降低复发率、减轻药物自身不良反应等方面有一定优势。国内有多位学者[2-3]指出银杏对高尿酸血症及痛风具有一定的治疗作用,但具体作用机制并不清楚。目前研究认为,银杏中的主要活性成分有黄酮类[4]、萜内酯类[5]、有机酸类,此外还含有聚戊烯醇类酯、多糖类、烷基酚酸类化合物及一些其他营养成分等[6]。银杏提取物具有减轻神经细胞损伤和脑部缺血的作用[7]。
网络药理学从中药成分、靶点与疾病间相互作用的整体性和系统性出发,采用复杂网络模型表达和分析研究对象的药理学性质,特别适宜研究中药多成分-多靶点的作用关系,有利于揭示中药成分复杂作用机制[8-9]。本实验以银杏叶为研究对象,利用随机森林算法建立银杏叶成分-靶点相互作用预测模型,对银杏叶化学成分进行靶点预测,构建银杏叶“成分-靶点-痛风”复杂网络,从网络药理学角度预测银杏叶提取物治疗痛风的有效成分及其潜在靶点,探讨银杏叶预防和治疗痛风的潜在作用机制。
1 模型、数据库和方法 1.1 软件与数据库 1.1.1 预测软件ChemBioDraw Ultra 12.0、ChemBio3D Ultra 12.0、OBioavail 1.1、Matlab 7.0、Sybyl-X 1.1.1.126、Dragon 5.4、Cytoscape 2.8.3。
1.1.2 数据库TCMSP(http://lsp.nwsuaf.edu.cn/tcmsp.php)、TTD(http://bidd.nus.edu.sg/group/ttd/)、DrugBank(http://www.drugbank.ca/)、SEA(http://sea.bkslab.org/)、KEGG(http://www.genome.jp/kegg/)。
1.2 银杏化合物数据库在Google学术、Springer Link数据库、NCBI、Science direct数据库和TCMSP中,以“银杏叶”“化学成分”“结构”为关键词搜集总结银杏中的化学成分结构式(158种)。所有化合物的结构用ChemDraw绘制分子结构,黄酮糖苷在肠道中可能被肠道酶水解成苷配基[10],收集到的化合物根据糖苷酶水解反应进一步去糖基的水解产物的结构,去糖基前后所有化合物都另存为mol2格式的3D结构,得到化合物数据库。
1.3 活性分子筛选以口服生物利用度(OB)≥30%和类药性(DL)≥0.18作为活性化合物的筛选标准。将数据库中具有较高活性的化合物筛选出来。其中OB使用OBioavail1.1系统[11]进行计算,DL用Tanimoto系数[12]进行计算。
1.3.1 OBioaval1.1 系统计算OB 用Sybyl软件对P450蛋白分子进行优化、对接,用DRAGON软件计算描述符,数据处理得到OB值。具体步骤如下:利用Matlab软件修改mol2格式的化合物名称为M_形式(如:化合物Kaempferol改名为M_0),并将化合物合并至.m格式文件,生成“toxName.txt”和“zong.txt”文件;使用Sybyl软件对P450蛋白分子进行优化,目的是为了将蛋白优化到最适宜于小分子进行对接的结构;使用Sybyl软件对小分子化合物3D结构进行优化,为了得到最优的空间结构;使用Sybyl软件对优化后的P450分子和化合物小分子进行对接打分;使用dragon软件计算化合物的描述符,将所有分子对接打分,并按照对接打分由小到大排序与其描述符合并至一个表格中;将数据按照<5、5~6、6~7.5、>7.5进行分组,生成4个“txt”文件,使用Matlab及Sybyl软件将其处理成“_2.txt”文件;使用Tanagra软件计算,数据处理得OB值。
1.3.2 Tanimoto系数计算DL按照下列公式计算DL。
T(x,y)=x·y/(||x||2+||y||2-x·y)
x代表基于Dragon软件计算的银杏叶提取物化合物描述符;
y代表基于Drago软件计算的Drugbank数据库中所有6 511个化合物描述符的平均值
1.4 靶点预测使用结合了随机森林(RF)和支持向量机(SVM)2种方法后设计出来的预测软件[13]预测化合物作用的相关靶点,同时,从SEA数据库中根据化合物结构的相似性对相关人类蛋白靶点进行预测。将2种方法预测的靶点进行整理,得到活性化合物与相关靶点之间的作用关系。
1.5 网络构建为了进一步解释化合物、靶标、通路和疾病之间的复杂关系,构建了2个网络。(1) 化合物-靶点网络(C-T):将筛选出来的银杏叶活性成分和痛风相关的靶点作用关系用Cytoscape2.8.3[14]软件进行建立。(2) 靶点-通路网络(T-P):在KEGG中对所预测验证过的靶点进行通路搜索,建立靶点与疾病间的通路关系。
1.6 研究方法研究方法和流程见图 1。

|
图 1 研究方法与流程 Fig.1 Research methods and processes |
2 结果与讨论
采用网络药理学方法来剖析银杏预防和治疗痛风的可能作用机制,为寻找新的抗痛风先导化合物提供有用的信息。
2.1 活性化合物筛选结果通过数据库和文献查询共收集到银杏叶中小分子化合物158个,其中包括61个黄酮类化合物,25个萜类化合物,以DL≥0.18和OB≥30,筛选出活性化合物39个,其中包括11个黄酮类化合物,11个萜类化合物。具体化合物信息见表 1。
|
|
表 1 筛选的39个活性化合物的OB和DL Table 1 OB and DL of 39 active compounds screened |
银杏黄酮和银杏内酯作为银杏叶中研究深入的小分子化合物,具有广泛的生物活性。结果显示,大多数筛选出来的银杏黄酮和银杏内酯同时具有高的OB和DL,如M_67(OB=49.05%,DL=0.24)、M_68(OB=50.38%,DL=0.24)、M_69(OB=47.37%,DL= 0.32),目前黄酮类化合物在防治高尿酸血症和痛风方面已有报道[15]。其中的槲皮素通过抗炎作用表现出很强的治疗痛风性关节炎功效[16]。Kaempferol(M_0)通过抑制黄嘌呤氧化酶从而治疗痛风[17]。部分具有活性的黄酮和萜类结构式见图 2。
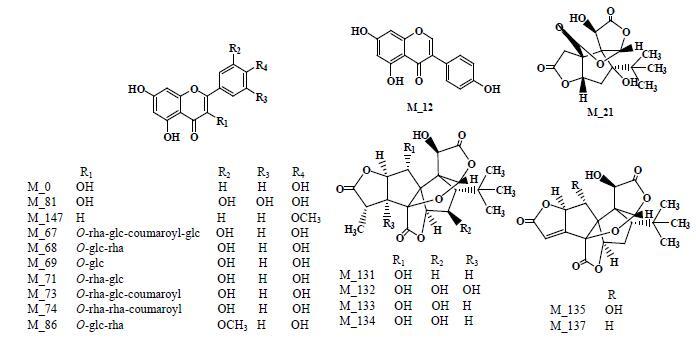
|
图 2 部分活性化合物结构式 Fig.2 Structures of some active compounds |
2.2 银杏叶抗痛风相关的靶点信息
查阅文献和CTD(http://ctdbase.org/),搜寻GOUT致病基因,共查到122个,在Uniprot(http://www.uniprot.org/)网站上查找活性化合物靶点和治病基因的Uniprot ID,并一一对应,相同基因49个,对应24个化合物。见表 2。银杏叶中潜在作用于痛风的有49个靶点,它们的作用主要有转运尿酸、抑制尿酸产生以及干扰NALP3炎症系统。下面选取了3个典型代表进行阐述。
|
|
表 2 痛风的调节基因 Table 2 Regulation genes of gout |
2.2.1
尿酸盐阴离子转运体1(URAT1)SLC22A12 2002年日本学者Enomoto等[18]首次在肾皮质近曲小管发现了大量表达的URAT1,并检测到该蛋白在近曲小管内重吸收尿酸的量高达一半左右。URAT1基因突变会影响尿酸的重吸收过程,造成血尿酸水平的异常。Shima等[19]和关明等[20]分别在日本和中国的受试者中,证实了SLC22A12中的rs893006多态性与高尿酸血症密切相关。因此,Enomoto等[18]提出无论是原发性高尿酸血症还是高尿酸合并肾脏损害,其患者的URAT1基因都存在突变现象,这更有力地说明了URAT1参与了尿酸的重吸收过程。在银杏叶中化合物M_67、M_68_、M_69、M_71、M_73、M_74都抑制SLC22A12,进而可降低尿酸水平。
2.2.2三磷酸腺苷结合盒G超家族成员2(ATP-binding cassette subfamily G member 2,ABCG2) ABCG2是1种三磷酸腺苷结合转运蛋白,在人的肿瘤组织和正常细胞中均有表达,具有抑制消化道吸收某些外源性物质以及参与形成血-脑、胎-血屏障等生理功能。ABCG2也是一种药物排出泵,是导致肿瘤耐药的重要机制之一[21]。最近的研究还显示,ABCG2也在肾近曲小管刷状缘膜上大量表达,负责尿酸的排泄,与高尿酸血症和痛风的发生也密切相关[22]。
目前认为,相比其他尿酸盐转运体(URAT1和GLUT9),ABCG2的基因变异种类最多,对血尿酸水平的影响最大[22-23]。除肾脏外,ABCG2同样也是尿酸排泄的肾脏外调节器,其除在肾近曲小管刷状缘膜上表达外,还在小肠上皮细胞的顶端膜和肝脏细胞中大量表达,负责尿酸在肾脏外的排泄[24]。日本研究者通过分析644名高尿酸血症患者和1 623名尿酸值正常者的情况,发现基因ABCG2是否变异与患病风险有关。分析显示,该基因的变异会导致肾脏功能异常,而人体内的大部分尿酸是通过肾脏排出。在银杏叶中化合物M_67、M_68_、M_69、M_71、M_73、M_74都作用于靶点ABCG2,促进尿酸的排泄。
2.2.3黄嘌呤氧化酶(xanthine oxidase,XOD) XOD在人类嘌呤分解代谢中起重要作用[25]。XOD催化次黄嘌呤生成黄嘌呤,进而生成尿酸[25-26],因为尿酸是导致痛风的主要原因[27],XOD是这种情况治疗最有前途的目标。目前,药物别嘌呤醇和非布索坦可通过抑制XOD降低血清尿酸水平。
别嘌呤醇广泛用于治疗慢性痛风,已超过40年的临床应用。然而,服用别嘌呤常常带来副作用如发热、皮疹、肾功能下降、肝细胞损伤、白细胞增多、嗜酸性粒细胞增多[28]。在目前的研究中[29],槲皮素、桑色素、杨梅酮、山柰酚、葛根素表现出显著的抑制肝脏XOD活性。可能类黄酮主要抑制XOD活性,降低血清尿酸盐的水平。化学结构分析表明,平面结构的羟基黄酮类化合物在降尿酸中起到了至关重要的作用。
NALP3炎症体[30]是一类细胞内膜式识别受体,同Toll样受体(toll-like receptors,TLR)一样,是固有免疫系统对病原体的一种重要感受器,广泛参与对病原体上病原相关分子模式的识别,同时也可感知内源性危险信号相关分子模式,产生相应的炎症应答反应。近期研究显示,NALP3炎症体与痛风炎症发生密切相关。单钠尿酸盐(MSU)晶体作为一个危险信号能被模式识别受体识别,活化多个过程最终导致NALP3炎性体形成,促进白细胞介素-1β(1L-1β)前体转化为成熟的1L-1β,诱导痛风炎症发生。
2.3 网络构建与分析研究表明,银杏叶提取物具有降尿酸作用,但是对于具体通过什么方式降低尿酸的研究却很少。银杏叶提取物对痛风的作用很明显是一个复杂的过程,并非仅是单一化合物作用于单一靶点,而是银杏叶中活性物质共同作用于多个靶点,进而协同作用于痛风疾病的复杂网络。本研究建立了C-T和T-P网络,通过对这2种网络进行分析,来探究活性化合物与其相关靶点之间的关系,分析银杏预防和治疗痛风的潜在作用机制。
2.3.1 C-T网络分析在对筛选得到的39个活性化合物通过靶点预测软件对潜在靶点进行预测,发现有15个化合物没有靶点与其相关,删去这15个化合物后,将“活性化合物”与“潜在靶点”按照相互对应关系使用Cytoscape 2.8.3构建出C-T网络(图 3)。C-T网络中包含73个节点(24个化合物和49个靶点)。从图中可以看出,18个活性化合物与NOS3、NOS2、PPARG、PTGS2、CA2联系紧密。
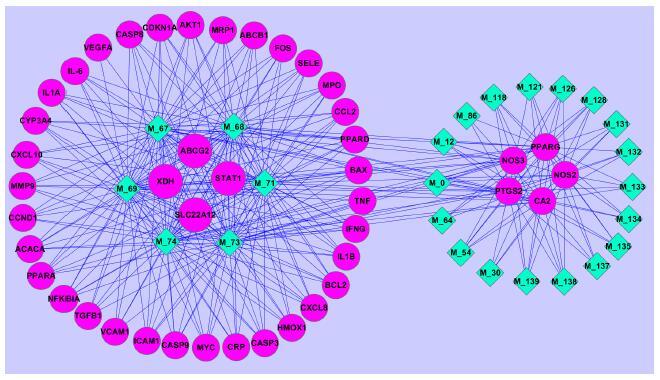
|
图 3 化合物-靶点网络 Fig.3 Compound-target network |
化合物M_67、M_68、M_69、M_71、M_73、M_74与疾病相关的靶点数分别为42、40、42、38、41、40。
2.3.2 T-P网络分析抑制动力学分析表明[17],山柰酚(M_0)可逆性竞争抑制XOD活性。银杏叶中的M_67、M_68、M_69能抑制尿酸代谢中的黄嘌呤氧化酶(XDH),降低尿酸的产生。
对痛风致病基因与银杏叶中的靶点进行通路富集,结果显示大部分通路与炎症通路相关联,Toll-like相关:AKT2、CASP8、NFKBIA、FOS、TNF、IL1B、STAT1、CXCL10;NOD-like相关:CASP8、IKB、CCL2、TNF、IL1B。
CASP8、IκB、CCL2、TNF-α、IL-1β为NOD-like 通路中的相关靶点。MSU作为一个内源性危险信号,沉积于组织会激发强烈的炎症反应,并且能被模式识别受体识别,激活多个过程,最终导致NALP3炎性体的形成(图 4)。NALP3炎性体作为一个多蛋白复合体,活化后可以介导半胱氨酸天冬氨酸蛋白酶-1(caspase-1)的激活,从而促进IL-1β前体转化为成熟的IL-1β,诱导痛风炎症的发生[31]。
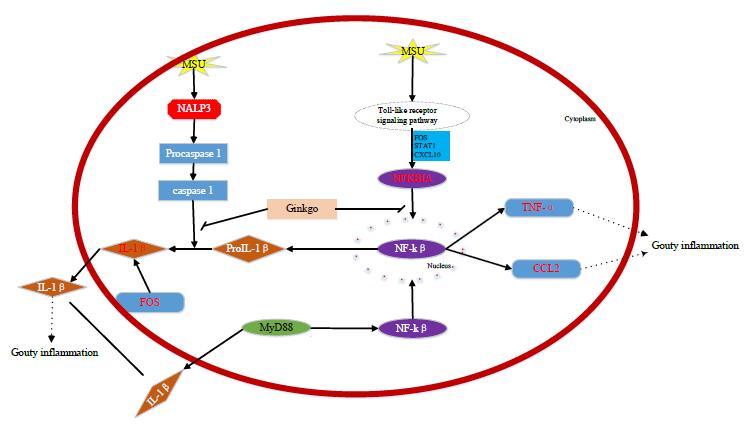
|
图 4 MSU诱导的NALP3炎性体信号通路 Fig.4 NALP3 inflammatory body signal pathway induced by MSU |
3 讨论
痛风是一种复杂的过程,涉及多个基因和各种复杂的疾病,这使得破译痛风机制更加困难。在本研究中,通过毒药物动力学(ADME)筛选、靶点预测、网络构建以及通路分析的网络药理学方法对银杏叶进行研究,筛选出了银杏叶中的活性分子,对其治疗痛风的潜在作用机制进行了阐述。银杏叶中小分子化合物158个,其中包括61个黄酮类化合物,25个萜类化合物,以DL≥0.18和OB≥30,筛选出活性化合物39个,其中包括11个黄酮类化合物和11个萜类化合物。
通过网络和通路分析,银杏叶提取物可能通过以下3种方式治疗痛风:减少尿酸生成、增加尿酸的排泄、抑制由疾病造成NALP3炎性紊乱。
本研究首次应用网络药理学研究系统对银杏叶中的活性化合物及其对痛风的作用机制进行系统研究,从理论预测、分析角度,阐明了银杏叶提取物治疗痛风的潜在作用机制。然而,仍然需要进一步的实验及临床研究对其进行验证及完善。
| [1] | 张瑞芬, 赵晶. 痛风发病机制研究进展[J]. 实用药物与临床 , 2007, 10 (4) :244–246. |
| [2] | 程虹毓, 朱继孝. 银杏叶提取物降尿酸及对黄嘌呤氧化酶抑制作用研究[J]. 中医药通报 , 2013, 12 (2) :61–63. |
| [3] | 李文英, 田大虎, 闫稳平, 等. 银杏叶片对高尿酸血症患者认知功能障碍的疗效观察[J]. 世界中医药 , 2013, 8 (1) :48–50. |
| [4] | 王成章, 陈祥, 谭卫红, 等. 银杏叶中黄酮类化合物及其分析方法[J]. 林产化学与工业 , 1998, 18 (1) :83–88. |
| [5] | 郭瑞霞, 李骘, 李力更, 等. 天然药物化学史话:银杏内酯[J]. 中草药 , 2013, 44 (6) :641–645. |
| [6] | 徐艳芬, 张丽娟, 宋新波. 银杏叶提取物的研究进展[J]. 药物评价研究 , 2010, 33 (6) :452–456. |
| [7] | van Beek T A. Chemical analysis of Ginkgo biloba leaves and extracts[J]. J Chromatogr A , 2002, 967 (1) :21–55. |
| [8] | 刘志华, 孙晓波. 网络药理学:中医药现代化的新机遇[J]. 药学学报 , 2012, 47 (6) :696–703. |
| [9] | Liu Y F, Ai N, Keys A, et al. Network pharmacology for Traditional Chinese Medicine research:methodologies and applications[J]. Chin Herb Med , 2015, 7 (1) :18–26. |
| [10] | Liu J L, Pei M J, Zheng C L, et al. A systemspharmacology analysis of herbal medicines used in health improvement treatment:predicting potential new drugs and targets[J]. Evid Based Complement Alternat Med , 2013 . DOI:10.1155/2013/938764 |
| [11] | Xu X, Zhang W, Huang C, et al. A novel chemometric method for the prediction of human oral bioavailability[J]. Int J Mol Sci , 2012, 13 (6) :6964–6982. |
| [12] | Yamanishi Y, Kotera M, Kanehisa M, et al. Drug-target interaction prediction from chemical, genomic and pharmacological data in an integrated framework[J]. Bioinformatics , 2010 . DOI:10.1093/bioinformatics/btq176 |
| [13] | Yu H, Chen J X, Xu X, et al. A systematic prediction of multiple drug-target interactions from chemical, genomic, and pharmacological data[J]. PLos One , 2011 . DOI:10.1371/journal.pone.0037608 |
| [14] | Shannon P, Markiel A, Ozier O, et al. Cytoscape:A software environment for integrated models of biomolecular interaction networks[J]. Genome Res , 2003, 13 (11) :2498–2504. |
| [15] | 夏道宗, 张英, 吕圭源. 黄酮类化合物防治高尿酸血症和痛风的研究进展[J]. 中国药学杂志 , 2009, 44 (10) :721–723. |
| [16] | 黄敬群, 李舒烨, 朱妙章, 等. 槲皮素对急性痛风性关节炎模型大鼠炎症因子的影响[J]. 现代生物医学进展 , 2011 (S2) :5017–5020. |
| [17] | Wang Y J, Zhang G W, Pan J H, et al. Novel insights into the inhibitory mechanism of kaempferol on xanthine oxidase[J]. J Agric Food Chem , 2015, 63 (2) :526–534. |
| [18] | Enomoto A, Kimura H, Chairoungdua A, et al. Molecular identification of a renal urate-anion exchanger that regulates blood urate levels[J]. Nature , 2002, 417 (6887) :447–452. |
| [19] | Shima Y, Teruya K, Ohta H. Association between intronic SNP in urate-anion exchanger gene, SLC22A12, and serum uric acid levels in Japanese[J]. Life Sci , 2006, 79 (23) :2234–2237. |
| [20] | 关明, 陈宇明, 张炯. SLC22A12基因rs893006基因型与中国人群血尿酸水平密切相关[A]//中华医学会第七次全国检验医学学术会议资料汇编[C]. 北京:中华医学会, 2008. |
| [21] | Doyle L A, Yang W, Abruzzo L V, et al. A multidrug resistance transporter from human MCF-7 breast cancer cells[J]. Proc Natl Acad Sci USA , 1998, 95 (26) :15665–15670. |
| [22] | Matsuo H, Takada T, Ichida K, et al. Common defects of ABCG2, a high-capacity urate exporter, cause gout:a function-based genetic analysis in a Japanese population[J]. Sci Transl Med , 2009 . DOI:10.1126/scitranslmed.3000237 |
| [23] | Krishnamurthy P, Schuetz J D. Role of ABCG2/BCRP in biology and medicine[J]. Annu Rev Pharmacol Toxicol , 2006, 46 :381–410. |
| [24] | Woodward O M, Köttgen A, Köttgen M. ABCG transporters and disease[J]. Febs J , 2011, 278 (18) :3215–3225. |
| [25] | Love B L, Barrons R, Veverka A, et al. Urate-lowering therapy for gout:focus on febuxostat[J]. Pharmacotherapy , 2010, 30 (6) :594–608. |
| [26] | Chao J, Terkeltaub R. A critical reappraisal of allopurinol dosing, safety, and efficacy for hyperuricemia in gout[J]. Curr Rheumatol Rep , 2009, 11 (2) :135–140. |
| [27] | Wyngaarden J B. Overproduction of uric acid as the cause of hyperuricemia in primary gout[J]. J Clin Invest , 1957, 36 (10) :1508–1515. |
| [28] | Singer J Z, Wallace S L. The allopurinol hypersensitivity syndrome. Unnecessary morbidity and mortality[J]. Arthritis Rheum , 1986, 29 (1) :82–87. |
| [29] | 王彩萍. 桑枝提取物主要成分及其调节有机离子转运改善高尿酸血症机理研究[D]. 南京:南京大学, 2009. |
| [30] | 贺玲玲, 赵东宝. NALP3炎性体在痛风发病中的作用[J]. 中华临床医师杂志:电子版 , 2013, 7 (11) :4992–4994. |
| [31] | 何琴花, 王一飞, 张明. Nalp3炎性体与MSU晶体及其在痛风发病中的作用[J]. 医药前沿 , 2015, 5 (31) :134–137. |
 2016, Vol. 47
2016, Vol. 47


