2. 江苏大学药学院, 江苏 镇江 212013
2. Department of Pharmaceutics, Jiangsu University, Zhenjiang 212013, China
牡丹皮[1]为毛茛科(Ranunculaceae)植物牡丹Paeonia suffruticosa Andr. 的干燥根皮,味苦、辛,微寒,归心、肝、肾经,清热凉血、活血化瘀。赤芍[1]为毛茛科植物芍药Paeonia lactiflora Pall. 或川赤芍Paeonia veitchii Lynch的干燥根,味苦,微寒,归肝经,活血化瘀、清热凉血、散瘀止痛。白芍[1]为毛茛科植物芍药Paeonia lactiflora Pall. 的干燥根,味苦、酸,微寒,归肝、脾经,养血调经、敛阴止汗、柔肝止痛、平抑肝阳。牡丹皮、赤芍与白芍属于同科植物,化学成分相同或相似,均含有氧化芍药苷、芍药苷、苯甲酰芍药苷等单萜苷类成分和没食子酸、五没食子酰葡萄糖、丹皮酚等酚酸类成分[2-3],但其传统功效及临床用药却存在很大不同,牡丹皮具有清热凉血、活血化瘀的功效,赤芍具有活血化瘀、散瘀止痛的功效,白芍则具有补血、养血的功效。本实验通过大鼠血瘀模型评价牡丹皮、赤芍与白芍的活血作用并对其活血作用机制进行探究,以期为牡丹皮、赤芍与白芍临床合理用药提供依据。
1 材料 1.1 仪器Aglient 1100高效液相色谱仪(包括四元泵,自动进样器,DAD二极管阵列检测器,美国安捷伦公司);MettlerAL204十万分之一天平(梅特勒-托利多仪器有限公司);Milli-Q超纯水机(美国Millipore公司);BE COMPACT X全自动血凝检测仪,MDK F280全自动血液流变分析仪,TD6001电子天平(天津天马衡基仪器有限公司);TDL-5-A离心机(上海安亭科学仪器厂)。
1.2 试剂没食子酸、丹皮酚(批号110831-200803、13011208中国食品药品检定研究院,质量分数≥98%),氧化芍药苷、芍药内酯苷、芍药苷、苯甲酰芍药苷、五没食子酰葡萄糖(批号14030708、 14030611、13113009、13030401、120827,成都普菲德生物技术有限公司,质量分数≥98%),盐酸肾上腺素(1 mg/mL,批号10141102,上海禾丰制药有限公司),枸橼酸钠(上海凌峰化学试剂有限公司),生理盐水(江苏亚邦生缘药业有限公司),水合氯醛(南京化学试剂有限公司),二抗:羊抗兔免疫球蛋白(IgG,Jackson);一抗:兔抗大鼠内皮型一氧化氮合酶(eNOS,ab95254),兔抗大鼠p-eNOS(Ser1177位磷酸化的eNOS,ab195944),血栓素B2(TXB2)、6-酮-前列腺素F1α(6-keto-PGF1α)ELISA试剂盒均购自南京建成生物科技有限公司。
1.3 药物牡丹皮(批号140506,亳州市万珍中药饮片厂)、赤芍(批号1412086,四川新荷花中药饮片股份有限公司)、白芍(生药材饮片,未经硫磺熏制及炒制,四川成都中川中药饮片有限公司),经南京中医药大学药学院吴德康教授分别鉴定为毛茛科植物牡丹Paeonia suffruticosa Andr. 的干燥根皮、毛茛科植物川赤芍Paeonia veitchii Lynch的干燥根、毛茛科植物芍药Paeonia lactiflora Pall. 的干燥根。丹参注射液(批号1411233,正大青春宝药业有限公司)。
1.4 动物清洁级雄性SD大鼠60只,体质量180~250 g,由江苏省中医药研究院实验动物中心提供,合格证号SYXK(苏)2011-0017。
2 方法 2.1 供试品溶液的制备 2.1.1 药效研究用供试品溶液的制备分别称取牡丹皮、赤芍、白芍各300 g,加75%乙醇加热回流提取2次,第1次加10倍量75%乙醇,第2次加8倍量75%乙醇,每次提取1.5 h,纱布滤过,合并2次滤液,减压浓缩至300 mL,相当于每毫升中含有1 g原药材。
2.1.2 HPLC法分析用供试品溶液的制备将牡丹皮、赤芍、白芍粉碎(过3号筛),精密称取约0.5 g牡丹皮、赤芍、白芍粉末,分别置50 mL锥形瓶中,加25 mL 75%乙醇加热回流1.5 h,同法提取2次,滤过,合并滤液,0.45 μm有机微孔滤膜滤过,即得,待进行HPLC分析。
2.2 牡丹皮、赤芍、白芍化学成分分析 2.2.1 色谱条件[4]色谱柱为Hedera ODS-2(250 nm×4.6 nm,5 μm);流动相为乙腈(A)-0.1%甲酸溶液(B),梯度洗脱:0~20 min,5%~10% A;20~30 min,10% A;30~80 min,10%~18% A;80~120 min,18%~50% A;体积流量0.8 mL/min;柱温25 ℃;检测波长254 nm;进样量10 μL。
2.2.2 对照品溶液的制备分别精密称取没食子酸1.53 mg、氧化芍药苷1.02 mg、芍药内酯苷2.22 mg、芍药苷3.13 mg、五没食子酰葡萄糖2.21 mg、苯甲酰芍药苷1.33 mg、丹皮酚2.59 mg,置10 mL量瓶中,加甲醇溶解,并稀释至刻度,摇匀,制得混合对照品储备液,采用甲醇稀释,得到一系列质量浓度的混合对照品溶液,0.45 μm有机微孔滤膜滤过,备用。
2.2.3 牡丹皮、赤芍、白芍化学成分定量测定牡丹皮、赤芍、白芍药材按“2.1.2”项方法制备,按“2.2.1”项中色谱条件进样分析。
2.3 牡丹皮、赤芍、白芍活血作用比较 2.3.1 动物分组与给药取SD大鼠,雌、雄性各半,60只大鼠随机分成对照组、模型组、阳性药组、牡丹皮组、赤芍组、白芍组。对照组、模型组均按10 mL/kg ig生理盐水,阳性药组ip丹参注射液(原药材3 g/kg,每毫升丹参注射液相当于1.5 g原药材),牡丹皮组(原药材5 g/kg,预试验筛选的有效剂量)、赤芍组(原药材5 g/kg)、白芍组(原药材5 g/kg)均按10 mL/kg ig给药,以上各组均每天给药2次,连续给药7 d。
2.3.2 血瘀大鼠模型的复制参照文献方法[5]复制急性血瘀大鼠模型,第7天给药后禁食:除对照组外,其余各组均sc 0.1%盐酸肾上腺素注射液0.8 mL/kg,对照组sc等容量生理盐水,2 h后,除对照组外,将其余各组大鼠置于冰水中浸泡5 min,取出,吹风机将其吹干,2 h后再次sc 0.1%盐酸肾上腺素注射液0.8 mL/kg,禁食过夜,复制急性血瘀大鼠模型。
2.3.3 血液流变学指标及内、外源性凝血功能指标的测定第8天,给药后30 min,大鼠以10%水合氯醛ip麻醉,腹主动脉取血3 mL,肝素钠抗凝;另取3 mL血液,3.8%枸橼酸钠抗凝,抗凝剂与血液按1∶9混匀,全血3 500 r/min,离心10 min,取上清,即血浆,送往江苏省中西医结合医院检验科,采用全自动血液流变分析仪、全自动血凝仪分别检测血液流变学(血黏度)及凝血功能指标:凝血酶原时间(PT)、部分活化凝血活酶时间(APTT)、凝血酶时间(TT)。
2.3.4 血小板黏附率的测定含EDTA的0.2 mmol/L无钙Tyrode液(pH 6.5)的制备:NaCl 8 g、KCl 0.2 g、NaH2PO4 0.05 g、MgCl2 0.1 g、NaHCO3 1 g、葡萄糖 1 g、EDTA 58.4 μg,双蒸水定容至1 L,用磷酸调pH值至6.5。血小板的制备:腹主动脉取血,3.8%枸橼酸钠抗凝,抗凝剂与血液以1∶9混匀,800 r/min离心10 min,取上清,即得富血小板血浆,再3 000 r/min离心10 min,取沉淀,即得血小板,Tyroder溶液洗涤2次,并将血小板稀释成4×108个/mL。对硝基苯磷酸二钠(pNpp)溶液制备:精密称取pNpp 0.05 g,柠檬酸0.13 g,柠檬酸三钠0.55 g,加入25 μL Triton X-100,定容至25 mL。
在微量反应板中的每个小孔中加入1 mg/mL的I型胶原蛋白100 μL,4 ℃过夜。包被好的微量反应板在临用前需要用生理盐水冲洗2次,分别加入100 μL各组的血小板悬浮液,37 ℃孵育1 h,PBS冲洗微量反应板2次,快速加入150 μL的pNpp溶液,室温孵育1 h,100 μL 2 mol/L NaOH溶液终止反应,全自动酶标仪在405 nm测定吸光度(A)值。
2.3.5 Western blotting法检测血小板内皮型一氧化氮合酶(eNOS)和磷酸化的eNOS(p-eNOS)蛋白表达水平将各组大鼠血小板加裂解液充分裂解,4 ℃下13 000 r/min,离心10 min,取上清,于95~100 ℃孵育5 min后冰上冷却上样,进行电泳分离:浓缩胶恒压80 V约30 min,分离胶100 V约90 min,取出凝胶,置于转移缓冲液中平衡15 min,按恒流200 mA通电,电转移100 min进行转膜,PVDF膜在5%脱脂奶粉封闭液中封闭(4 ℃,过夜),弃去封闭液,不洗。加入封闭液和一抗抗体(1∶1 000)摇床摇荡孵育(4 ℃,过夜),PBST漂洗滤膜4次,每次10 min。将膜与HRP结合的二抗(辣根过氧化酶标记抗体,二抗用封闭液稀释1∶5 000)室温下摇荡孵育2 h,然后用PBST充分洗膜,漂洗4次,每次10 min,按0.1 mL/cm2显影液计算用量,将显影液加于PVDF膜上,室温放置1 min。用保鲜膜将膜包好(尽量避免气泡),置于凝胶成像系统拍照,封存。
2.3.6 血清中TXB2和6-keto-PGF1α的检测大鼠眼丛静脉取血,不加抗凝剂,3 500 r/min离心10 min,取上清,ELISA法测定TXB2和6-keto-PGF1α的量,严格按照试剂盒说明书进行操作。
2.4 统计学方法采用SPSS 16.0统计软件对数据进行多样本t检验及方差分析,实验数据以x±s表示。
3 结果 3.1 牡丹皮、赤芍、白芍成分分析结果牡丹皮、赤芍、白芍药材醇提物及混合对照品的HPLC图谱见图 1,以各色谱峰峰面积(Y)对质量(X)进行线性回归,各成分的回归方程、相关系数及线性范围见表 1。根据各成分的标准曲线计算牡丹皮、赤芍、白芍75%醇提物中各成分的量,每个样品重复测定3次,测定结果见表 2,赤芍、白芍中均检测出没食子酸、氧化芍药苷、芍药内酯苷、芍药苷、五没食子酰葡萄糖、苯甲酰芍药苷、丹皮酚,牡丹皮药材中除芍药内酯苷未能检出,其他成分均能检测到,但各成分在3种药材中的量存在较大差别,赤芍中的芍药苷明显比牡丹皮及白芍中的量高,赤芍与白芍中的芍药内酯苷较牡丹皮高,而牡丹皮中丹皮酚的量明显高于赤芍与白芍。
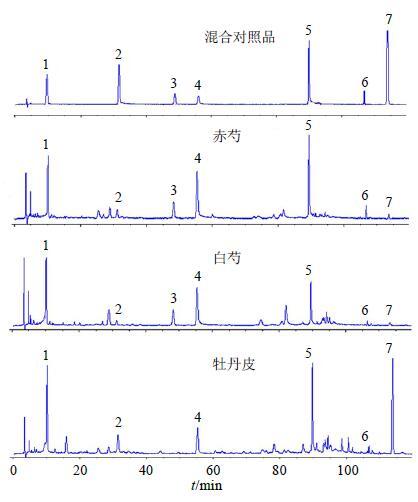
|
图 1 混合对照品及各药材醇提物HPLC色谱图 Fig.1 HPLC of mixed reference substance and alcohol extract of each medicinal material |
|
|
表 1 7种成分的回归方程、相关系数及线性范围 Table 1 Regression equation,correlation coefficient,and linear rangeof seven components |
|
|
表 2 牡丹皮、赤芍与白芍药材醇提物中7种化学成分的量 (x±s,n = 3) Table 2 Contents of seven components from Moutan Cortex,Paeoniae Rubra Radix,and Paeoniae Alba Radix (x±s,n = 3) |
3.2 牡丹皮、赤芍、白芍活血作用比较 3.2.1
血液流变学指标及内、外源性凝血功能指标PT、APTT、TT比较 结果见表 3,与对照组相比,模型组全血黏度和血浆黏度均升高(P<0.05、0.01),血液黏滞性增强,表明血瘀模型复制成功。高切变率(200 s−1)下,赤芍组能显著改善全血黏度(P<0.01),牡丹皮组与白芍组则无显著作用。中、低切变率(30 s−1、3 s−1)下,牡丹皮组与赤芍组均显著降低血瘀模型大鼠全血黏度(P<0.05、0.01),白芍则对血瘀模型大鼠全血黏度无明显作用,牡丹皮组显著降低血浆黏度(P<0.05)。与白芍组比较,赤芍组显著降低高切变率(200 s−1)下的全血黏度(P<0.05)。
|
|
表 3 牡丹皮、赤芍与白芍对急性血瘀模型大鼠血液流变学指标的影响 (x±s,n = 10) Table 3 Effects of Moutan Cortex,Paeoniae Rubra Radix,and Paeoniae Alba Radix on hemorheology of acute blood stasis model rats (x±s,n = 10) |
牡丹皮组及赤芍组能作用于外源性途径而显著延长血瘀模型大鼠的PT(P<0.05),白芍组则对PT无明显的影响;赤芍组与牡丹皮组间则无明显的差异。赤芍组、白芍组均能作用于内源性途径而显著延长模型大鼠APTT(P<0.05、0.01),且赤芍与白芍对APTT的作用有显著差异(P<0.05),而牡丹皮组对APTT的作用未达到显著性差异,且与赤芍组之间存在显著性差异(P<0.05)。牡丹皮组、赤芍组、白芍组均能显著延长TT(P<0.05、0.01);与白芍组相比,赤芍组显著延长TT(P<0.05)。结果见表 4。
|
|
表 4 牡丹皮、赤芍、白芍对急性血瘀模型大鼠PT、TT和APTT的影响 (x±s,n = 10) Table 4 Effects of Moutan Cortex,Paeoniae Rubra Radix, and Paeoniae Alba Radix on PT,APTT,and TT of acute blood stasis model rats (x±s,n = 10) |
3.2.2
血小板黏附率及eNOS、p-eNOS蛋白表达水平的比较 由图 2可见,与对照组比较,模型组大鼠血小板黏附率明显增加(P<0.001)。与模型组比较,牡丹皮组、赤芍组、白芍组大鼠血小板黏附率均显著下降(P<0.05、0.01);与白芍组相比,牡丹皮组与赤芍组对血小板黏附率有较优的改善趋势,且牡丹皮组与白芍组比较,存在显著性差异(P<0.05)。
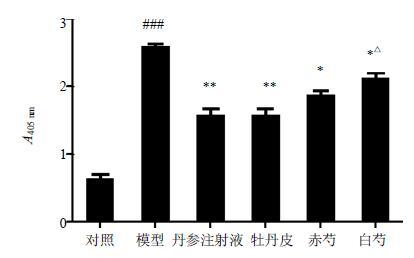
|
图 2 牡丹皮、赤芍与白芍抑制血小板黏附的作用 (x±s,n = 10) Fig.2 Inhibition of Moutan Cortex,Paeoniae Rubra Radix,and Paeoniae Alba Radix on platelet adhesion (x±s,n = 10) |
由图 3可见,与对照组比较,模型组大鼠血小板的p-eNOS、eNOS蛋白水平明显降低(P<0.01、0.001);与模型组相比,牡丹皮组显著增加p-eNOS、eNOS的蛋白水平(P<0.01、0.001),且赤芍组与白芍组也能增加p-eNOS、eNOS的蛋白水平(P<0.05)。与牡丹皮组比较,赤芍组与白芍组作用均较弱,且存在显著性差异(P<0.05),但赤芍与白芍两组之间无显著性差异。
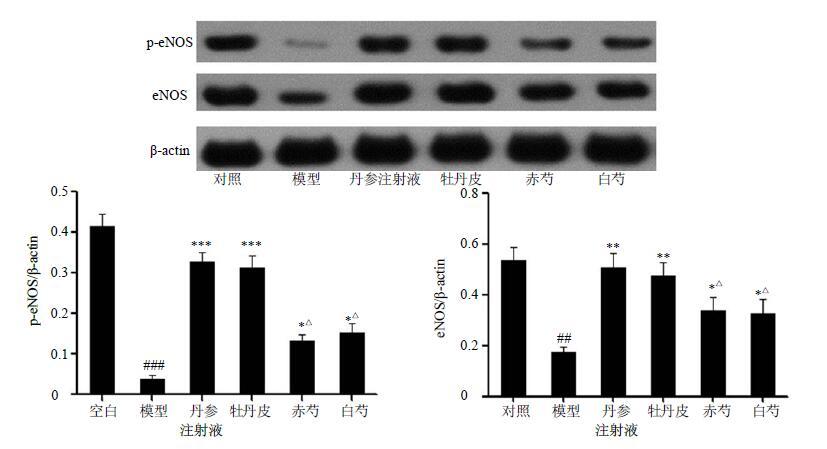
|
图 3 牡丹皮、赤芍与白芍对急性血瘀模型大鼠血小板中eNOS和p-eNOS蛋白表达的影响 (x±s,n = 10) Fig.3 Effects of Moutan Cortex,Paeoniae Rubra Radix,and Paeoniae Alba Radix on expression of eNOS and p-eNOS in platelets of acute blood stasis model rats (x±s,n = 10) |
3.2.3
血清中TXB2、6-keto-PGF1α水平的比较 结果见图 4。模型组与对照组相比TXB2、6-keto-PGF1α均有显著性差异(P<0.01)。牡丹皮组及赤芍组均显著降低血清中TXB2的量(P<0.05、0.01),且升高6-keto-PGF1α的量(P<0.01),白芍组能显著升高6-keto-PGF1α的量(P<0.05),且具有降低血清中TXB2量的趋势,但未达到显著性差异。与赤芍组相比,白芍组对血清中TXB2的影响明显较弱(P<0.05),且两组中TXB2/6-keto-PGF1α差异显著(P<0.01)。
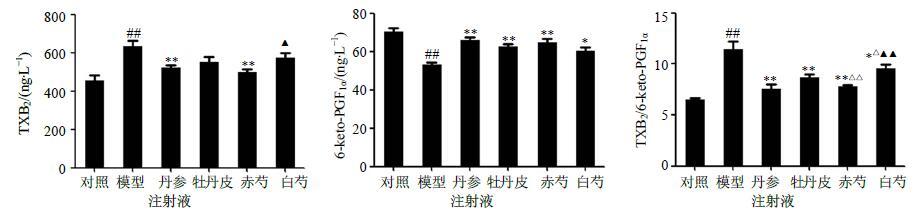
|
图 4 牡丹皮、赤芍与白芍对急性血瘀模型大鼠血清中TXB2和6-keto-PGF1α水平的影响 (x±s,n = 10) Fig.4 Effects of Moutan Cortex,Paeoniae Rubra Radix,and Paeoniae Alba Radix on levels of TXB2 and 6-keto-PGF1α in serum of acute blood stasis model rats (x±s,n = 10) |
4 讨论
血液流变学,是针对血液进行的物理流变学检测,研究血液及其有形成分的流变学特性,目前血液流变学检验已广泛用于临床,其对很多疾病有预报性,如糖尿病、高血压、冠心病等[6]。血液流变学分为宏观血液流变学与微观血液流变学,宏观血液流变学将血液作为连续介质,研究血液与血浆的宏观流变性质;微观血液流变学则研究血液内部微观结构与血液流变性的关系[7]。全血黏度和血浆黏度反映了血液最基本的流变特性,测定这些指标对心血管系统疾病的预防、治疗有重要的参考价值。本实验中,赤芍能够显著改善不同切变率下血瘀模型大鼠的全血黏度,牡丹皮组及白芍组则对不同切变率下的全血黏度及血浆黏度有较弱的或无明显的改善作用,说明赤芍充分发挥了活血化瘀的作用,能够显著地改善血瘀模型大鼠异常的血液流变性,其作用较牡丹皮及白芍强。
PT、APTT、TT是临床上用于检测内、外源性凝血系统功能最常用的筛选方法,是术前患者必须做的常规检测项目,也是凝血系统疾病的诊断指标[8]。PT是外源性凝血系统的筛选指标,反映血浆凝血酶原水平,APTT反映内源性凝血因子的活性变化,TT反映了内、外源凝血途径的共同途径。因此,本实验选择了PT、APTT、TT 3个指标来研究牡丹皮、赤芍、白芍抗凝的功效。模型组大鼠血浆的PT、TT显著缩短,说明模型组大鼠凝血系统出现异常。牡丹皮组通过影响PT、TT,改善急性血瘀模型大鼠的凝血系统;赤芍组显著延长PT、APTT、TT,可以通过内、外源凝血途径共同调节凝血系统,具有很强的活血化瘀功效;白芍组则对APTT、TT有延长的作用,对PT无显著的改善作用。牡丹皮、赤芍、白芍化学成分类似,对急性血瘀模型大鼠的凝血系统作用指标及强度均存在差异,这可能与3种药材中的各化学成分的量及其特定的配比有关。
eNOS的功能与凝血系统血小板聚集功能异常存在相关性[9];TXA2是目前已知最强的血小板聚集诱导剂和缩血管物质之一,具有促进血小板聚集和诱发血栓形成的作用,它的半衰期只有30 s,在血液中很快降解为TXB2;前列腺素I2(PGI2)是一种对血小板聚集最有效的内源性抑制剂,具有抗血小板聚集和舒张血管的作用,PGI2的性质不稳定,迅速水解成6-keto-PGF1α,在正常的生理状态下,循环血中TXA2及PGI2处于相对平衡状态,相互拮抗,TXA2/PGI2失衡导致机体瘀血及血栓的形成[10]。本实验通过检测牡丹皮、赤芍、白芍对血小板黏附率、血小板中eNOS、p-eNOS蛋白表达及血清中TXB2、6-keto-PGF1α水平的影响,探讨牡丹皮、赤芍与白芍活血化瘀功效的机制。实验中血瘀模型大鼠血小板黏附率显著升高,血小板中eNOS、p-eNOS蛋白表达下调,血清中TXB2的量显著升高,且6-keto-PGF1α的量降低,说明血瘀模型大鼠造模成功;与模型组相比,牡丹皮组、赤芍组与白芍组均能够抑制血小板黏附,且上调eNOS、p-eNOS蛋白的表达,牡丹皮组的作用较赤芍组与白芍组强,而赤芍组与白芍组之间无显著性差异;牡丹皮组及赤芍组均能显著降低TXB2的量,同时升高6-keto-PGF1α的量,白芍亦能降低TXB2及升高6-keto-PGF1α量,但其效果不及赤芍,且存在显著性差异。
目前有文献报道,芍药苷、苯甲酰芍药苷、丹皮酚等成分具有抗血小板聚集的作用[11-12],且对TXA2及PGI2具有一定的作用[13-14],说明这些成分与其活血化瘀的功效存在一定的联系。牡丹皮、赤芍、白芍皆为毛茛科植物,其化学成分类似,均含有没食子酸、氧化芍药苷、芍药内酯苷、芍药苷、五没食子酰葡萄糖、苯甲酰芍药苷、丹皮酚等化学成分,但其物质基础结构差异较大,牡丹皮药材中丹皮酚的量较高,而在赤芍及白芍药材中只含微量[3, 15],其中没食子酸、氧化芍药苷、芍药内酯苷、芍药苷、五没食子酰葡萄糖、苯甲酰芍药苷、丹皮酚的量比为1.46∶0.78∶0∶11.76∶4.94∶1.06∶16.84;赤芍药材中芍药苷的量较白芍药材高[16],其中各成分的量比为1.26∶0.44∶12.62∶27.85∶5.15∶1.70∶0.30;白芍中各成分的量比为1.62∶0.30∶15.70∶21.40∶4.04∶1.48∶0.12,3味药材的各成分所占的比例存在较大的差异,其物质结构基础的不同可能是其药材功效差异的原因,体现了中药之秘在于量,“量”是物质基础组成的关键。本实验依据中医药理论关于血瘀证的暴怒及寒邪的诱因,通过sc肾上腺素结合冰水刺激,复制大鼠血瘀模型,并从内、外源性凝血系统,血小板系统,血液流变学及血清中TXB2、6-keto-PGF1α的量变化的角度探讨牡丹皮、赤芍、白芍活血化瘀的功效。结果显示,牡丹皮、赤芍、白芍均具有一定程度的活血化瘀功效,其中牡丹皮、赤芍更长于活血化瘀功效,但其作用途径存在差异,3种药材功效上及作用途径上的差异可能与药材中的各成分的量及配比存在密切的关系。本研究为3者在临床上用于治疗不同病症提供了一定的依据;但是,对于牡丹皮、赤芍、白芍功效差异的物质基础,以及这些物质基础对活血化瘀功效的贡献度等相关问题还需进一步深入探讨。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | 谢剑琳, 张振秋, 杨超, 等. HPLC波长切换法同时测定牡丹皮中6个成分的含量[J]. 中国实验方剂学杂志 , 2013, 19 (2) :85–89. |
| [3] | 余捷婧, 吴金雄, 梁亚凤, 等. HPLC同时测定赤芍和白芍中没食子酸等6种成分的量[J]. 中草药 , 2015, 46 (11) :1673–1677. |
| [4] | 张明华. 道地丹皮防治糖尿病肾病优效性物质基础的独特组分结构特征密码探究[D]. 镇江:江苏大学, 2014. |
| [5] | 陈奇. 中药药理学实验方法学[M]. 北京: 人民卫生出版社, 1996 . |
| [6] | 李玲芬. 血液流变学检测及临床意义[J]. 现代中西医结合杂志 , 2005, 14 (18) :2480–2482. |
| [7] | 王红梅. 血液流变学检验及其临床应用[J]. 中国民族民间医药 , 2009, 18 (23) :81. |
| [8] | 张春雨. PT、APTT、TT、Fg检测及临床应用[J]. 中国实用医药 , 2015, 10 (7) :108–109. |
| [9] | 张小丽, 韦晟. 银杏内酯B抑制血小板活化研究[J]. 全科医学临床与教育 , 2015, 13 (2) :135–138. |
| [10] | 陈春, 杨天伦. TXA2/PGI2与心血管疾病[J]. 现代生物医学进展 , 2008, 8 (11) :2166–2168. |
| [11] | Koo Y K, Kim J M, Koo J Y, et al. Platelet anti-aggregatory and blood anti-coagulant effects of compounds isolated from Paeonia lactiflora and Paeonia suffruticosa[J]. Pharmazie , 2010, 65 (8) :624–628. |
| [12] | 郭齐, 李连达, 郝伟, 等. 牡丹皮有效组分重组方对家兔血小板聚集及凝血功能的影响[J]. 中国现代应用药学 , 2010, 27 (11) :967–970. |
| [13] | 闵存云, 刘和强, 詹锋, 等. 牡丹皮对糖尿病大鼠PGI2、TXA2、ET、NO的影响[J]. 中药材 , 2007, 30 (6) :687–690. |
| [14] | 饶梦琳, 唐蜜, 何锦悦, 等. 芍药苷对大鼠局灶性脑缺血再灌注脑血流量及PGI2/TXA2平衡的影响[J]. 药学学报 , 2014, 49 (1) :55–60. |
| [15] | 刘小蔓, 常增荣, 戴俊东, 等. HPLC法同时测定牡丹皮中4种化学成分的含量[J]. 中国新药杂志 , 2015, 24 (8) :954–957. |
| [16] | 李明元, 范成杰, 万丽, 等. 相同基源的赤芍和白芍中芍药苷含量的比较[J]. 现代生物医学进展 , 2008, 8 (6) :1142–1143. |
 2016, Vol. 47
2016, Vol. 47


