2. 天津药物研究院 释药技术与药代动力学国家重点实验室, 天津 300193 ;
3. 天津药物研究院 天津市中药质量控制技术工程实验室, 天津 300193
2. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China ;
3. Tianjin Engineering Laboratory of Quality Control Technology of Traditional Chinese Medicine, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
元胡止痛片是典型且相对简单的中药复方制剂,由延胡索和白芷2味中药组成,多年来在临床上应用于治疗胃痛、胁痛、头痛、行经腹痛及创伤性肿胀疼痛[1-2]。经研究发现,生物碱和香豆素类化合物是延胡索和白芷中的主要活性成分[3],且具有广泛的药理活性,如血管舒张、止痛、抗炎、抗焦虑及抗痉挛等[4-9]。其中延胡索乙素是延胡索中的异喹啉类生物碱,是元胡止痛片中的重要活性成分,《中国药典》将延胡索乙素作为延胡索和元胡止痛片的质控成分。欧前胡素是白芷中的香豆素类化合物,具有良好的止痛、抗炎等药理活性[10-12],现已被作为白芷的质控成分[1]。
目前,关于延胡索乙素和欧前胡素的药动学研究有很多,但大部分已报道文献都集中于延胡索乙素[13-15]和欧前胡素[16-18]单一成分的药动学研究。也有文献报道在元胡止痛提取物给药后,对动物体内的包括延胡索乙素在内的多种成分进行药动学研究。如Gao等[19]用LC-MS/MS法同时测定延胡索和元胡止痛提取物给药后,小鼠血浆和脑组织中延胡索乙素、小檗碱、巴马汀和脱氢紫堇碱4种生物碱的质量浓度,其中延胡索乙素的定量下限为5 ng/mL。另外,Tao等[20]建立了液相色谱串联四级杆飞行时间质谱的方法检测元胡止痛提取物ig给药后,大鼠血浆中包括延胡索乙素及紫堇碱在内的5种化合物,延胡索乙素线性范围为50~5 000 ng/mL,该研究虽然在大鼠血浆中同时检测到了欧前胡素,但并未将欧前胡素作为元胡止痛提取物的关键活性成分进行药动学研究。目前虽然已建立有多种方法测定生物样品中欧前胡素的量[16, 18, 21],但尚无同时对欧前胡素和延胡索乙素2种有效成分进行药动学研究的方法。建立元胡止痛片给药后,同时测定延胡索乙素和欧前胡素2种有效成分的分析方法,对于研究2者在体内的暴露行为及其药动学研究具有十分重要的意义。
延胡索乙素和欧前胡素2种活性成分在元胡止痛片中的量均很低[22],本实验考察的元胡止痛片,经测定其延胡索乙素和欧前胡素的量分别为0.4 mg/g和0.26 mg/g。当每只犬以18片的剂量经口服给药时,延胡索乙素和欧前胡素实际的给药量仅为0.18 mg/kg和0.117 mg/kg。因此,需要建立高灵敏度的分析方法描述元胡止痛片给药后2种主要成分在Beagle犬体内的药动学特征。本研究旨在建立一种高灵敏度、高准确度的LC-MS/MS方法,同时测定Beagle犬血浆中的延胡索乙素和欧前胡素,阐明元胡止痛片给药后Beagle犬体内延胡索乙素和欧前胡素的药动学特征。
1 材料 1.1 仪器日本Shimadzu公司Prominence 30 A液相色谱仪,配有LC-30AD二元梯度泵,CTO-30A柱温箱,SIL-30AC自动进样器,DGU-20A5脱气机;美国Applied Biosystems公司Sciex TRIPLE QUADTM 5500型三重四极杆串联质谱仪,配有电喷雾离子化源(ESI)以及Analyst 1.5.2数据处理软件;Zorbax Eclipse XDB-C18(50 mm×4.6 mm,5 μm)色谱柱,Agilent Technologies公司;BM-40型纯水制备系统,北京中盛茂源科技发展有限公司。
1.2 药品与试剂延胡索乙素对照品(批号110726-201414,质量分数99.9%)、欧前胡素对照品(批号110826-201214,质量分数99.5%)均由天津药物研究院中药现代研究部提供;乙氧苯柳胺(中国食品药品检定研究院,批号100680-200901,质量分数100%);元胡止痛片(南宁市维威制药有限公司,批号130805,糖衣片,规格0.45 g/片,片芯质量 0.25 g/片);甲醇(色谱级,天津市康科德科技有限公司);甲酸(色谱级,天津光复精细化工研究所);甲基叔丁基醚(色谱纯,美国Tedia公司);超纯水(BM-40仪器自制)。
1.3 动物健康Beagle犬6只,雌雄各半,普通级,体质量10.1~11.8 kg,由北京玛斯生物技术有限公司提供。饲养间采用明暗各12 h间隔的照明控制,饲养室的温度保持在(22±1)℃,湿度保持在(60±5)%。
2 方法 2.1 色谱条件色谱柱为Zorbax Eclipse XDB-C18(50 mm×4.6 mm,5 μm),柱温40 ℃,流动相为100%甲醇-0.1%甲酸水溶液,梯度洗脱:0~2.5 min,40%甲醇,2.5~4.8 min,90%甲醇;5.0~7.0 min,98%甲醇;7.1~11 min,40%甲醇;体积流量为0.4 mL/min,进样量为10 μL。
2.2 质谱条件离子源为电喷雾离子源(ESI),正离子扫描模式,多反应监测(MRM)定量检测(驻留时间200 ms);各项参数分别为卷帘气(CUR):68.95 kPa(10 psi),碰撞气(CAD):55.06 kPa(8 psi),喷雾电压(IS):5 000 V,源温度(TEM):400 ℃,Gas1:620.55 kPa(90 psi),Gas2:273.80 kPa(40 psi),入口电压(EP):6 V,碰撞出口电压(CXP):15 V;延胡索乙素:m/z 356.2 [M+H]+→m/z 192.1,碰撞能(CE)75 V,去簇电压(DP)280 V;欧前胡素:m/z 271.1 [M+H]+→m/z 203.0,CE 19 V,DP 65 V;内标乙氧苯柳胺:m/z 258.1 [M+H]+→m/z 121.1,CE 30 V,DP 80 V。
2.3 溶液配制配制的待测物质控样品储备液和工作液均存放于4 ℃冰箱,临用时室温放置30 min后使用。
2.3.1 延胡索乙素和欧前胡素的混合对照品储备液与系列工作液分别精密称取延胡索乙素10.01 mg,欧前胡素10.05 mg分别置于50 mL量瓶中,用甲醇定容,混合均匀,得200 μg/mL的延胡索乙素和200 μg/mL欧前胡素对照品溶液,精密量取1 mL延胡索乙素对照品溶液(200 μg/mL)和0.1 mL欧前胡素对照品溶液(200 μg/mL),置于100 mL量瓶中,用甲醇定容,混合均匀,得含2 μg/mL延胡索乙素和0.2 μg/mL欧前胡素的混合对照品溶液。随后用甲醇梯度稀释成延胡索乙素质量浓度分别为20、10、2、1、0.2、0.1、0.05 ng/mL和欧前胡素质量浓度分别为2、1、0.2、0.1、0.02、0.01、0.005 ng/mL的系列混合对照品工作液及延胡索乙素质量浓度分别为16、2、0.1 ng/mL和欧前胡素质量浓度分别为1.6、0.2、0.01 ng/mL的系列质控混合工作液。
2.3.2 内标储备液与工作液精密称取10 mg乙氧苯柳胺,置于10 mL量瓶中,用甲醇溶解定容,混合均匀,得1.0 mg/mL内标储备液I。精密量取1.0 mg/mL内标储备液I 1 mL,置于100 mL量瓶中,用甲醇定容,混匀得10 μg/mL内标储备液II。精密量取10 μg/mL内标储备液II 1.00 mL,置于500 mL量瓶中,用甲醇定容,混匀得20 ng/mL内标工作液。
2.4 血浆样品采集健康Beagle犬6只,po给予元胡止痛片,给药剂量为4.5 g/犬,即18片/犬,相当于36 g生药,20 mL水送服,给药前禁食,自由饮水,给药后4 h喂食。分别于给药前(0 h)及给药后0.083、0.25、0.5、1、1.5、2、3、4、6、8、12、24、30 h从犬前肢静脉采血4 mL,肝素抗凝,离心分离血浆(4 ℃、4 000 r/min离心5 min),−80 ℃冰箱冻存至测定。
2.5 血浆样品处理检测时,将血浆样品从−80 ℃冰箱中取出后,室温放置融化,取500 μL血浆,加入50 μL内标乙氧苯柳胺(20 ng/mL)、10 μL甲醇、3 mL甲基叔丁基醚,涡旋2 min,4 ℃、12 000 r/min离心5 min;取上清液2.4 mL于玻璃管中,37 ℃ N2吹干,加入100 μL复溶液(甲醇-水-甲酸5∶3∶2)复溶,涡旋混匀1 min,取样本于内插管中,4 ℃、12 000 r/min离心5 min,取上清液10 μL进样,进行LC-MS/MS定量分析。
2.6 数据处理应用Analyst 1.5.2数据处理软件,对待测物延胡索乙素、欧前胡素和内标乙氧苯柳胺进行积分,记录峰面积。以待测物质量浓度为横坐标(X),待测物与内标物的峰面积比值为纵坐标(Y),用加权最小二乘法(权重为1/x2)进行回归运算,求得的直线回归方程即为校正曲线。以WinNonlin 6.3软件非房室模型统计矩方法计算药动学参数。
3 结果 3.1 方法学验证本实验根据美国科学促进会(AAPS)指导原则进行分析方法学验证[23],验证的内容包括:专属性、精密度和准确度、线性和定量下限、基质效应、提取回收率、稳定性、稀释效应。
3.1.1 专属性本实验检测犬空白血浆、加入对照品的空白血浆样品、元胡止痛片给药后的血浆样品,结果表明,延胡索乙素、欧前胡素和内标乙氧苯柳胺的保留时间分别为1.60、4.46、4.41 min。空白基质对延胡索乙素、欧前胡素以及内标的测定无干扰,色谱图见图 1。
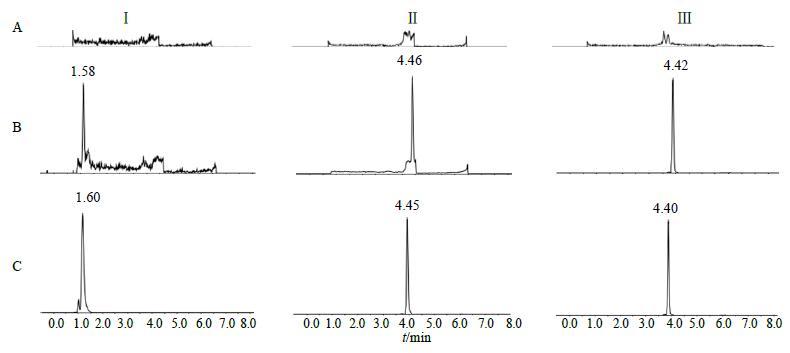
|
图 1 方法学专属性色谱图 Fig.1 Specific chromatograms of methodology |
3.1.2 线性范围及定量下限
取500 μL犬空白血浆,加入10 μL混合对照品系列工作液,得到犬血浆校正曲线,采用“2.5”项下的方法进行样品处理,进行LC-MS/MS分析,记录延胡索乙素、欧前胡素及内标的峰面积。根据“2.6”项下的方法进行数据处理,最低浓度点的准确度在80%~120%,其余6个浓度点的校正标样的准确度均在85%~115%。典型校正曲线得到回归方程为延胡索乙素:Y=0.006 08 X+0.000 057 2,r=0.995 4,线性范围为0.05~20 ng/mL;欧前胡素:Y=0.489X+0.000 648,r=0.998 4,线性范围0.005~2 ng/mL。延胡索乙素和欧前胡素的定量下限分别为0.05 ng/mL和0.005 ng/mL,两者的相对误差(RE)在−3.33%~−1.13%,精密度RSD均小于14%。
3.1.3 准确度和精密度配制高、中、低质量浓度(延胡索乙素质量浓度分别为16.0、2.0、0.1 ng/mL和欧前胡素质量浓度分别为1.6.0、0.20、0.01 ng/mL)水平的系列质控混合工作液,采用“2.5”项下的方法进行生物样品处理,进行LC-MS/MS分析,每个质量浓度6个样本,连续进行3个批次的样本分析。应用当日校正曲线计算各质控样品的质量浓度,考察分析方法的准确度和精密度,结果见表 1。犬血浆中延胡索乙素各质量浓度水平质控样品的RE在−7.19%~4.00%,批内精密度RSD在4.67%~8.67%,批间精密度RSD在2.15%~14.4%;犬血浆中欧前胡素各质量浓度水平质控样品的RE在−3.68%~5.89%,批内精密度RSD在4.65%~7.75%,批间精密度RSD在1.68%~5.66%,均符合有关生物样品分析方法验证的要求。准确度和精密度具体结果见表 1。
|
|
表 1 方法精密度、准确度、提取回收率及基质效应结果 (n = 6) Table 1 Results of precision,accuracy,recovery,and matrix effect (n = 6) |
3.1.4 基质效应
使用6批犬空白血浆,低(延胡索乙素0.1 ng/mL、欧前胡素0.01 ng/mL)、中(延胡索乙素2 ng/mL、欧前胡素0.2 ng/mL)、高(延胡索乙素16 ng/mL、欧前胡素1.6 ng/mL)3个质量浓度水平进行基质效应考察。
样品A:40 μL超纯水、25 μL无水甲酸、10 μL质控工作液、50 μL内标乙氧苯柳胺(20 ng/mL)甲醇溶液,涡旋1 min,4 ℃、12 000 r/min离心10 min;取样本于内插管中,4 ℃ 、12 000 r/min离心5 min,进样10 μL,进行LC-MS/MS定量分析记录待测物和内标的色谱峰面积。
样品B:取500 μL犬空白血浆,加入60 μL甲醇和3 mL甲基叔丁基醚,涡旋2 min后,4 ℃、12 000 r/min离心5 min。取2.4 mL上清液至玻璃管,37 ℃水浴中N2流吹干,100 μL上述样品A复溶,涡旋混匀2 min,将样品溶液转移至进样管中,4 ℃、12 000 r/min离心5 min,进样10 μL进行LC-MS/MS分析记录待测物和内标的色谱峰面积。
样品B测得的峰面积与相应质量浓度的样品A测得的峰面积比即为待测物和内标的基质效应。
结果见表 1,表明延胡索乙素在3个质控质量浓度水平下的基质效应为88.2%~104%,RSD为1.53%~5.35%;欧前胡素在3个质控质量浓度水平下的基质效应为96.8%~107%,RSD为1.40%~7.89%;内标乙氧苯柳胺的基质效应为89.8%,基质效应不会对犬血浆中延胡索乙素和欧前胡素的分析产生明显影响。
3.1.5 提取回收率使用低(延胡索乙素0.1 ng/mL、欧前胡素0.01 ng/mL)、中(延胡索乙素2 ng/mL、欧前胡素0.2 ng/mL)、高(延胡索乙素16 ng/mL;欧前胡素1.6 ng/mL)3个质量浓度水平进行提取回收率考察,每个质量浓度6个样本。
样品C:取500 μL犬空白血浆,加入10 μL质控工作液,50 μL内标工作液(乙氧苯柳胺20 ng/mL)和3 mL甲基叔丁基醚,涡旋2 min后,4 ℃、12 000 r/min离心5 min。取2.4 mL上清液至玻璃管,37 ℃水浴中N2流吹干,100 μL复溶液(甲醇-水-无水甲酸50∶30∶20)复溶,涡旋混匀2 min,将样品溶液转移至进样管中,4 ℃、12 000 r/min离心5 min,进样10 μL进行LC-MS/MS定量分析记录待测物和内标的色谱峰面积。
样品C测得的峰面积与相应质量浓度的样品B测得的峰面积比即为待测物和内标的提取回收率。
结果见表 1,表明在试验选择的样品处理条件下,待测物延胡索乙素在3个质控质量浓度水平下的提取回收率为98.1%~108%,RSD为4.07%~4.99%;待测物欧前胡素在3个质控质量浓度水平下的提取回收率为84.7%~91.9%,RSD为6.77%~9.95%,内标乙氧苯柳胺的提取回收率为82.8%。
3.1.6 稳定性该实验分别考察了室温放置4 h,进样器放置48 h,−80 ℃冻存3周以及冻融循环3次的条件下,延胡索乙素和欧前胡素在犬血浆中的稳定性。由表 2可以看出,2个质控质量浓度水平的延胡索乙素和欧前胡素RSD均不大于8.76%,因此犬血浆中的延胡索乙素和欧前胡素在分析过程中稳定。
|
|
表 2 稳定性结果 (n= 6) Table 2 Results of stability (n = 6) |
3.1.7 稀释效应
为考察犬血浆药物浓度超出曲线范围的样品测定准确度,制备延胡索乙素质量浓度为160 ng/mL和欧前胡素质量浓度为16 ng/mL的混合生物样品,用空白犬血浆稀释10倍后进行测定,考察稀释效应。稀释10倍后测定结果乘以稀释倍数所得计算值,与标识质量浓度相比的延胡索乙素的RE为9.06%,RSD为3.22%;欧前胡素的RE为4.79%,RSD为2.81%。表明对犬血浆样品进行稀释后分析,经校正计算后的结果能够准确反映超出曲线范围的药物质量浓度。
3.2 药动学研究本实验验证了同时测定犬血浆中的延胡索乙素和欧前胡素的LC-MS/MS方法。6只成年健康Beagle犬,以18片/犬的剂量po给药后,按“2.4”项下方式采集样品,按“2.5”项下方式进行样品处理,测定血浆中的延胡索乙素和欧前胡素的质量浓度,药时曲线如图 2所示。Beagle犬经po给药元胡止痛片后,与体内暴露量密切相关的及与消除过程密切相关的药动学参数如表 3所示。延胡索乙素在Beagle犬体内的tmax为1.08 h,Cmax为48.70 ng/mL,AUC0~t为170.00 h·ng/mL,t1/2为7.71 h;欧前胡素在犬体内的tmax为1.17 h,Cmax为0.063 4 ng/mL,AUC0~t为0.176 0 h·ng/mL,t1/2为2.390 h。
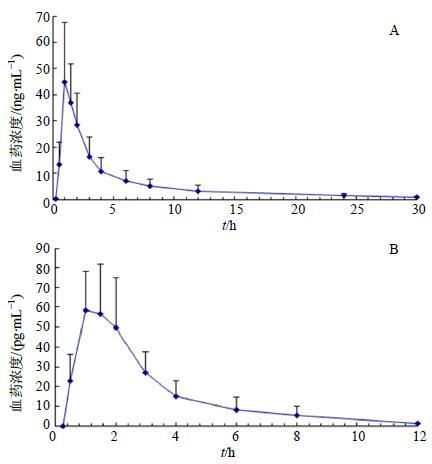
|
图 2 犬口服元胡止痛片后血浆中延胡索乙素 (A) 和欧前胡素 (B) 的药物浓度-时间曲线 (x±s,n = 6) Fig.2 Mean plasma concentration-time curves of tetrahydropalmatine (A) and imperatorin (B) after ig administration of YTZ to dogs (x±s,n = 6) |
|
|
表 3 犬口服给药元胡止痛片后延胡索乙素和欧前胡素的主要药动学参数 (x±s,n = 6) Table 3 Main pharmacokinetic parameters of tetrahydropalmatine and imperatorin after ig administration of YTZ to dogs (x±s,n = 6) |
4 讨论
本实验考察了向水相中加入甲酸铵、乙酸铵及甲酸后对延胡索乙素、欧前胡素及内标乙氧苯柳胺色谱行为的影响,结果发现加入甲酸后,分析物的峰形得以改善,同时可以增强分析物响应,提高灵敏度。进一步考察了向水相中加入不同体积分数的甲酸。最终选择0.1%的甲酸水溶液作为水相。另外为避免基质效应及改善峰形,采用梯度洗脱方式。
沉淀蛋白、液液萃取及固相萃取都是样品处理的常用手段。实验采用甲醇沉淀犬血浆时发现有严重的基质效应且灵敏度很低。改用液液萃取方式后,分别考察了醋酸乙酯、二氯甲烷、乙醚及甲基叔丁基醚作为提取剂,发现醋酸乙酯提取后基质效应较高,而一步的甲基叔丁基醚萃取可以很好地克服上述问题,提取回收率较高且无明显基质效应。且液液萃取方式成本低,样品处理过程简单,适合大批量生物样品分析,因此实验采用甲基叔丁基醚萃取的方式进行样品处理。
在研究中,建立的LC-MS/MS方法灵敏度高、专属性好,延胡索乙素在0.05~20 ng/mL线性良好,欧前胡素在0.005~2 ng/mL线性良好,延胡索乙素和欧前胡素的定量下限分别为0.05 ng/mL和0.005 ng/mL,批内和批间精密度均小于14.4%,准确度均在-7.19%~5.89%,提取回收率在82.8%~108%,基质效应在88.2%~107%;且仅用一步液液萃取方式进行样品处理,处理方式简单,可行性高。经验证,该方法可用于同时测定犬血浆中的延胡索乙素和欧前胡素,并应用于口服给药元胡止痛片后Beagle犬的药动学研究。
结果显示,元胡止痛片给药后,犬体内延胡索乙素的tmax为1.08 h,Cmax为48.70 ng/mL,AUC0~t为170.00 h·ng/mL,t1/2为7.71 h,与文献报道的元胡止痛分散片在犬体内的药动学研究[24]相比,吸收相对较慢,但t1/2较长,在体内的清除过程较为缓慢;换算成与本研究相同的给药剂量,发现元胡止痛分散片给药后延胡索乙素在体内的暴露量远远大于元胡止痛片。由此可以看出,不同剂型的元胡止痛复方制剂在体内的暴露行为具有较大的差异,因此该方法的建立对于研发和筛选更为有效的元胡止痛复方制剂的剂型具有十分重要的意义。
有研究表明,欧前胡素配伍延胡索总碱ig给予大鼠,发现欧前胡素能够提高延胡索乙素在大鼠血浆中的量[25],且延胡索乙素与白芷香豆素总挥发油配伍时对大鼠醋酸扭体法等的镇痛作用均优于延胡索乙素单用[26],因此,该方法的建立对于延胡索乙素、欧前胡素以及其联合用药的药动学研究,并阐明其发挥药理作用的作用机制具有重要的意义。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | Chang K W, Tsai T Y, Chen K C, et al. iSMART:an integrated cloud computing web server for traditional Chinese medicine for online virtual screening, de novo evolution and drug design[J]. J Biomol Struct Dyn , 2011, 29 (1) :243–250. |
| [3] | Zhang Y, Xu H, Chen X, et al. Simultaneous quantification of 17 constituents from Yuanhu Zhitong Tablet using rapid resolution liquid chromatography coupled with a triple quadrupole electrospray tandem mass spectrometry[J]. J Pharm Biomed Anal , 2011, 56 (3) :497–504. |
| [4] | Chen Y F, Tsai H Y, Wu T S. Anti-inflammatory and analgesic activities from roots of Angelica pubescens[J]. Planta Med , 1995, 61 (1) :2–8. |
| [5] | Hiller K O, Ghorbani M, Schilcher H. Antispasmodic and relaxant activity of chelidonine, protopine, coptisine, and Chelidonium majus extracts on isolated guinea-pig ileum[J]. Planta Med , 1998, 64 (8) :758–760. |
| [6] | Leung W C, Zheng H, Huen M, et al. Anxiolytic-like action of orally administered dl-tetrahydropalmatine in elevated plus-maze[J]. Prog Neuropsychopharmacol Biol Psych , 2003, 27 (5) :775–779. |
| [7] | Yuan C S, Mehendale S R, Wang C Z, et al. Effects of Corydalis yanhusuo and Angelicae dahuricae on cold pressor-induced pain in humans:a controlled trial[J]. J Clin Pharmacol , 2004, 44 (11) :1323–1327. |
| [8] | Zhang Y C, Xu H Y, Chen X M, et al. Study on the application of intestinal absorption in vitro coupled with bioactivity assessment in Yuanhu Zhitong preparation[J]. J Med Plants Res , 2012 (10) :1941–1947. |
| [9] | 吴雪松, 许浚, 张喜民, 等. 元胡止痛方的化学成分及药理作用研究进展[J]. 中草药 , 2015, 46 (7) :1081–1095. |
| [10] | 杜兴旭, 王春梅, 秦晶, 等. 中药白芷香豆素类成分的研究进展[J]. 井冈山医专学报 , 2005, 26 (2) :120–122. |
| [11] | Hong J, Shin K H, Lim S S, et al. Lead compounds for anti-inflammatory drugs isolated from the plants of the traditional oriental medicine in Korea[J]. Inflamm Allergy Drug Targ , 2008, 7 (3) :195–202. |
| [12] | 吴媛媛, 蒋桂华, 马逾英, 等. 白芷的药理作用研究进展[J]. 时珍国医国药 , 2009, 20 (3) :625–627. |
| [13] | 刘雪赟. 延胡索乙素大鼠体内药动学研究[J]. 南京中医药大学学报 , 2012, 28 (6) :555–557. |
| [14] | 冯彬彬, 张建海, 徐晓玉. 川芎嗪、阿魏酸对延胡索乙素大鼠体内药动学的影响[J]. 中草药 , 2014, 45 (18) :2664–2668. |
| [15] | Ceremuga T E, Shellabarger P, Persson T, et al. Effects of tetrahydropalmatine on post-traumatic stress disorderinduced changes in rat brain gene expression[J]. J Integr Neurosci , 2013, 12 (4) :513–528. |
| [16] | Wang S, Chen Q, Wang L, et al. Development and validation of a gas chromatography-mass spectrometry method for the determination of imperatorin in rat plasma and tissue:application to study its pharmacokinetics[J]. Anal Sci , 2009, 25 (7) :869–873. |
| [17] | 郑辉. 欧前胡素和异欧前胡素在大鼠体内药物代谢动力学研究[D]. 泰安:泰山医学院, 2009. |
| [18] | 张笑恺, 曹蔚, 谢艳华, 等. 欧前胡素在大鼠体内的药动学与组织分布研究[J]. 中国药房 , 2013, 24 (3) :216–219. |
| [19] | Gao Y, Hu S, Zhang M, et al. Simultaneous determination of four alkaloids in mice plasma and brain by LC-MS/MS for pharmacokinetic studies after administration of Corydalis Rhizoma and Yuanhu Zhitong extracts[J]. J Pharm Biomed Anal , 2014, 92 :6–12. |
| [20] | Tao Y, Xu H, Wang S, et al. Identification of the absorbed constituents after oral administration of Yuanhu Zhitong prescription extract and its pharmacokinetic study by rapid resolution liquid chromatography/quadrupole time-of-flight[J]. J Chromatogr B Analyt Technol Biomed Life Sci , 2013, 935 :1–9. |
| [21] | 丁光超, 叶肖栗, 任国飞. 高效液相色谱串联质谱法测定大鼠血浆中的欧前胡素[J]. 药物分析杂志 , 2008, 28 (7) :1056–1059. |
| [22] | 杨静, 马斐, 李海霞, 等. 元胡止痛片中延胡索乙素和欧前胡素的含量测定[J]. 中国药师 , 2014, 17 (9) :1512–1514. |
| [23] | Whitmire M L, Bryan P, Henry T R, et al. Nonclinical dose formulation analysis method validation and sample analysis[J]. AAPS J , 2010, 12 (4) :628–634. |
| [24] | 黄欣, 苏乐群, 孙付军, 等. 元胡止痛分散片的家犬体内药动学研究[J]. 中国现代应用药学 , 2008, 25 (1) :45–47. |
| [25] | 梁新丽, 廖正根, 王光发, 等. 白芷提取物与延胡索总碱配伍对延胡索乙素在大鼠体内药代动力学的影响[J]. 药学学报 , 2009, 44 (6) :645–650. |
| [26] | 杨倩, 王四旺. 延胡索乙素与白芷总香豆素、总挥发油配伍药效学比较研究[J]. 现代生物医学进展 , 2009, 9 (15) :2814–2816. |
 2016, Vol. 47
2016, Vol. 47


