2. 安徽中医药大学第一附属医院, 国家中医药管理局中药制剂三级实验室, 安徽 合肥 230031
2. Grade 3 Laboratory of Traditional Chinese Medicine Preparation, State Administration of TCM, The First Affiliated Hospital of Anhui University of Traditional Chinese Medicine, Hefei 230031, China
苍耳子为菊科植物苍耳Xanthium sibiricum Patr. 的干燥成熟带总苞的果实,具有散风除湿、通鼻窍的功能[1]。研究发现苍耳子中含有大量的酚酸类化合物,包括绿原酸、新绿原酸、咖啡酸和多种咖啡酰奎宁酸类等[2-3],此类化学成分被证实是苍耳子发挥临床疗效的重要活性成分,具有良好的抗菌、抗病毒和镇痛作用等生物活性[4-5];而苍耳子中的水溶性苷类成分,包括羧基苍术苷、苍术苷等具有一定毒性,是其主要的毒性成分[6]。苍耳子生品有毒,经炮制后,可降低毒性[7-8]。
生苍耳子表面密被硬刺,易相互粘连,传统的碾法去刺较复杂,且除刺效率较低。《中国药典》2015版中记载苍耳子的炮制方法为清炒法,炒后去刺。清炒法的主要目的是降低毒性,并易去刺和洁净药物。而目前市售的苍耳子多采用机械去刺,方法简单,高效。因此,对于传统清炒后去刺的炮制工艺有待进行改进。将清炒法改为砂炒法炮制去刺后的苍耳子药材,可克服清炒法炮制的不足。砂炒法以砂为传热媒介,增大了药材的受热面积且使其受热均匀,炮制的药材色泽均一,质地疏松,使其有效成分易于溶出,毒性成分变性达到增效减毒的目的[9]。砂炒法炮制苍耳子虽具有较明显的优点,但其具体工艺及合理性目前报道还较少,本实验从活性成分和毒性成分的量及特征指纹图谱等角度,对传统清炒法、控温砂炒法和随机温度砂炒法进行比较,探讨了砂炒法炮制工艺的可行性,为苍耳子炮制工艺改进的合理性提供实验依据。
1 仪器与材料Waters Acquity UPLC H-Class超高效液相色谱系统,美国Waters公司;KQ3200DB型超声清洗器,江苏昆山超声仪器有限公司;XFB-200型高速中药粉碎机,吉首市中州制药机械厂;BP211D型电子天平,德国Sartorius公司。
对照品绿原酸(批号110753-200413,质量分数99.39%)、咖啡酸(批号110885-200102,质量分数98.00%)购自中国食品药品检定研究院;对照品3,5-二咖啡酰奎宁酸(批号12101101,质量分数99.2%)、4,5-二咖啡酰奎宁酸(批号11081803,质量分数98.40%)、隐绿原酸(批号11112203,质量分数99.00%)和新绿原酸(批号11112202,质量分数99.00%)均购自成都曼斯特化工有限公司;羧基苍术苷和苍术苷对照品,自制,经IR、UV、1H-NMR、13C-NMR和MS等光谱检测确认其结构;按归一化法测得其质量分数均≥98%。
去刺的苍耳子药材购于安徽省药材公司,产地为河南,经安徽中医药大学药学部李立华主任中药师鉴定为菊科苍耳属植物苍耳Xanthium sibiricum Patr. 的干燥成熟带总苞的果实。色谱纯甲醇、乙腈购自Sigma公司;其他试剂均为分析纯。
2 方法与结果 2.1 苍耳子炮制品的制备苍耳子生品1份,以传统清炒法、控温砂炒法及不控温砂炒法分别制备炮制品,每种炮制品每份50 g,每种6份,共有19份样品。(1)生苍耳子(S0):取大小均匀的原药材,机械去刺,除去杂质,洗净,50 ℃真空干燥。(2)清炒苍耳子(S1~S6):按《中国药典》2015年版(四部)0213炮制通则(清炒法),取苍耳子置炒制容器内,用文火炒至终点颜色(药材表面呈黄褐色为标准)时,取出,放凉。(3)控温砂炒苍耳子(砂炒1;S7~S12):按《中国药典》2015年版(四部)0213炮制通则(砂炒法),取洁净河砂置炒制容器内,用武火加至滑利状态,测定离锅底1 cm左右处的温度,设定为炒制温度为160 ℃,投入苍耳子不断翻动,炒至终点颜色时,取出,去砂,放凉。(4)随机温度砂炒苍耳子(砂炒2;S13~S18):取洁净河砂置炒制容器内,用武火加至滑利状态时,投入苍耳子不断翻动,炒至终点颜色时,取出,筛去砂,放凉。
2.2 苍耳子炮制品的UPLC定量测定 2.2.1 色谱条件色谱柱为Waters Acquity UPLC BEH C18柱(100 mm×2.1 mm,1.7 μm);流动相为乙腈-0.1%磷酸水溶液,梯度洗脱:0~1 min,3%乙腈;1~2.5 min,3%~5%乙腈;2.5~9 min,5%~15%乙腈;9~9.5 min,15%~18%乙腈;9.5~16 min,18%乙腈;16~16.5 min,18%~28%乙腈;16.5~19 min,28%乙腈;19~21 min,28%~50%乙腈;21~22 min,50%乙腈;22~25 min,3%乙腈;体积流量1.0 mL/min;柱温25 ℃;检测波长327 nm。
2.2.2 对照品溶液的制备精密称定新绿原酸2.88 mg、绿原酸5.09 mg、隐绿原酸2.99 mg、咖啡酸3.06 mg、3,5-二咖啡酰奎宁酸2.99 mg和4,5-二咖啡酰奎宁酸2.91 mg,置于10 mL棕色量瓶中,加入甲醇定容至刻度,摇匀。再依次精密称定上述对照品溶液0.25、0.50、0.25、0.10、0.25、0.10 mL,置于5 mL棕色量瓶中,加入甲醇定容至刻度,摇匀,制成含新绿原酸14.4 μg/mL、绿原酸50.9 μg/mL、隐绿原酸14.59 μg/mL、咖啡酸6.12 μg/mL、3,5-二咖啡酰奎宁酸14.95 μg/mL和4, 5-二咖啡酰奎宁酸5.82 μg/mL的混合对照品溶液。
2.2.3 供试品溶液的制备取苍耳子炮制品和生品粉末(过3号筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加水10 mL,称定质量,超声处理(功率300 W,频率40 kHz)40 min,放冷,再称定质量,用水补足减失的质量,摇匀,6 000 r/min离心10 min,取上清液滤过,取续滤液,即得。
2.2.4 标准曲线的制备精密吸取6种酚酸类混合对照品溶液0.5、1、2、3、4、5 μL,注入液相色谱仪中,测定新绿原酸、绿原酸、隐绿原酸、咖啡酸、3,5-二咖啡酰奎宁酸和4,5二咖啡酰奎宁酸的峰面积。以峰面积为纵坐标(Y),6种酚酸混合对照品的进样量为横坐标(X),绘制标准曲线,计算回归方程,结果分别为新绿原酸Y=301 078.964 38 X-23 153.824 66,r=0.999 7,线性范围7.2~72.0 ng;绿原酸Y=846 977.879 45 X-17 306.021 92,r=0.999 1,线性范围25.5~254.5 ng;隐绿原酸Y=518 773.868 49 X-1 618.660 27,r=0.998 6,线性范围7.5~74.8 ng;咖啡酸Y=46 966.898 63 X-4 743.654 79,r=0.999 8,线性范围3.1~30.6 ng;3,5-二咖啡酰奎宁酸Y=324 417.819 18 X- 24 033.032 88,r=0.998 6,线性范围7.5~74.8 ng;4,5-二咖啡酰奎宁酸Y=151 629.320 55 X- 13 570.578 08,r=0.998 6,线性范围0.3~2.9 ng。
2.2.5 精密度试验精密吸取6种酚酸类对照品溶液10 μL,按“2.2.1”项色谱条件重复进样6次,测定峰面积积分值,结果新绿原酸、绿原酸、隐绿原酸、咖啡酸、3,5-二咖啡酰奎宁酸和4,5-二咖啡酰奎宁酸的峰面积的RSD分别为1.14%、0.89%、0.97%、0.70%、0.99%、0.55%。
2.2.6 稳定性试验取苍耳子(S5)供试品溶液6份(4 ℃低温避光下保存),按照“2.2.3”项方法进行提取,采用“2.2.1”项色谱条件,在0、4、8、12、24 h进样10 μL,测定各成分峰面积,结果新绿原酸、绿原酸、隐绿原酸、咖啡酸、3,5-二咖啡酰奎宁酸和4,5-二咖啡酰奎宁酸峰面积的RSD分别为1.32%、1.99%、2.14%、1.64%、1.93%、2.06%。
2.2.7 重复性试验取同一批苍耳子药材(S5)样品6份,按“2.2.3”项下供试品溶液制备方法操作,采用上述色谱条件分别进样10 μL,由标准曲线求出各成分量,结果新绿原酸、绿原酸、隐绿原酸、咖啡酸、3,5-二咖啡酰奎宁酸和4,5-二咖啡酰奎宁酸质量分数的RSD分别为2.17%、2.05%、1.98%、1.58%、2.81%、2.56%。
2.2.8 加样回收率试验称取S5样品0.2 g,精密称定,共6份,分别置10 mL量瓶中,加入各对照品溶液适量,按“2.2.3”项下方法制备供试品溶液,按“2.2.1”项下色谱条件测定,计算得新绿原酸、绿原酸、隐绿原酸、咖啡酸、3,5-二咖啡酰奎宁酸和4,5二咖啡酰奎宁酸的平均回收率分别为97.78%、99.47%、98.39%、98.49%、97.65%、96.87%,RSD分别为2.01%、3.23%、2.75%、2.81%、1.75%、1.48%。
2.2.9 样品测定分别称取苍耳子生品及炮制品粉末(过50目筛)0.3 g,精密称定,按照“2.2.3”项下方法进行供试品溶液的制备,采用“2.2.1”项色谱条件测定新绿原酸、绿原酸、隐绿原酸、咖啡酸、3,5-二咖啡酰奎宁酸和4,5-二咖啡酰奎宁酸6种酚酸的量。实验结果(表 1)表明苍耳子经炮制后,6种酚酸类成分的量较高,且控温砂炒苍耳子(砂炒1)中各酚酸类成分总量最高。
|
|
表 1 苍耳子炮制品和生品的定量测定和指纹图谱相似度 Table 1 Quatitative determination and similarity of processed and raw Xanthii Fructus |
2.3 羧基苍术苷和苍术苷的定量测定 2.3.1 色谱条件
在前期研究的基础上[10],优选的最佳色谱条件为Aglient CT-C18色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.01 mol/L磷酸二氢钠水溶液(4%氢氧化钠调pH值6,62∶38),检测波长203 nm;体积流量0.8 mL/min;进样体积5 μL;柱温30 ℃。
2.3.2 对照品溶液的制备精密称定羧基苍术苷6.22 mg和苍术苷5.73 mg,置于10 mL棕色量瓶中,加入甲醇定容至刻度,摇匀。再精密称定上述对照品溶液各1 mL,置于5 mL棕色量瓶中,加入甲醇定容至刻度,摇匀,制成含羧基苍术苷124.4 μg/mL、苍术苷114.6 μg/mL的对照品溶液。
2.3.3 供试品溶液的制备方法同“2.2.3”项方法。
2.3.4 定量测定按“2.2.3”项下方法制备各供试品溶液,按“2.3.1”项下色谱条件,分别精密吸取对照品溶液和供试品溶液,自动进样器进样,计算各样品中羧基苍术苷与苍术苷的量,结果见表 1,研究结果表明,苍耳子生品中羧基苍术苷的量较高,炮制后各样品羧基苍术苷的量降低,苍术苷的量较高,且改进后的控温砂炒苍耳子(砂炒1)中各成分量最低,说明炮制后,苍耳子毒性成分羧基苍术苷可能部分转化为苍术苷;也可能被温度破坏,说明炮制后,可降低毒性成分,为苍耳子炮制工艺改进提供了实验依据。
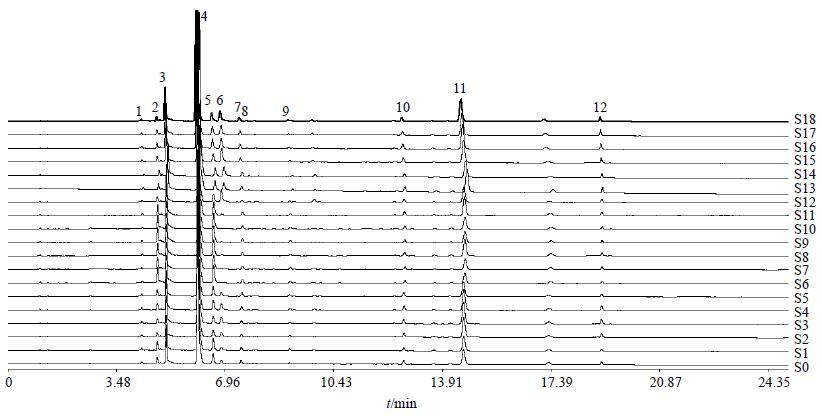
2.4 指纹图谱分析 2.4.1 苍耳子指纹图谱的测定及特征峰指认精密吸取苍耳子炮制样品和生品溶液,按“2.2.1”项下色谱条件进样,测定样品的指纹图谱。采用中国药典委员会颁布的《中药色谱指纹图谱相似度评价系统软件》(2004年版A)处理图谱,生成混合对照品、苍耳子生品和炮制品的共有模式的UPLC色谱图,见图 1,结果表明,共匹配了13个色谱峰,通过对照保留时间,指认了其中的6个峰,分别为2号峰(新绿原酸)、4号峰(绿原酸)、5号峰(隐绿原酸)、6号峰(咖啡酸)、11号峰(3,5-二咖啡酰奎宁酸)、12号峰(4,5-二咖啡酰奎宁酸)。

|
图 1 混合对照品 (A)、苍耳子生品 (B)、砂炒1 (C)、砂炒2 (D) 和清炒 (E) 的共有模式的UPLC图 Fig.1 UPLC of mixed reference substances (A),raw (B),sand fried 1 (C),sand fried 2 (D),and stir-fried (E) processed Xanthii Fructus |
2.4.2 UPLC特征指纹图谱的建立和相似度分析
将19个苍耳子炮制品和生品实验数据导入色谱指纹图谱系统软件,经选峰,设定匹配模式,将谱峰自动匹配,以S1号样品图谱作为参照谱进行指纹匹配,对各样品色谱图的原始数据进行分析,确定了13个共有峰,并进行了相似度计算,见图 2和表 1。相似度计算结果表明19个苍耳子样品指纹图谱的相似度均大于0.98,相似度良好,说明炮制品内在成分与对照指纹图谱整体相似。因此,19个苍耳子炮制品和生品生成的共有模式指纹图谱可作为苍耳子的特征指纹图谱。
|
图 2 苍耳子炮制品和生品的UPLC特征指纹图谱 Fig.2 UPLC fingerprint of processed and raw Xanthii Fructus |
2.4.3 样品的聚类分析
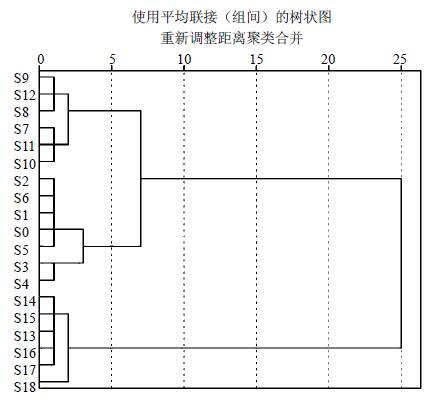
为了更直观地、准确地比较苍耳子不同炮制工艺的差异性,以每个炮制样品特征峰的峰面积为指标,采用SPSS 19.0软件,进行聚类分析研究,结果见图 3,19个苍耳子样品大致可聚为4大类,I类砂炒苍耳子1,包括S9、S12和S8,质量最好;II类砂炒苍耳子1,包括S7、S11和S10,质量较好;III类清炒和生品,包括S2、S6、S1、S、S5、S3和S4,质量次之;IV类砂炒2,包括S14、S15、S13、S16、S17和S18,与前3类样品差异较大,质量最差。以13个共有峰峰面积为指标的聚类分析结果与指纹图谱和相似度分析后的总体趋势一致,因此,本研究可以推测不同炮制工艺苍耳子的比较中,改进的控温砂炒苍耳子(砂炒1)炮制工艺稳定,可靠,重现性好。
|
图 3 苍耳子炮制品和生品的聚类分析 Fig.3 Hierarchical cluster analysis of processed and raw Xanthii Fructus |
2.4.4 样品的偏最小二乘法-判别分析(PLS-DA)
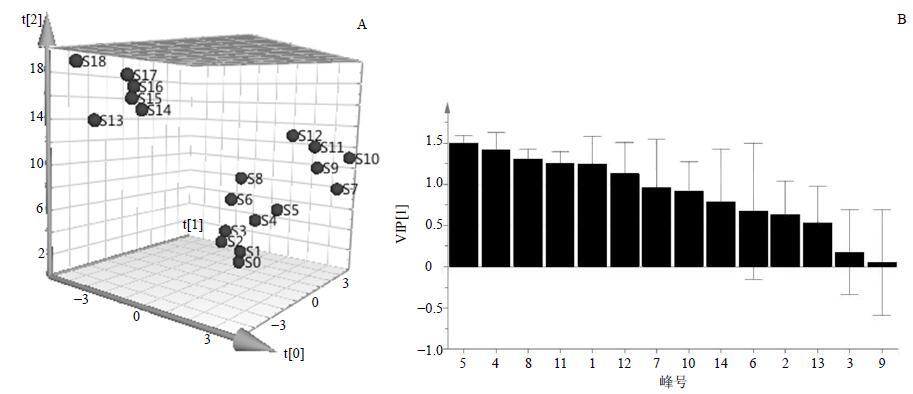
PLS-DA是一种多因变量对多自变量的回归建模方法。采用SPSS 19.0软件对19个炮制样品和生品的峰面积数据进行归一化后,导入SIMCA 13.0软件,建立PLS-DA数学模型,见图 4-A。PLS-DA得分图,可将样品清晰地分为4类。砂炒苍耳子1中各成分量最高,与相似度、聚类分析分析方法的结果基本一致。PLS-DA分析反映各炮制品和生品间的差异,且19个样品进行预测,模型建立稳定、可靠。VIP得分图(图 4-B)显示,色谱峰变量对样品分类影响大小排序为峰5>峰4>峰8>峰11>峰1>峰12>峰7>峰10>峰14>峰6>峰2>峰13>峰3>峰9;其中VIP值>1.0的色谱峰共有8个,分别是峰5、峰4、峰8、峰11、峰1、峰12、峰7、峰10,说明这8个成分的色谱峰对分类具有显著性的差异。
|
图 4 苍耳子炮制品和生品的PLS-DA得分图 (A) 和VIP得分图 (B) Fig.4 PLS-DA scores plot (A) and VIP plot (B) of processed and raw Xanthii Fructus |
3 讨论
《本草纲目》中,苍耳子有“入药炒熟,去刺用”的记载。苍耳子机械去刺方法简单,且去刺后便于运输和炮制,目前市售的生品苍耳子多已去刺。鉴于上述情况,本实验考虑对其炮制工艺适当改进,即对去刺后的苍耳子,以砂炒法进行炮制。以河沙为加热介质,传热速度快,河沙颗粒小可充分包裹药材,使其表面受热均匀,且砂炒后几乎无破裂现象,保证了药材的外观质量。因此,炒砂法较清炒法具有较明显的优势。
近年对苍耳子炮制的研究主要集中在降低毒性和增强疗效等方面[11],酚酸类成分的定量测定测定易受光线和温度等影响,因此要严格控制实验条件。课题组前期对苍耳子砂炒的温度和时间进行考察[12],确定了苍耳子炮制的最佳砂炒法工艺,炮制温度为160 ℃,炮制时间7 min左右。此工艺炮制品的酚酸类成分的含量较高,故本实验选择其作为控温砂炒苍耳子(砂炒1)炮制工艺的最佳工艺条件,且炮制后的毒性成分含量较低。
在指纹图谱数据处理中,发现绿原酸的量很高,用相似度法分析时,它的影响很大,容易导致各样品相似度都很高,体现不出炮制品的优劣,而PLS-DA法[13-15]通过对不同组分量的变化分析,能够清晰、准确的将不同工艺的炮制样品分组。本实验选择采用有监督的PLS-DA方法,能使不同炮制样品组完全分开,体现其质量差异。
实验在课题组前期研究和文献基础上[16],对色谱条件、样品处理方法等均进行了优化,建立的实验方法稳定、可行。实验建立了不同炮制工艺指纹图谱,采用了相似度评价、聚类分析、PLS-DA等分析方法,结合活性成分和毒性成分的量变化,对其炮制工艺进行了比较,研究结果表明改进后的控温砂炒苍耳子(砂炒1)较传统工艺活性成分量高且毒性成分含量较低,能达到传统鉴定的外观质量标准;实验建立的含量测定、指纹图谱分析方法稳定、可靠,重现性好。实验结果表明,改用砂炒法炮制苍耳子具有一定的可行性,但能否最终代替清炒法仍需要药效、毒理学方面进一步的实验验证。
| [1] | 崔秀荣, 马海波, 张旗, 等. 苍耳子的化学成分和临床应用研究进展[J]. 现代药物与临床 , 2012, 27 (6) :614–618. |
| [2] | 韩婷, 李慧梁, 胡国, 等. 苍耳子中酚酸类化合物及不同品种和居群苍耳子中总酚酸含量的测定[J]. 中国中医药信息杂志 , 2006, 4 (2) :194–198. |
| [3] | 陈洁, 王瑞, 师彦平. 苍耳子的化学成分研究[J]. 中草药 , 2013, 44 (13) :1717–1720. |
| [4] | 杨柳, 苏芝军, 许舜军, 等. UPLC法同时测定苍耳子中4种酚酸类成分的含量[J]. 药学学报 , 2010, 45 (12) :1537–1540. |
| [5] | Han T, Zhang Q Y, Zhang H, et al. Authentication and quantitative analysis on the chemical profile of Xanthium fruit (Cang-Er-Zi) by high-performance liquid chromatography-diode-array detection tandem mass spectrometry method[J]. Anal Chim Acta , 2009, 634 (2) :272–278. |
| [6] | Obatomi D K, Thanh N T, Brant S, et al. The toxic mechanism and metabolic effects of atractyloside in precision-cut pig kidney and liver slices[J]. Arch Toxicol , 1998, 72 (8) :524–530. |
| [7] | 金传山, 吴德林, 张京生. 不同炮制方法对苍耳子成分及药效的影响[J]. 安徽中医学院学报 , 2000, 19 (1) :54–56. |
| [8] | Huang M H, Wang B S, Chiu C S, et al. Antioxidant, antinociceptive, and anti-inflammatory activities of Xanthii Fructus extract[J]. J Ethnopharmacol , 2011, 135 (2) :545–552. |
| [9] | 刘树民, 曹敏, 武斌, 等. 基于UPLC-TOF/MS的苍耳子不同部位化学成分研究[J]. 中药材 , 2013, 36 (6) :924–929. |
| [10] | 韩燕全, 洪燕, 夏伦祝, 等. UPLC指纹图谱技术结合毒性成分含量优选苍耳子的炮制工艺[J]. 中国中药杂志 , 2014, 39 (7) :1248–1254. |
| [11] | 安靖, 王耀登, 盛昌翠, 等. 苍耳子炮制前后羧基苍术苷和苍术苷的含量比较[J]. 药物分析杂志 , 2013, 33 (11) :1910–1913. |
| [12] | 洪燕, 韩燕全, 夏伦祝, 等. 不同炮制时间和温度对苍耳子中2种酚酸含量的影响[J]. 中国中医药信息杂志 , 2014, 21 (4) :82–85. |
| [13] | Yang L, Su Z, Zeng X, et al. Quality assessment of Fructus xanthii based on fingerprinting using high-performance liquidchromatography[J]. JAOA CInt , 2012, 95 (4) :1053–1058. |
| [14] | 李瑞煜, 张定堃, 韩雪, 等. 基于代谢组学方法的制附片煎煮过程成分变化规律及煎煮时限探讨[J]. 中草药 , 2016, 47 (1) :38–45. |
| [15] | 李娟, 张松, 秦雪梅, 等. 基于NMR代谢组学技术的款冬花生品与蜜炙品化学成分比较[J]. 中草药 , 2015, 46 (20) :3009–3016. |
| [16] | 李钰馨, 韩燕全, 洪燕, 等. 多指标正交试验优选炮苍耳子中酚酸类成分的提取工艺[J]. 安徽中医药大学学报 , 2015, 34 (4) :82–85. |
 2016, Vol. 47
2016, Vol. 47


