2. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001 ;
3. 中药提取精制新技术重点研究室, 江苏 连云港 222001
2. State Key Laboratory of Pharmaceutical Process New-teach for Chinese Medicine, Lianyungang 222001, China ;
3. The Key Laboratory for the New Technique Research of TCM Extraction and Purification, Lianyungang 222001, China
金黄油膏(Jinhuang Ointment)是苏州市中医院骨伤科的协定处方,由赤芍、天花粉等5味中药组成,临床用于软组织损伤、骨折早期及骨性关节炎等病症,尤其对热性肿痛效果良好[1]。但原制剂为油膏,处方药味均以细粉入药,存在药物释放不完全、质量可控性差、使用不便等缺点。与之相比,凝胶剂作为一种新型的外用制剂,具有载药量大、生物相容性好、使用方便、舒适等多种优点。因此,为了有效解决金黄油膏临床应用的顺应性,克服其剂型上的不足,拟将其开发为金黄凝胶(Jinhuang Gel)6类新药[1-2]。
但剂型改变后的金黄凝胶能否增加药物成分的透皮吸收效果尚不清楚,而常用的中药经皮给药制剂体外透皮吸收研究方法,常常只能选择单个或几个药物成分作为指标,并不能代表中药经皮给药制剂整体药物成分的透皮规律[3-6]。本研究采用主成分分析(PCA)法对金黄凝胶经皮给药的整体药物组分的HPLC指纹图谱进行综合评价,克服了由单个或几个药物成分作为评价指标研究透皮规律的缺陷,并在PCA揭示出各共有药物组分峰面积表现出相似的体外透皮吸收规律的基础上,以金黄凝胶中透皮吸收效果较好的芍药苷色谱峰为代表,对累积透过量、透皮速率及皮肤滞留量等指标进行考察。
1 仪器与材料Agilent 1200高效液相色谱仪,美国安捷伦科技有限公司;TPY-2智能透皮扩散试验仪,上海黄海药检仪器有限公司;BS124S Sartorius电子天平,北京赛多利斯科学仪器有限公司;GL-16型离心机,上海安亭科学仪器厂。金黄凝胶,批号20150101,每克金黄凝胶含芍药苷0.89 mg,相当于生药0.23 g,江苏康缘药业股份有限公司研制;金黄油膏(对照药物),批号20130510,相当于生药0.23 g,苏州市中医院院内制剂;空白凝胶(空白组),批号20150101,江苏康缘药业股份有限公司;芍药苷对照品,质量分数94.9%,批号110736-201337,中国食品药品检定研究院;实验所用试剂甲醇与乙腈为色谱纯,磷酸为分析纯,纯化水(自制)。
SD大鼠10只,购于浙江省实验动物中心,雄性,体质量150~200 g,生产许可证号SCXK(浙)2014-0001,质量合格证号0016661。
2 方法与结果 2.1 大鼠离体皮肤制备健康大鼠10只,雄性,体质量150~200 g,实验室饲养1周以适应环境。实验前小心剪去背部体毛(注意不要损伤皮肤),然后将大鼠脱颈处死,剥离背部皮肤,将取下的皮肤平铺于玻璃片上,角质层朝下,仔细去除其皮下脂肪及黏连组织,再用生理盐水反复冲洗干净,滤纸吸干表面水分,用锡箔纸包裹后放入冰箱(−20 ℃)冷冻保存,1周内用完。每次实验前仔细检查鼠皮的完整性,有任何破损的皮肤不能用于实验。
2.2 体外透皮吸收实验实验分为实验组(金黄凝胶,n=9)、对照组(金黄油膏,n=9)和空白组(空白凝胶,n=3)。实验前从冰箱中取出备用皮肤,室温下自然解冻,并用无菌生理盐水漂洗至无浑浊,滤纸吸干表面水分备用。取约50 mg金黄凝胶(与金黄油膏生药材用量一致),均匀涂于皮肤表面,将大鼠皮肤固定在竖式Franz扩散池(扩散池面积为1.67 cm2,体积为6.5 mL)的上下两室之间,使角质层面向上,用弹簧夹固定,接收池中加满生理盐水作为接收液,恒温(37.0±0.2)℃,磁力搅拌子转速300 r/min。分别于2、4、6、8、10、12、24 h从接收池中取出0.5 mL接收液,并立即补加等量的恒温(37.0±0.2)℃新鲜生理盐水。按上述方法完成对照组与空白组的体外透皮吸收实验。
2.3 接收液与皮肤样品的制备将各时间点吸取的0.5 mL接收液分别置于1.5 mL的离心管中,转速12 000 r/min离心10 min,取上清液至高效液相样品瓶中;将实验结束后的有效扩散面积大鼠皮肤剪切下来,并剪碎置于玻璃匀浆器中,加入0.5 mL甲醇充分匀浆,匀浆液离心后,取上清液0.2 mL加入装有内插管的高效液相样品瓶中,待测。
2.4 供试品溶液制备称取金黄凝胶4 g置于20 mL量瓶中,加甲醇稀释至刻度,超声处理10 min,转速12 000 r/min离心10 min,取上清液作为供试品溶液。
2.5 HPLC分析方法的建立[7-8] 2.5.1 HPLC条件色谱柱为Agilent SB-C18柱(150 mm×4.6 mm,5 μm),流动相为乙腈-0.1%磷酸水溶液(14∶86),检测波长230 nm,体积流量1.0 mL/min,柱温30 ℃,进样量10 μL。
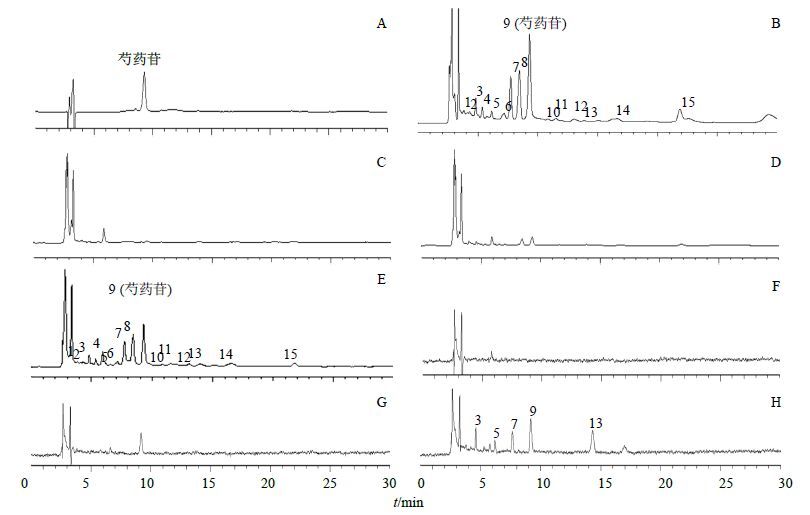
2.5.2 专属性考察空白组与实验组24 h时间点的接收液及实验结束后的皮肤经处理后进样分析,结果表明空白组接收液与空白组皮肤样品的色谱峰均不干扰金黄凝胶有效成分芍药苷的HPLC测定,且能够与金黄凝胶其他药物组分的色谱峰很好地分离,见图 1。
|
图 1 24 h时间点接收液与皮肤滞留样品的HPLC图谱 Fig.1 HPLC of receptive solution and skin retention at 24 h time point |
2.5.3 对照品溶液的配制和标准曲线的建立
精密称取芍药苷对照品4.600 mg,置20 mL量瓶中,加适量甲醇溶解,并稀释至刻度,摇匀,得对照品储备液。精密量取对照品储备液1.00 mL,置25 mL量瓶中,加甲醇至刻度,摇匀,得芍药苷质量浓度为9.2 μg/mL的对照品溶液。精密量取9.2 μg/mL对照品溶液0.25、0.50、1.00、2.00、3.00、4.00 mL,置5 mL量瓶中,加甲醇至刻度,摇匀,得芍药苷质量浓度分别为0.46、0.92、1.84、3.68、5.52、7.36 μg/mL的系列对照品溶液。以芍药苷质量浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归,得回归方程Y=13.932 X+0.563 6,r=0.998 8,结果表明芍药苷在0.46~7.36 μg/mL线性关系良好。
2.5.4 精密度试验取9.2 μg/mL的芍药苷对照品溶液进样10 μL,重复进样6次,芍药苷峰面积RSD值为1.27%。
2.5.5 稳定性试验取金黄凝胶皮肤滞留样品与24 h接收液样品分别进样,每次进样10 μL,每隔12 h进样1次,3 d内测定6次,结果显示芍药苷及其他主要色谱峰面积基本保持不变,金黄凝胶皮肤滞留样品与24 h接收液样品中芍药苷峰面积RSD值分别为2.13%和2.26%。
2.5.6 重复性试验按“2.4”项下方法制备金黄凝胶供试品溶液,平行6份,分别进样10 μL,结果表明图 1-B中15个药物组分色谱峰面积的RSD均小于3.00%,其中芍药苷峰面积RSD为1.77%。
2.5.7 加样回收率试验将各组24 h空白组接收液混合,作为空白接收液备用。取芍药苷对照品溶液适量加入空白接收液中,配制成含芍药苷0.46、0.92、1.84 μg/mL的低、中、高3个质量浓度的对照品溶液各3份,进样10 μL测定,计算回收率分别为105.7%、103.2%、99.7%,RSD分别为2.17%、1.78%、1.43%。
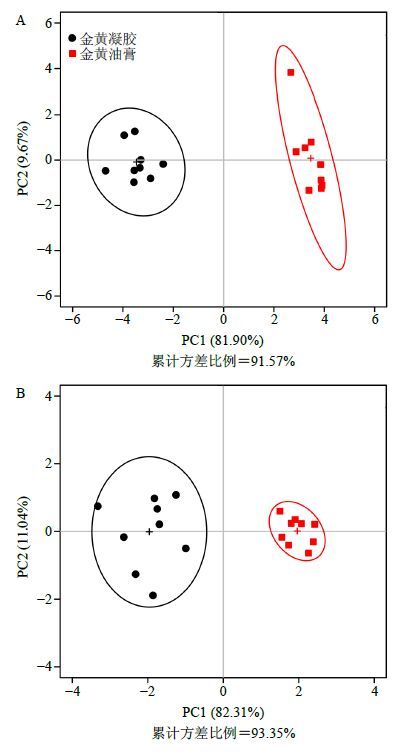
2.6 数据处理 2.6.1 PCA在完成体外透皮实验样品的HPLC测定后,对接收液及皮肤滞留样品进行PCA。首先导出金黄凝胶和金黄油膏24 h时间点HPLC色谱图的CSV格式原始数据,然后将CSV数据通过R软件(https://www.r-project.org/)做PCA运算,得到PCA得分图。PCA得分图直观形象地显示金黄凝胶组和金黄油膏组的接收液及皮肤滞留样品均能够完全分开(图 2),表明金黄凝胶和金黄油膏组无论在接收液还是在皮肤滞留样品中,其HPLC指纹图谱均整体表现出显著性差异。
|
图 2 皮肤滞留样品 (A) 与接收液样品 (B) HPLC指纹图谱数据的PCA Fig.2 PCA score plot of HPLC fingerprint data from skin retention (A) and receptive solution (B) |
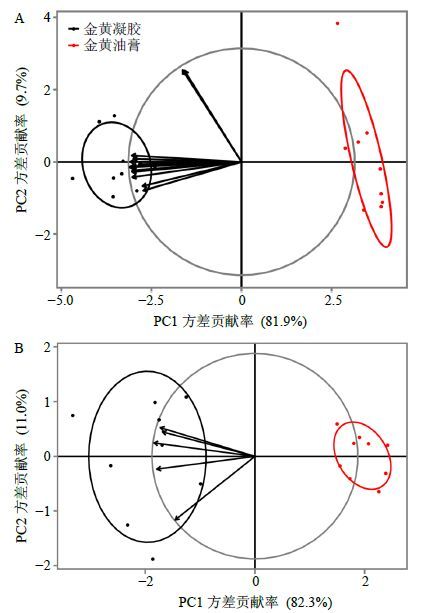
基于HPLC的特征谱图和色谱峰保留时间是鉴定化合物的基础,而色谱响应强度(如峰高、峰面积)是定量不同样品或组别之间差异的基础[9]。本实验从金黄凝胶与金黄油膏24 h时间点的接收液和皮肤滞留样品的指纹图谱中共找出了15个共有药物组分峰(图 1-B),该15个共有药物组分峰是通过对比给药组样品、金黄凝胶供试品与空白组样品的色谱峰保留时间,排除空白样品色谱峰干扰后的共有峰。首先对这15个共有药物组分峰的峰面积数据进行标准化处理[标准化数据=(峰面积-该列平均峰面积)/该列的标准差],然后经标准化处理的数据作为输入变量进行PCA,求出金黄凝胶和金黄油膏在接收液与皮肤滞留样品中的PCA载荷图(图 3)。PCA载荷图直观形象地展示出各共有药物组分峰的峰面积变量与金黄凝胶组变量在空间上相聚较近,表明各药物组分峰的峰面积与金黄凝胶组正相关程度高,即金黄凝胶组药物组分的整体透皮效果优于金黄油膏组;另外,各峰面积变量距离原点较远且远近相似,说明各峰面积变量均可以被这2个主成分充分解释,且各峰面积变量表现出相似的体外透皮吸收特征。
|
图 3 皮肤滞留样品 (A) 与接收液样品 (B) 共有药物组分峰的主成分分析载荷图 Fig.3 PCA biplot of common peak areas from skin retention (A) and receptive solution (B) |
2.6.2 累积透过量(Q)与皮肤滞留量(QS)计算方法[4]
通过上述PCA得知各共有药物组分峰的体外透皮吸收特征相似,为了能够揭示金黄凝胶体外渗透动力学特征,选择了复方中透皮吸收效果较好的有效成分芍药苷为代表,对Q、透皮速率及QS等指标进行考察。芍药苷Q按照下列公式计算。
| ${{Q}_{n}}\left( V{{C}_{n}}+\sum\limits_{i=1}^{n-1}{{}}{{C}_{i}}{{V}_{i}} \right)/A$ | (1) |
其中Qn为第n个时间点(金黄凝胶与金黄油膏中芍药苷均从6 h检测到)的Q(μg/cm2),Cn为第n个时间点测得的芍药苷质量浓度(μg/mL),Ci为第i个时间点测得的芍药苷质量浓度(μg/mL),Vi为每次取样的体积(mL),实验中扩散池容积(V)为6.5 mL,有效扩散面积(A)为1.67 cm2
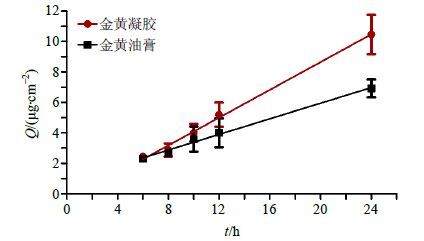
以Q对渗透时间t进行线性回归(图 4),所得方程即为渗透动力学方程,所得斜率即为透皮速率常数[Js,μg/(cm2·h)]。芍药苷体外渗透动力学参数及QS见表 1。综上表明芍药苷在2种剂型中的体外透皮行为满足零级动力学过程,且金黄凝胶组中芍药苷的Q24、Js及QS均显著高于金黄油膏组。由于PCA显示各共有药物组分峰的体外透皮吸收特征相似,因此其他药物组分在金黄凝胶中的体外透皮行为也应满足零级动力学过程。
|
图 4 金黄凝胶与金黄油膏中芍药苷的透皮吸收曲线 Fig.4 Q-t curves of paeoniflorin from Jinhuang Gel and Jinhuang Ointment |
|
|
表 1 芍药苷体外渗透动力学参数及皮肤滞留量 Table 1 In vitro permeation kinetics parameters and skin retention amount of paeoniflorin |
3 讨论
中药经皮给药制剂是一种高度复杂的混合体系,临床上常以多物质多靶点的方式协调发挥疗效,因此全面综合地评价中药经皮给药制剂的透皮规律,能够为其药效的发挥提供重要的物质基础。目前在研究中药经皮给药制剂体外透皮吸收过程中,由于中药经皮给药制剂复杂的物质基础,通常只能选择单个或几个药物成分作为评价指标,很难代表其整体药物成分的透皮规律。因此,寻找一种更加全面综合的评价透皮规律方法,是中药经皮给药制剂现代化研究的一个重要方面[10]。
PCA是一种基于投影技术的多元统计分析方法,它可以利用投影的方法将原始数据产生的数学模型进行降维处理以化繁为简,在不损失或尽量少损失原有信息的情况下把多个变量转化成较少几个重要变量且包含原有大部分信息的多元统计方法,该方法排除了原始数据中相互重叠的信息,避免了评价中主观加权的弊端,从而直观地发现样品或组别之间的差异[9-12]。
本研究对金黄凝胶经皮给药的整体药物组分的指纹图谱原始数据及15个共有药物组分峰面积分别进行PCA,克服了由单个或几个药物成分作为评价指标研究透皮规律的缺陷。PCA的结果表明金黄凝胶组药物组分的整体体外透皮吸收效果优于金黄油膏组。实验中选择透皮吸收效果较好的芍药苷色谱峰为代表,对Q、Js及QS等指标进行考察,结果表明芍药苷在2种剂型中的体外透皮行为符合零级动力学过程,且金黄凝胶组中芍药苷的Q、Js及QS均显著高于金黄油膏组。由于PCA显示各峰面积变量具有相似的体外透皮吸收特征,因此可知金黄凝胶组中其他药物组分的Q24、Js及QS也应显著高于金黄油膏组,且金黄凝胶组中其他药物组分的体外透皮吸收行为应满足零级动力学过程。以上研究结果与前期研究发现金黄凝胶对大鼠急性软组织损伤的治疗作用明显优于金黄油膏[13]是相符的。
| [1] | 唐建兰, 刘承伟, 王丹丹, 等. 金黄凝胶制剂成型工艺研究[J]. 中草药 , 2015, 46 (2) :207–210. |
| [2] | 唐建兰, 张珊, 刘承伟, 等. 金黄凝胶制备及质量控制研究[J]. 世界科学技术-中医药现代化 , 2015, 17 (5) :1085–1089. |
| [3] | 朱倩云, 李筱青, 李成网. 氮酮对如意金黄乳膏体外透皮吸收的影响[J]. 中国实验方剂学杂志 , 2011, 17 (20) :24–26. |
| [4] | Vizserálek G, Berkó S, Tóth G, et al. Permeability test for transdermal and local therapeutic patches using skin PAMPA method[J]. Eur J Pharm Sci , 2015, 76 (8) :165–172. |
| [5] | 王森, 欧水平, 管咏梅, 等. 良肤乳膏小鼠皮肤药物动力学的研究[J]. 中国中药杂志 , 2010, 35 (17) :2254–2257. |
| [6] | 王平, 刘善新. 颈痛舒贴片中芍药苷的体外透皮吸收研究[J]. 中国现代应用药学 , 2014, 31 (1) :66–69. |
| [7] | 蔡郁, 刘新颜, 梁文革. 以经皮微渗析技术研究芍药苷大鼠经皮吸收[J]. 中国实验方剂学杂志 , 2011, 17 (10) :116–118. |
| [8] | 张会, 张黄琴, 蒋秋冬, 等. 香附四物汤效应部位体外透皮吸收性质的研究[J]. 中草药 , 2015, 46 (20) :3017–3022. |
| [9] | 阿基业. 代谢组学数据处理方法——主成分分析[J]. 中国临床药理学与治疗学 , 2010, 15 (5) :481–489. |
| [10] | Trygg J, Holmes E, Lundstedt T. Chemometrics in metabonomics[J]. J Proteome Res , 2007, 6 (2) :469–479. |
| [11] | 张耀奇, 潘扬. 术类中药及其相关成药质量的主成分分析[J]. 南京中医药大学学报 , 1997, 13 (3) :149–150. |
| [12] | 李振皓, 刘培, 钱大玮, 等. 主成分分析用于香附四物汤效应部位体外经皮渗透的研究[J]. 药学学报 , 2013, 48 (6) :933–939. |
| [13] | 程玥, 唐朝辉, 曹亮, 等. 金黄凝胶对大鼠急性软组织损伤的治疗作用研究[J]. 现代药物与临床 , 2015, 30 (7) :768–773. |
 2016, Vol. 47
2016, Vol. 47


