紫菀Asteris Radix为常用中药,是菊科(Compositae)多年生草本植物紫菀Aster tataricus L.f.的干燥根及根茎,别名青菀、还魂草等,生于低山阴坡湿地、山顶和低山草地及沼泽地,海拔400~2 000 m[1]。具有润肺下气、消痰止咳的功效,常用于痰多咳喘,新久咳嗽,老嗽咳血[2]。紫菀分布于河北、黑龙江、吉林、辽宁和山西等地。河北省安国及安徽省亳州市等地有大量栽培[3]。紫菀是河北省道地药材,其化学成分丰富,药理活性多且明显。现代药理研究表明,紫菀中的黄酮类物质具有明显的抗氧化、抗炎等功效,如山柰酚、槲皮素在抑制溶血、脂质过氧化物反应和免疫调节方面均有显著作用,木犀草素亦有祛痰、止咳平喘的功效[4]。紫菀中的有机酸类物质也具有抗肿瘤、抗氧化和抗菌消炎等作用。如阿魏酸具有清除自由基、抗血栓、抑制肿瘤、防治高血压等保健作用[5];绿原酸具有利胆、抗菌、抗过敏、抗致畸、抗氧化、预防心血管疾病、糖尿病、抗肿瘤、促进糖类和脂质代谢等作用[6]。而紫菀中所含有的香豆素类物质也具有抗HIV、抗肿瘤、抗氧化、抗炎等多种药理活性[7]。鉴于紫菀新的药用价值,因此有必要对紫菀的活性成分进行全面地质量分析,以扩大紫菀的临床应用范围。目前紫菀的测定方法多为HPLC法和UV法[8-11],分析时间较长,杂质干扰较大。本实验采用HPLC-MS/MS法同时对紫菀中的4种黄酮类成分、3种有机酸类成分及2种香豆素类成分进行测定,并将其应用于不同来源市售紫菀的质量分析。该方法简便、快速、灵敏度高,为全面控制紫菀的质量,探索其新的药用价值和药效物质提供了参考。
1 仪器与试药 1.1 仪器Agilent1200高效液相色谱仪,配有在线脱气机,四元泵,自动进样器(美国Agilent公司);3200QTRAPTM三重四级杆线性离子阱质谱仪,配有ESI离子源(美国AB公司);Analyst 1.5.2 software数据系统(美国AB公司);SCQ-200超声波清洗器(100 W,25 kHz,上海声谱超声波设备厂);JA1203N型万分之一天平(上海精密科学仪器有限公司);BP211D型十万分之一天平(德国Sartorius公司)。
1.2 样品试药对照品山柰酚(批号1107341-201310)、槲皮素(批号100081-201408)、异鼠李素(批号110860-201410)、东莨菪内酯(批号110768-200504)、阿魏酸(批号110773-201313)、咖啡酸(批号110885-200102)和绿原酸(批号110753-201415)均购自中国食品药品检定研究院(质量分数大于98%)。木犀草素购自北京索莱宝科技有限公司(质量分数大于98%);伞形花内酯购自大连美仑生物技术有限公司(质量分数大于98%)。
乙腈为色谱纯(美国J.T.Baker公司);甲酸为色谱纯(美国Dikma公司);水为纯净水(杭州娃哈哈集团有限公司);其他试剂均为分析纯。不同批次样品由河北医科大学药学院生药学李连怀副教授鉴定为紫菀Aster tataricus L.f.。样品具体信息见表 1。
|
|
表 1 紫菀样品 Table 1 Samples of Asteris Radix |
2 方法与结果 2.1 分析条件 2.1.1 色谱条件
色谱柱为Diamonsil C18柱(150 mm×4.6 mm,5μm),流动相为水(A,0.05%甲酸)-乙腈(B,0.05%甲酸),梯度洗脱,0~8 min,10%~35% B;8~13 min,35%~75% B,13~20 min,75%~95% B,进样前按流动相初始条件平衡6 min;体积流量0.8 mL/min;柱温30℃;进样量10μL。对照品和样品的多反应监测模式(MRM)提取色谱图见图 1。
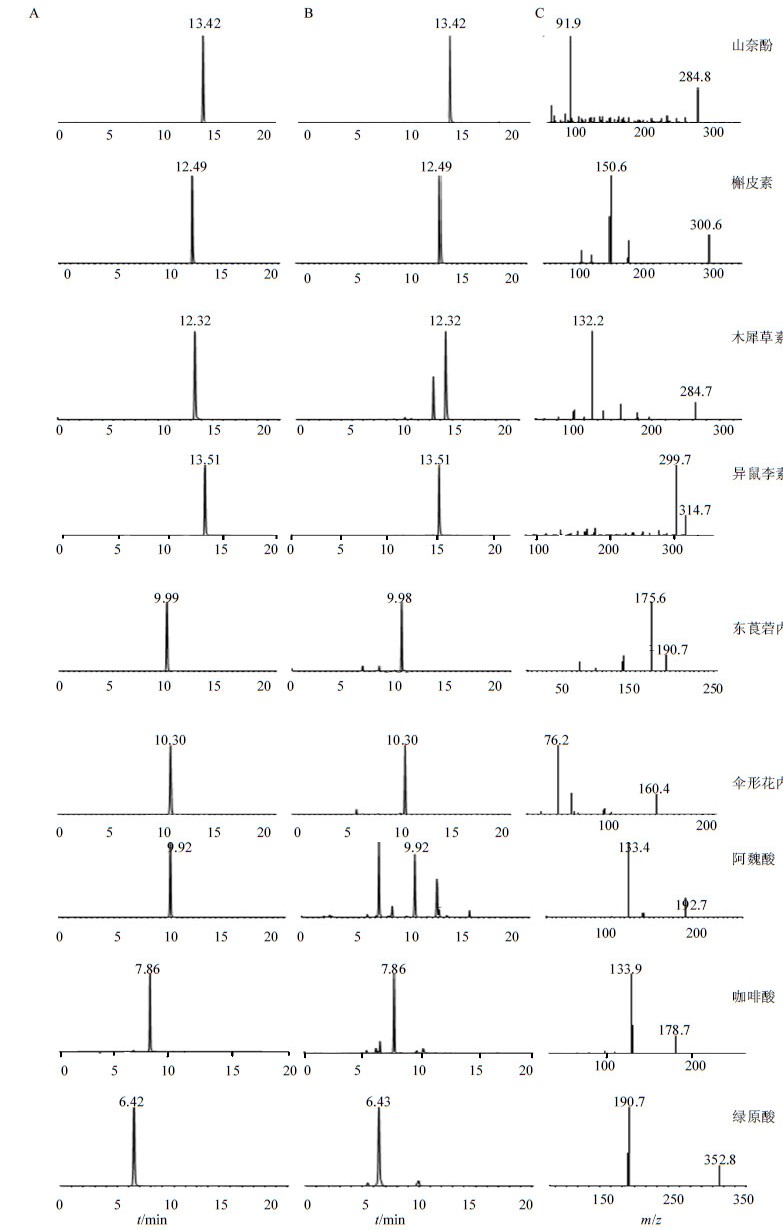
|
图 1 对照品(A)、紫菀样品(B)的MRM色谱图和对照品二级质谱图(C) Fig.1 MRM chromatograms of reference substances (A) and Asteris Radix samples (B) and second mass spectrum of reference substances (C) |
2.1.2 质谱条件
离子源为电喷雾离子化源(ESI);MRM进行定量分析;采用负离子检测模式;源喷射电压(IS)为−4 500 V;离子源温度为650℃;雾化气(GS1,N2)压力为413.70 kPa;辅助气(GS2,N2)压力为448.18 kPa;气帘气(N2)压力为206.85 kPa。接口加热,全程通入氮气,MRM模式定量。监测的离子对,解簇电压(DP)和碰撞能量(CE)见表 2。9种被测成分的二级质谱图见图 1。
|
|
表 2 紫菀中9种成分的质谱数据 Table 2 MS data of nine constituents from Asteris Radix |
2.2 溶液的制备 2.2.1 对照品溶液的制备
分别称取对照品山柰酚、槲皮素、木犀草素、异鼠李素、东莨菪内酯、伞形花内酯、阿魏酸、咖啡酸和绿原酸适量,精密称定,加75%甲醇制成对照品溶液。分别取各对照品溶液适量,摇匀,即得山柰酚、槲皮素、木犀草素、异鼠李素、东莨菪内酯、伞形花内酯、阿魏酸、咖啡酸和绿原酸的混合对照品溶液,质量浓度分别为30.300、15.550、0.438、21.950、1.100、0.247、6.050、6.150、45.600μg/mL。
2.2.2 供试品溶液的制备将紫菀于常温下阴干,粉碎后过40目筛。取样品粉末约1 g,精密称定,置具塞锥形瓶中,精密加入75%甲醇40 mL,称定质量,超声处理(功率250 W,频率50 kHz)40 min,放冷,再称定质量,用75%甲醇补足减失的质量,摇匀,静置2 h,取上清液过0.22μm微孔滤膜,续滤液作为供试品溶液。
2.3 方法学考察 2.3.1 线性关系、定量限和检测限精密量取上述混合对照品溶液适量,采用倍数稀释法进行稀释,得到6个不同质量浓度的系列对照品溶液,按照上述色谱和质谱条件进行分析,并记录色谱峰面积。以对照品的质量浓度为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,得回归方程(表 3)。将混合对照品溶液用75%甲醇逐步稀释并进行测定,分别以信噪比为10和3时各对照品的量作为定量限(LOQ)和检测限(LOD)。结果9种待测组分的质量浓度和峰面积的相关系数(r)均大于0.998 5,表明该方法线性关系良好。各组分的回归方程、线性范围、LOQ和LOD见表 3。
|
|
表 3 9种成分的回归方程、相关系数、线性范围、LOQ和LOD Table 3 Regression equations, correlation coefficients, linear ranges, LOD, and LOQ of nine constituents |
2.3.2 精密度试验
取上述配好的对照品溶液连续进样6次,测定,计算各成分峰面积的RSD值分别为山柰酚2.36%、槲皮素2.85%、木犀草素3.09%、异鼠李素2.15%、东莨菪内酯2.37%、伞形花内酯1.95%、阿魏酸2.63%、咖啡酸2.48%和绿原酸2.48%,表明该方法精密度良好。
2.3.3 稳定性试验取同一供试品溶液(河北-4),分别于0、2、4、8、12、24、48 h进样分析测定,记录峰面积,考察供试品溶液的稳定性。山柰酚、槲皮素、木犀草素、异鼠李素、东莨菪内酯、伞形花内酯、阿魏酸、咖啡酸和绿原酸的RSD分别为2.05%、2.10%、1.33%、2.85%、1.99%、2.90%、2.27%、2.12%和2.26%,表明样品稳定性良好。
2.3.4 重复性试验取同一批号(河北-4)紫菀样品,取约1 g,精密称取6份,按“2.2.2”项方法操作,制备供试品溶液,并在“2.1”色谱条件下计算9个组分的量,测得山柰酚、槲皮素、木犀草素、异鼠李素、东莨菪内酯、伞形花内酯、阿魏酸、咖啡酸、绿原酸质量分数的RSD分别为1.07%、1.10%、2.70%、1.98%、1.67%、2.67%、1.69%、1.33%和2.49%,符合规定,表明本方法重复性良好。
2.3.5 加样回收率试验精密称取已测定的紫菀样品(河北-4)0.5 g,分别精密加入190.37、380.74、571.11μg山柰酚,99.68、199.36、299.04μg槲皮素,0.43、0.86、1.29μg木犀草素,6.24、12.48、18.72μg异鼠李素,3.55、7.10、10.65μg东莨菪内酯,1.54、3.08、4.62μg伞形花内酯,7.88、15.76、23.64μg阿魏酸,15.59、31.18、46.77μg咖啡酸,112.23、224.46、336.69μg绿原酸的对照品溶液,每个水平3份,共9份,按“2.2.2”项下方法操作,制备供试品溶液。按上述色谱条件测定9个化合物的峰面积,计算回收率及RSD值。结果9种被测成分的平均回收率为97.43%~103.87%,RSD值为0.19%~3.40%。
2.4 样品测定取不同批次的紫菀样品,按“2.2.2”项下的方法制备供试品溶液,按照“2.1”项下的条件进行测定,记录色谱峰面积,将9个待测成分的峰面积代入相应的标准曲线方程中,并计算其质量分数。不同批号的紫菀的测定结果见表 4。
|
|
表 4 紫菀中9种成分的测定结果 Table 4 Determination of nine constituents in Asteris Radix |
不同产地的紫菀药材中有效成分的量相差较大,但总体结果看所测成分中山柰酚、槲皮素和绿原酸的含量相对较高,平均质量分数分别为672.44、390.18和1 142.49μg/g。其次为咖啡酸、阿魏酸及异鼠李素,平均质量分数分别为103.47、30.14和29.53μg/g,质量分数相对较低的是东莨菪内酯、伞形花内酯和木犀草素,平均质量分数分别为10.79、2.60和1.50μg/g。不同产地紫菀药材中各有效成分的量变化也差异较大,来自安徽亳州的3批药材中黄酮类成分及绿原酸的量要高于其他批次的紫菀药材,来自河北安国的4批药材中香豆素类成分及阿魏酸、咖啡酸的量相对较高。11批药材中质量分数差异最大的为东莨菪内酯,3号河北安国的紫菀东莨菪内酯比9号吉林紫菀的量高近40倍。
3 讨论在流动相的选择上,本实验对乙腈、甲醇和不同浓度的甲酸、乙酸溶液的不同配比进行了比较,结果表明,以水(0.05%甲酸)-乙腈(0.05%甲酸)为流动相进行梯度洗脱时,9种待测成分均有很好的分离,且响应值较高,峰形较好。
在药材的提取上,实验比较了以30%、50%、75%、100%甲醇,30%、50%、75%、100%乙醇为提取溶剂,结果表明以75%甲醇提取效率较高。另外还对提取方法进行了比较,超声提取与加热回流提取效果相近,但超声提取相对方便快捷,因此选择超声提取法。最后,还考察了提取20、40、60和90 mim对待测成分的提取效果,结果表明超声提取40 min提取效率较高。
本实验首次建立了一种快速、准确的HPLC-MS/MS分析方法,用于同时测定紫菀中的山柰酚、槲皮素、木犀草素、异鼠李素、东莨菪内酯、伞形花内酯、阿魏酸、咖啡酸和绿原酸9种化合物。该方法简单、准确、灵敏度高,成功检测了市售常见的11批紫菀样品,结果表明不同产地的紫菀药材有效成分的量及各质量分数的变化差异较大,这可能与采收时间、生长环境有关。HPLC-MS/MS方法为紫菀的质量控制提供了可靠地分析手段,对进一步研究紫菀的各类成分和各种生物活性的差异,充分利用其新的药用价值具有重要的意义。
| [1] | 侯海燕, 陈立, 董俊兴. 紫菀化学成分及药理活性研究进展[J]. 中国药学杂志 , 2006, 41 (3) :161–163. |
| [2] | 中国药典[S].一部. 2015. |
| [3] | 苏桂云, 刘颖. 紫菀、蜜紫菀的生产工艺流程[J]. 首都医药 , 2001, 2 . |
| [4] | Ng T B, Liu F, Lu Y H, et al. Antioxidant activity of compounds from the medicinal herb Aster tataricus[J]. Comp Biochem Physiol C Toxicol Pharmacol , 2003, 136 (2) :109–115. DOI:10.1016/S1532-0456(03)00170-4 |
| [5] | 田亚平, 景秀娟, 许磊, 等. HPLC法测定紫菀中阿魏酸、槲皮素和山柰酚[J]. 中草药 , 2008, 39 (6) :926–928. |
| [6] | 刘畅, 苟建敏, 何珺. 绿原酸的分离纯化工艺研究[J]. 贵州大学学报 , 2011, 6 (28) :29–32. |
| [7] | 孔令雷, 胡金凤, 陈乃宏. 香豆素类化合物药理和毒理作用的研究进展[J]. 中国药理学通报 , 2012, 28 (2) :165–168. |
| [8] | 高文远, 张蓉, 贾伟, 等. HPLC法测定紫菀中紫菀酮的含量[J]. 中草药 , 2003, 34 (10) :953–954. |
| [9] | 王甫成, 夏成凯, 栗进才, 等. HPLC法同时测定紫菀中5中黄酮类成分[J]. 中成药 , 2012, 34 (2) :306–309. |
| [10] | 王丹, 谭忠德, 王瑛. UV法测定紫菀中总黄酮类成分的含量[J]. 吉林医药学院学报 , 2014, 35 (1) :33–34. |
| [11] | 黄珊珊, 高英, 李卫民, 等. 分光光度法测定紫菀中总三萜类成分的含量[J]. 时珍国医国药 , 2008, 19 (6) :1406–1407. |
 2016, Vol. 47
2016, Vol. 47


