2. 山东省平邑县中医医院 老年病科, 山东 平邑 273300 ;
3. 山东中医药大学 中医药经典理论教育部重点实验室, 山东 济南 250355
2. Pingyi Country Hospital of Traditional Chinese Medicine, Pingyi 273300, China ;
3. Key Laboratory for Classical Theory of Traditional Chinese Medicine, Education Ministry, Shangdong University of Traditional Chinese Medicine, Jinan 250355, China
现代中医药研究中,常用白芍来治疗抑郁样障碍,无论在组方频次和用药剂量上,白芍都占有重要的位置[1]。本实验室前期研究也证明了以白芍提取物作为君药的舒郁胶囊和白香丹胶囊通过中枢作用机制对抑郁症及经前期综合征情绪障碍具有治疗作用[2-3]。国内外研究表明,白芍提取物的主要有效成分为单萜类物质及酚酸类成分[4],在口服给予白芍提取物后,其入血成分有芍药苷或芍药内酯苷等原型成分,也有单萜类物质的代谢产物如去羟基去亚甲基芍药苷等[5],但是对其抗抑郁作用的药效学物质基础研究国内外未见报道,其化学成分在大脑中的吸收与分布情况仍不清楚。为进一步研究白芍提取物(Paeoniae Alba Radix extracts,PARE)有效成分在大鼠血清和脑内的吸收代谢情况,本研究用电喷雾离子阱多级质谱法(LC/MSn)鉴定分析大鼠口服白芍提取物后血清及脑内的化学成分,尽可能较为全面地反映白芍提取物在机体内的物质基础,为其临床研究提供依据。
1 材料 1.1 实验动物雌性Wistar大鼠,体质量180~200 g,由山东中医药大学实验动物中心提供,许可证号SCXK(鲁)2011-0003。饲养于温度(22±2)℃及湿度(50±10)%的动物房,自由饮食,每天接受12 h光照,适应性饲养1周后,分笼饲养,每笼2只。
1.2 药品与主要试剂白芍提取物(含芍药苷35%,青岛阳光海川医药科技发展有限公司生产,批号20110527);芍药苷对照品(质量分数≥98%,批号110736-200526)购自中国食品药品检定研究院;LC-MS级甲醇购自Fisher Scientific,LC-MS级乙腈购自Merck公司,甲酸购自Fluka公司,去离子水来自本实验室Milli-Q去离子水系统(Millipore,美国),其余试剂为分析纯。
1.3 实验仪器Agilent 1100 series液相色谱仪系统;Agilent XCT plus型电喷雾离子阱质谱仪系统;KQ-300DE型医用数控超声波清洗器(昆山市超声仪器有限公司)。
2 方法 2.1 HPLC检测条件色谱柱为Kromasil C18 100 R(250 mm×4.6 mm,5 μm);流动相为乙腈(A)-0.2%冰醋酸水溶液(B);梯度洗脱:0~5 min,2%~5% A;5~12 min,5%~12% A;12~28 min,12%~16% A;28~42 min,16%~24% A;42~56 min,24%~36% A;56~72 min,36%~39% A;72~81 min,39%~64% A;81~90 min,64%~100% A。柱温30 ℃;体积流量为1 mL/min;进样量20 μL。
2.2 MS检测条件雾化气(N2)压力275.8 kPa(40.0 psi),干燥气体积流量11.0 L/min,温度350 ℃,毛细管电压3 500 V,扫描范围m/z 100~1 400;负离子扫描模式,多级质谱的碰撞电压为1 V。检测时采用柱后分流方法,进入紫外检测器与质谱检测器中的比例为4∶1。
2.3 大鼠血清样品及脑组织样品制备将雌性Wistar大鼠随机分为对照组(生理盐水,5 mL/kg)和白芍提取物组(36 mg/kg[6])每组12只。各组连续ig给药3 d,第4天给药120 min(预试验结果表明此时间点血中检测的成分较多)后,每组随机取6只大鼠,下腔静脉取血,全血静置30 min,4 000 r/min离心20 min,取上清液于-80 ℃保存备用。每组剩余6只大鼠用生理盐水进行心脏灌流后取全脑,并迅速剥离脑组织,于-80 ℃保存备用。
取待测大鼠血清100 μL加入离心管,再加入300 μL甲醇,涡旋2 min,在4 ℃下16 000×g离心30 min,取上清液,N2吹干,将吹干后的样品用甲醇定容至100 μL,涡旋2 min,16 000×g离心,取上清液20 μL,进行HPLC-ESI-MSn检测分析。
取脑组织,精密称质量,加入2倍量生理盐水,5 000 r/min匀浆1 min,记录匀浆液体积,加入3倍量甲醇沉淀蛋白,涡旋2 min,在4 ℃下,16 000×g离心30 min,取上清液,氮气吹干,加入少量甲醇复溶,涡旋2 min,16 000×g离心30 min后,取上清液20 μL,进行HPLC-ESI-MSn检测分析。
3 结果 3.1 白芍提取物在大鼠血清中的移行成分根据血清样品质谱信息和提取总离子流图,与对照组相比较,确定为入血成分或代谢成分后,再进一步比较质谱信息、保留时间、对照品和相关文献数据进行成分确认。由此通过HPLC-ESI-MSn法进行检测,共鉴定出白芍提取物进入血清中化学成分34个,其中8个成分为新推测的文献中未检索到的代谢产物(表 1)。
|
|
表 1 白芍提取物ig给药后在大鼠血清中的成分分析 Table 1 Composition analysis of PARE in rat plasma after ig administration |
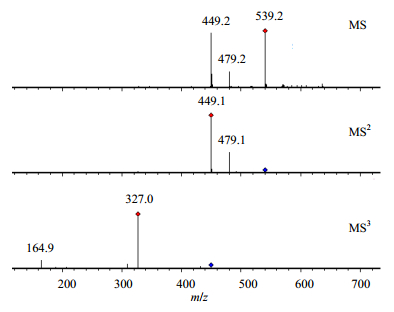
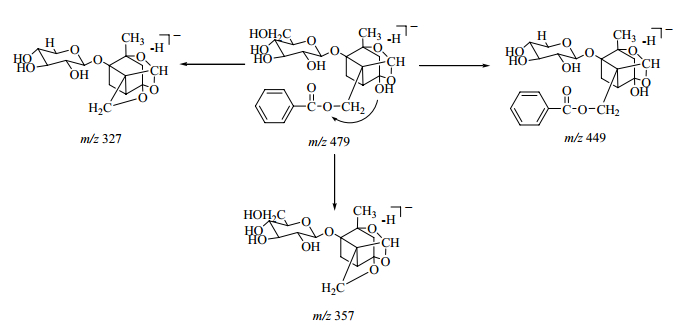
在ESI-模式下,化合物19(tR=27.8 min)通过与对照品比对,鉴定为芍药苷。其基峰离子为 [M-H+CH3COOH]-(m/z 539),该离子在进一步的MS/MS裂解过程中,产生其准分子离子[M-H]-(m/z 479),该离子比较容易通过在葡萄糖基6位碳上丢失1分子甲醛(30)产生m/z 449离子;通过丢失1分子苯甲酸(122)生成m/z 357离子;通过同时丢失1分子苯甲酸(122)和1分子甲醛(30)生成m/z 327离子。芍药苷多级质谱图以及可能的ESI-MS/MS裂解途径分别见图 1和图 2。
|
图 1 芍药苷ESI-MS/MS质谱图 Fig.1 MSn spectra of paeoniflorin |
|
图 2 芍药苷可能的MS/MS裂解途径 Fig.2 Proposed MS/MS fragmentation pathway for paeoniflorin |
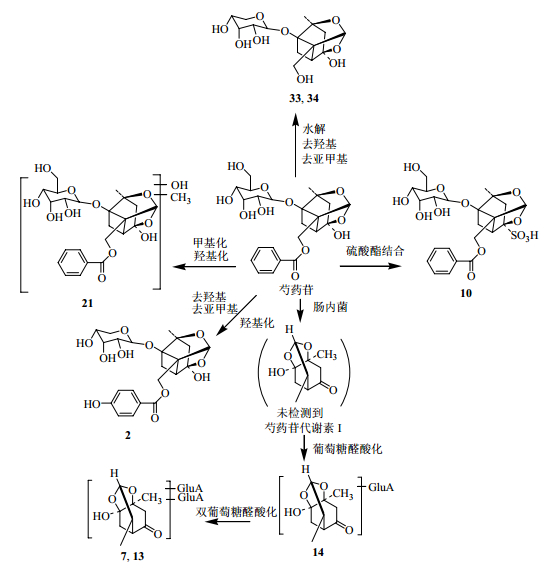
化合物17(tR=24.7 min)与芍药苷对照品有相同的溶剂离子峰,[M-H]-离子继续裂解产生m/z 357 [M-H-122]-、327 [M-H-122-30]-和283 [M-H-122-30-44]-离子,它们的裂解途径与芍药苷类似,根据文献报道[5],此化合物可鉴定为芍药内酯苷。
化合物20(tR=28.0 min)存在m/z 449的离子。对m/z 449进行MS2分析,得到m/z 327 [M-H-122]-和309 [M-H-122-H2O]-离子,继而中性丢失葡萄糖残基,形成m/z 165 [M-H-122-162]-碎片离子。推测该代谢产物的裂解途径可能类似于芍药苷,结合文献资料[5],推断该代谢产物为去羟基去亚甲基芍药苷。化合物21(tR=27.8 min)在ESI-模式下得到m/z 569 [M-H+CH3COOH]-的溶剂离子峰,与芍药苷有共同的碎片离子m/z 449、327,并且该化合物的相对分子质量比芍药苷多30,推测该化合物可能是芍药苷经过甲基化和羟基化的产物。化合物10(tR=16.5 min)一级质谱m/z 543,结合其多级质谱数据及文献资料[4],推测该化合物为芍药苷亚硫酸酯,这可能是血中的代谢产物,也可能是药材在储存过程中经过硫熏处理后生成的化学成分直接被吸收入血。
化合物2(tR=5.6 min)、3(tR=5.9 min)、5(tR=6.9 min)、33(tR=61.3 min)及34(tR=61.4 min)多级质谱信息均存在m/z 345、327碎片离子,而且化合物34、35有相同的溶剂离子峰m/z 405 [M-H+CH3COOH]-,化合物2存在 [M-H]-离子(m/z 465),且化合物3 [M-H]-离子(m/z 507)比化合物2相对分子质量大162(葡萄糖残基),结合文献信息[4],由此将它们分别鉴定为去羟基去亚甲基氧化芍药苷、去羟基去亚甲基去苯甲酰基芍药苷葡萄糖化、去苯甲酰基芍药苷、去羟基去亚甲基去苯甲酰基芍药苷或其同分异构体。
化合物7(tR=14.0 min)、13(tR=20.3 min)、14(tR=22.0 min)多级质谱信息显示m/z 373、197及175碎片离子,它们最明显的ESI-MS/MS裂解规律主要是中性丢失176碎片,推断是葡萄糖醛酸残基,产生苷元离子m/z 197 [aglycon-H]-,根据文献数据[7],将它们分别推测化合物7和13为芍药苷代谢素-I-双葡萄糖醛酸或其同分异构体,化合物14为芍药苷代谢素-I-葡萄糖醛酸。
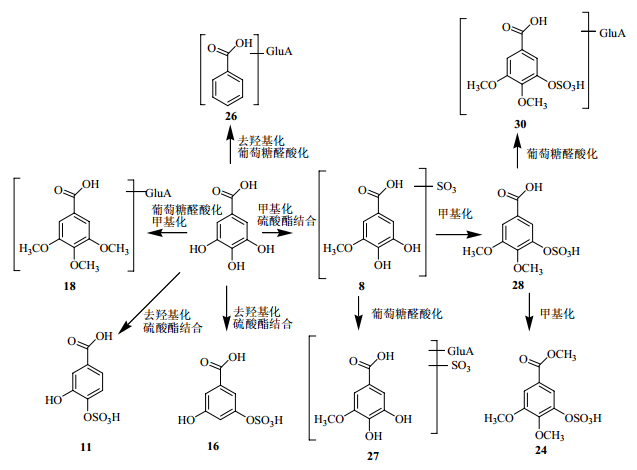
化合物9(tR=15.0 min)一级质谱m/z 527 [M-H]-,二级质谱m/z 497 [M-H-HCHO]-,三级质谱m/z 479 [M-H-HCHO-H2O]-、271 [M-H-HCHO-H2O-galloyl-2HCHO-CO2]-,由此可以推测该化合物为6′-O-没食子酰基去苯甲酰基芍药苷。化合物22(tR=32.6 min)、23(tR=33.0 min)一级质谱m/z 631 [M-H]-,多级质谱m/z 613、465,313和169,根据文献信息[8],分别推测为没食子酰氧化芍药苷或没食子酰氧化芍药内酯苷。化合物12(tR=20.0 min)一级质谱m/z 495,对其进行质谱分析,出现m/z 465 [M-H-HCHO]-和137 [C7H5O3]-碎片离子,结合文献报道[4],推断为氧化芍药苷或其同分异构体。
化合物8(tR=14.1 min)的ESI-MS谱基峰离子为m/z 263 [M-H]-,中性丢失SO3产生糖苷配基离子m/z 183 [aglycon-H]-,进一步解离产生m/z 167碎片离子,根据文献报道[9]的质谱裂解规律推测该化合物为4-O-甲基没食子酸硫酸酯或3-O-甲基没食子酸硫酸酯。化合24(tR=35.7 min)基峰离子为m/z 291 [M-H]-,比化合物8多28,且通过中性丢失SO3产生子离子,推测该化合物为三甲基化没食子酸硫酸酯。化合物27(tR=42.8 min)的准分子离子m/z 439 [M-H]-,通过丢失葡萄糖醛酸片段产生二级质谱m/z 263,因此推测该化合物为甲基没食子酸硫酸酯-葡萄糖醛酸酯。
化合物11(tR=18.1 min)、16(tR=24.5 min)、25(tR=39.9 min)准分子离子m/z 233 [M-H]-,通过丢失SO3产生子离子m/z 153,通过丢失44产生子离子m/z 189,结合文献报道[8]分别推测该化合物为原儿茶酸-4-O-硫酸酯、原儿茶酸-3-O-硫酸酯或其同分异构体。
化合物28(tR=43.3 min)准分子离子m/z 277 [M-H]-,在ESI-MS2中产生m/z 197的基峰离子,推断其中性丢失SO3,ESI-MS3谱中的m/z 169则是继续丢失2个CH2的结果,由此将其鉴定为3,4-二-O-甲基没食子酸硫酸酯。化合物30(tR=50.4 min)的 [M-H]-离子(m/z 453)通过丢失葡萄糖醛酸片段产生二级质谱m/z 277,由此可以推测该化合物为3,4-二-O-甲基没食子酸硫酸酯-葡萄糖醛酸酯。
化合物18(tR=26.8 min)的 [M-H]-离子m/z为453,其子离子m/z为211、197和175,由此推测该化合物为三甲基化没食子酸-葡萄糖醛酸苷。化合物26(tR=42.4 min)的 [M-H]-离子m/z为297,其子离子通过丢失葡萄糖醛酸片段产生碎片离子m/z 121,由此推测该化合物为苯甲酸-葡萄糖醛酸苷。
3.2 白芍提取物在大鼠体内潜在的生物转化途径根据以上白芍提取物ig给药后在血中代谢产物鉴定的结果,芍药苷(芍药内酯苷)和没食子酸类物质的主要代谢物及生物转化途径见图 3和4。
|
图 3 芍药苷在大鼠血清中相关的代谢途径 Fig.3 Relative metabolic pathways of paeoniflorin in serum of rats |
|
图 4 没食子酸类在大鼠血清中相关的代谢途径 Fig.4 Relative metabolic pathways of gallic acids in serum of rats |
3.3 白芍提取物在大鼠全脑中的成分鉴定
根据入血成分或代谢产物的鉴定方法,对已经寻找到的血中化学成分和文献中可能吸收入脑的化学成分进行MS/MS分析,以进一步确认可能的入脑成分或代谢产物。结果发现,大鼠全脑内共鉴定出芍药苷相关的代谢产物有芍药苷、芍药内酯苷、去羟基去亚甲基芍药苷(表 2)。
|
|
表 2 白芍提取物ig给药后在大鼠全脑中的成分分析 Table 2 Composition analysis of PARE in rat brain after ig administration |
4 讨论
本实验从大鼠血清中检测到了34个入血成分或代谢产物,其中17个为芍药苷相关的原型成分或代谢产物,10个为没食子酸相关的代谢产物,另外还有7个为其他化学成分相关的代谢产物,这些化学成分中有8个代谢产物为文献未检索到的新代谢产物。在大鼠全脑中共检测到了3个入脑成分或代谢产物,其中去羟基去亚甲基芍药苷为新检测到的代谢产物。药物进入体内后,有的化学成分进入机体后直接具有生物活性,有的则在各种生物代谢酶的作用下,产生各种化学结构的代谢产物而间接发挥其生物活性,因此这些入血入脑成分或代谢产物在体内的发挥药理作用的形式及机制都需要进一步的研究。
有研究证明大鼠静脉给予芍药提取物后,芍药苷能快速分布到大鼠海马组织[10],皮下给予芍药苷后,在大鼠脑内亦能检查到芍药苷[11]。本实验灌胃给予白芍提取物后,在大鼠脑内检测到芍药苷和芍药内酯苷,证明这2种成分均能通过血脑屏障而进入脑内,发挥相应的药理活性,这与文献描述相一致[12-13]。由此可见,芍药苷和芍药内酯苷在单方或复方中以原型成分吸收入血入脑,代谢产物去羟基去亚甲基芍药苷,可能为血中代谢产物透过血脑屏障进入到脑中。脑中的芍药苷、芍药内酯苷、去羟基去亚甲基芍药苷可能是白芍发挥中枢机制治疗抑郁样情绪障碍的有效成分。
HPLC-ESI-MSn方法具有快速,准确的优点,对中药复方复杂化学成分的分析研究及对中药药效物质基础研究均具有重要意义。对于体内样品中的部分成分仅仅依靠其色谱保留行为以及多级质谱数据等信息进行结构鉴定,不能准确确定其结构,还需要在以后的研究中通过分离和制备技术以及核磁共振等其他分析方法来进一步鉴定其具体明确的结构。
| [1] | 王景霞, 张建军, 李伟, 等. 白芍提取物治疗抑郁症的实验研究[J]. 中国实验方剂学杂志 , 2010, 16 (7) :183–184. |
| [2] | 王美艳, 宋春红, 薛玲. 舒郁胶囊对PMS肝气郁证模型大鼠海马μ阿片受体分布表达的影响[J]. 世界科学技术—中医药现代化 , 2015, 17 (4) :782–787. |
| [3] | 李倩, 魏盛, 朱德豪, 等. 白香丹胶囊对PMDD肝气逆证模型大鼠海马NMDAR1亚基蛋白分布及表达的影响[J]. 世界科学技术—中医药现代化 , 2015, 17 (4) :805–810. |
| [4] | Li S L, Song J Z, Choi F F, et al. Chemical profiling of Radix Paeoniae evaluated by ultra-performance liquid chromatography/photo-diode-array/quadrupole time-of- flight mass spectrometry[J]. J Pharm Biomed Anal , 2009, 49 (2) :253–266. DOI:10.1016/j.jpba.2008.11.007 |
| [5] | Chen Z W, Tong L, Li S M, et al. Identification of metabolites of Radix Paeoniae Alba extract in rat bile, plasma and urine by ultra-performance liquid chromatography-quadrupole time-of-flight mass spectrometry[J]. J Pharm Anal , 2014, 4 (1) :14–25. DOI:10.1016/j.jpha.2013.06.004 |
| [6] | 李芳, 宋春红, 魏盛, 等. 白芍提取物对经前期综合征肝气郁证模型大鼠额叶5-HT3A/3BR分布与蛋白表达的影响[J]. 世界科学技术—中医药现代化 , 2015, 17 (11) :2267–2271. |
| [7] | Liang J, Xu F, Zhang Y Z, et al. The profiling and identification of the absorbed constituents and metabolites of Paeoniae Radix Rubra decoction in rat plasma and urine by the HPLC-DAD-ESI-IT-TOF-MSn technique: a novel strategy for the systematic screening and identification of absorbed constituents and metabolites from traditional Chinese medicines[J]. J Pharm Biomed Anal , 2013, 83 (5) :108–121. |
| [8] | Xiao S, Luo K, Wen X X, et al. A pre-classification strategy for identification of compounds in traditional Chinese medicine analogous formulas by high- performance liquid chromatography-Mass spectrometry[J]. J Pharm Biomed Anal , 2014, 92 (11) :82–89. |
| [9] | Yan Z X, Chen Y, Li T X, et al. Identification of metabolites of Si-Ni-San, a traditional Chinese medicine formula, in rat plasma and urine using liquid chromatography/diode array detection/triple-quadrupole spectrometry[J]. J Chromatogr B , 2012, 885/886 (5) :73–82. |
| [10] | He X H, Xing D M, Ding Y, et al. Determination of paeoniflorin in rat hippocampus by high-performance liquid chromatography after intravenous administration of Paeoniae Radix extract[J]. J Chromatogr B Analyt Technol Biomed Life Sci , 2004, 802 (2) :277–281. DOI:10.1016/j.jchromb.2003.11.040 |
| [11] | Xia S M, Shen R, Sun X Y, et al. Development and validation of a sensitive liquid chromatography-tandem mass spectrometry method for the determination of paeoniflorin in rat brain and its application to pharmacokinetic study[J]. J Chromatogr B , 2007, 857 (1) :32–39. DOI:10.1016/j.jchromb.2007.06.022 |
| [12] | Li T X, Hu L, Zhang M M, et al. A sensitive UPLC-MS/MS method for simultaneous determination of eleven bioactive components of Tong-Xie-Yao-Fang decoction in rat biological matrices[J]. J Chromatogr B , 2014, 944 :90–100. DOI:10.1016/j.jchromb.2013.11.015 |
| [13] | Luo N C, Li Z H, Qian D W, et al. Simultaneous determination of bioactive components of Radix Angelicae Sinensis-Radix Paeoniae Alba herb couple in rat plasma and tissues by UPLC-MS/MS and its application to pharmacokinetics and tissue distribution[J]. J Chromatogr B , 2014, 963 :29–39. DOI:10.1016/j.jchromb.2014.05.036 |
 2016, Vol. 47
2016, Vol. 47


