天然化合物姜黄素(curcumin,Cur)是从姜科(Zingiberaceae)、天南星科(Araceae)等植物的根茎中提取出来的一种相对分子质量较小的多酚类物质[1-2]。通常认为它是姜黄中最有效的活性成分[3],在食品生产中常用作色素和调味剂[4],在植物界中是很少见的二酮类色素,为二酮类化合物[5-6]。近年来,很多学者研究发现,Cur具有抗氧化、抗菌、抗炎、抗肿瘤、保护肝肾、清除体内自由基等药理作用,对心脑血管、消化系统也具有保护功能[7-8]。Cur开发应用前景广阔,具有较为理想的药用价值,且毒性很低,具有良好的临床应用潜力[9-10]。但是Cur水溶性差,口服生物利用度低,使其应用受到了限制。
为了提高难溶性药物的溶解度,可以通过制备颗粒小、粒径分布均匀的纳米粉来解决,药物纳米化常用的方法有湿磨法、气流粉碎法、高压均质技术、超临界流体技术和反溶剂法等,其中机械粉碎法是目前应用最广泛的,但是缺点是耗能大、效率低和粒径分布不均匀。高压均质技术和超临界流体技术存在投资大、产率低、不易在工业中放大等缺点。反溶剂法[11-13]是把药物溶于它的良溶剂中后,加入到它的不良溶剂中,从而通过降低良溶剂的溶解能力,使药物迅速达到过饱和状态而结晶析出的一种传统微粉化技术。随着含有药物的溶液滴加到反溶剂中,溶剂与反溶剂体系对药物的溶解度骤降,药物达到过饱和,从而结晶析出。可通过添加相应的表面活性剂,控制药物的结晶,促进晶核的形成,抑制结晶的团聚,获得平均粒径较理想的纳米药物。此方法操作简单、效率高、成本低、生产过程可以一步完成,得到的药物颗粒的特点是制备的粉体颗粒小、活性中心多、吸附能力强、粒度分布均匀。目前,通过该方法已成功制备了多种难溶性口服药物。例如,许文佳等[14]采用反溶剂重结晶法制备甘草酸纳米粒,得到的纳米粒平均粒径为220 nm左右;赵修华等[15]利用反溶剂法进行反式肉桂酸微粉化的工艺研究,所得微粉化反式肉桂酸的粒径为130 nm左右。
近年来,已有很多学者通过脂质体[16]、胶束[17]、微乳[18]、熔融[19]、纳米结晶[20]等方法进行Cur纳米化研究,虽然得到的纳米Cur提高了其溶解度和生物利用度,但是Cur纯度低、辅料多、在生产中不易放大,以高分子材料作为辅料会产生安全性等问题。所以本研究通过反溶剂法制备Cur纳米粒(curcumin nanoparticles,CN)冻干粉(CN lyophilized powder,CNLP)来提高Cur的溶解度和生物利用度,减少其用药量,节省资源;改变Cur传统剂型,丰富Cur的剂型选择和给药途径,增强Cur的临床药效[21-22]。本研究主要利用反溶剂法制备CNLP,采用单因素优化实验方法对药物质量浓度、表面活性剂用量、水和有机相的比例、搅拌速率、沉积时间、Cur和甘露醇的质量比6个因素进行考察研究,得到制备CNLP的最优制备条件,并对CNLP的粒径检测、饱和溶解度、溶出速率情况进行研究。
1 仪器与材料SHJ-A4水浴恒温磁力搅拌器,常州华奥仪器制造有限公司;ZetaPALS激光粒度仪,美国布鲁克海文;Quanta-200扫描电子显微镜(SEM),荷兰FEI公司;Scientz-18N型冷冻干燥机,宁波新芝生物科技股份有限公司;LXJ-IIB型离心机,上海安亭科学仪器厂;Waters1525高效液相色谱仪,美国Waters公司。
Cur,质量分数98%,西安源森生物科技有限公司,批号B20614;Cur对照品,质量分数≥98%,中国食品药品检定研究院,批号20140516;聚山梨酯-80(P80)、甘露醇,分析纯,天津市天力化学试剂有限公司;丙酮,天津市富于精细化工有限公司;去离子水,实验室自制;乙腈,色谱级,山东禹王实业有限公司;盐酸,分析纯,新乡市宏盛化工有限公司;冰乙酸、磷酸二氢钾、氢氧化钠,分析纯,天津市致远化学试剂有限公司。
2 方法与结果 2.1 反溶剂法制备CNLP本实验通过反溶剂法制备CNLP。将一定质量的Cur溶解在适量溶剂丙酮中,超声10 min,然后以4 000 r/min离心10 min去除杂质,取上清。在磁力搅拌器适当搅拌速率条件下,将Cur丙酮溶液匀速加入含有P80的水溶液中,搅拌5 min。将得到的CN混悬液用旋转蒸发仪进行旋蒸,去除溶剂丙酮,最后在混悬液中加入适量甘露醇作为冻干保护剂,混合均匀后放入-40℃冰箱中预冻(12 h),再将其放入冻干机中进行冷冻(-80℃)干燥48 h,最后得到CNLP。
2.2 单因素优化通过预试验进行考察研究,确定了以丙酮作为溶剂、水作为反溶剂,影响粒径大小的因素有药物质量浓度、P80用量、溶剂和反溶剂体积比(丙酮-水体积比)、搅拌速率、沉积时间、Cur和甘露醇的质量比共6个因素。例如,研究沉积时间时,其他因素设置为药物质量浓度8 mg/mL、溶剂和反溶剂的比例1:5、表面活性剂P80用量0.1%、搅拌速率1 200 r/min,每组实验重复3次,得到的Cur纳米混悬液通过激光粒度仪来检测粒径,计算平均值。因素范围设置如下:Cur质量浓度为0.1~10 mg/mL,溶剂和反溶剂的比例为1:1~1:20,表面活性剂P80用量为0.01%~0.3%,沉积时间为2~60 min,搅拌速率为200~2 000 r/min,甘露醇与Cur质量比为0:1~6:1。
2.2.1 表面活性剂P80用量对CN平均粒径的影响保持其他实验工艺条件不变(Cur质量浓度为10 mg/mL、反溶剂与溶剂比例为1:5、沉积时间为10 min、搅拌速率为1 200 r/min)的情况下考察表面活性剂P80用量分别为0.01%、0.015%、0.025%、0.05%、0.1%、0.15%、0.2%、0.25%、0.3%对得到的CN混悬液平均粒径的影响,结果平均粒径分别为(547.9±6.2)、(517.9±5.3)、(125.0±3.1)、(49.5±4.3)、(57.5±6.7)、(52.4±2.1)、(52.1±3.9)、(51.4±4.1)、(56.1±3.3)nm。当表面活性剂P80用量从0.01%增加到0.05%时(按P80水溶液计算),CN混悬液的平均粒径从547.9 nm降低至49.5 nm,然而随着表面活性剂P80用量增加至0.3%时,CN混悬液的平均粒径并没有发生明显变化。通过观察,平均粒径先随着表面活性剂用量增加而减小,然后基本保持不变,原因是P80作为非离子型表面活性剂,用量越高时它的亲水能力就越强,这样也会增强Cur在水中的分散性,所以导致CN混悬液的平均粒径变小,但是用量过大时,因P80为油性物质,所以导致在冻干过程中不易冻干。继续增加表面活性剂用量时,粒径基本保持不变,综合考虑,0.05%的表面活性剂P80用量被确定为最佳用量。
2.2.2 Cur质量浓度对CN平均粒径的影响在其他工艺条件不变(表面活性剂用量为0.05%、反溶剂与容积比为1:5、沉积时间为10 min、搅拌速率为1 200 r/min)的情况下考察Cur质量浓度分别为0.1、0.25、0.5、1、2、4、6、8、10 mg/mL对得到的CN混悬液平均粒径的影响,结果平均粒径分别为(151.9±2.3)、(162.8±1.6)、(182.0±2.9)、(136.6±3.1)、(61.4±2.8)、(51.70±1.7)、(55.8±2.6)、(46.1±3.1)、(61.5±2.5)nm。Cur的质量浓度从0.1 mg/mL增加至4 mg/mL时,Cur平均粒径呈减小趋势,增加至8 mg/mL时平均粒径无明显变化,当增加到10 mg/mL时平均粒径有增大趋势。这是由于Cur丙酮溶液质量浓度过高时,沉积过程中产生的药物微粒数量增多,同样也会增大药物微粒间的碰撞和团聚几率,在重结晶过程中就会生成大量的微粒团聚物,导致粒径增大;药物质量浓度过小易造成产品得率较低等问题。因此综合考虑,将8 mg/mL作为Cur最佳质量浓度用来制备CN。
2.2.3 溶剂与反溶剂体积比对CN平均粒径的影响在其他工艺条件不变(表面活性剂用量为0.05%、Cur质量浓度为8 mg/mL、沉积时间为10 min、搅拌速率为1 200 r/min)的情况下考察溶剂与反溶剂体积比分别为1:2、1:2.5、1:3、1:4、1:5、1:10、1:15、1:20对得到的CN混悬液平均粒径的影响,结果平均粒径分别为(102.3±2.9)、(94.9±3.1)、(65.7±2.5)、(65.7±1.4)、(44.5±3.2)、(62.2±2.8)、(76.0±3.6)、(107.6±2.6)nm。当体积比从1:1增加到1:5时,CN混悬液的平均粒径从102.27 nm减小到44.53 nm;当体积比从1:5增加到1:20时,平均粒径又持续增大至107.63 nm。原因是随着反溶剂比例的增加会使药物在短时间内达到过饱和,这时在沉积过程中Cur粒子会迅速结晶析出,会产生很小的Cur微粒子,反之在继续增加反溶剂的比例时,虽然会继续增大过饱和度,但是产生的小微粒不稳定,会产生团聚和聚合现象,所以粒径也随之增大。因此,选择体积比1:5为最优条件。
2.2.4 沉积时间对CN平均粒径的影响在其他工艺条件不变(表面活性剂用量为0.05%、Cur质量浓度为8 mg/mL、溶剂与反溶剂比为1:5、搅拌速率为1 200 r/min)的情况下考察沉积时间分别为2、5、10、20、30、60 min对得到的CN混悬液平均粒径的影响,结果平均粒径分别为(114.8±3.9)、(49.8±2.6)、(51.9±1.6)、(55.2±3.8)、(53.4±2.9)、(47.6±2.3)nm。沉积过程在5 min之前,平均粒径迅速减小,5 min以后直至60 min,平均粒径大小虽有变化但幅度相当小,基本趋于稳定。这是因为CN在重结晶过程中,短时间内尚未沉积完全,导致粒径变大;达到5 min以后,随着沉积时间的延长,搅拌过程中,由于奥斯瓦尔德熟化效应,小粒子会相互碰撞并聚集生长为大颗粒[23]。但是在不断搅拌的条件下,又将团聚的大粒子拆分成小粒子,所以其平均粒径并未发生明显变化。综合考虑,沉积时间的长短对CN的得率有影响,需要进一步进行优化。
2.2.5 搅拌速率对CN平均粒径的影响在其他工艺条件不变(表面活性剂用量为0.05%、Cur质量浓度为8 mg/mL、溶剂与反溶剂比为1:5、沉积时间为5 min)的情况下考察搅拌速率分别为200、400、800、1 200、1 600、2 000 r/min对得到的CN混悬液平均粒径的影响,结果平均粒径分别为(84.8±3.5)、(50.9±2.3)、(49.9±3.3)、(51.0±3.1)、(51.6±1.9)、(52.1±2.6)nm。搅拌速率由200 r/min到400 r/min时,平均粒径迅速从75.00 nm减小到50.93 nm;继续加速到800 r/min,平均粒径减小到49.93 nm;再继续加速,随着搅拌速率的增加,平均粒径基本保持不变。这是因为在低搅拌速率下,沉积出的粒子不能在体系中均匀的分散,从而使粒子团聚;反之,在沉积刚开始时,高搅拌速率,会使粒子不易团聚,破坏了粒子的聚合,继续搅拌时,也会使沉积体系更加均匀,最后粒子粒径变化趋于稳定。虽然搅拌速率为800 r/min时粒径最小,但综合考虑到节能环保等因素,因此选择搅拌速率较小而粒径差别不大的400 r/min为最佳搅拌速率。
2.2.6 冻干保护剂甘露醇用量对CNLP平均粒径的影响在上述条件下(表面活性剂用量为0.05%、Cur质量浓度为8 mg/mL、溶剂与反溶剂比为1:5、沉积时间为5 min、搅拌速率为400 r/min)制备的CN混悬液,按照甘露醇与Cur的质量比为0:1、0.5:1、1:1、2:1、3:1、4:1、5:1、6:1的比例加入到CN混悬液中,使其充分溶解后,进行真空冷冻干燥,最后得到CNLP,再用去离子水复溶后,检测粒径,结果平均粒径分别为(310.3±5.1)、(220.4±4.3)、(227.9±2.6)、(212.3±3.9)、(195.6±3.1)、(172.2±4.6)、(176.9±2.5)、(175.1±3.9)nm。不加甘露醇的平均粒径为310.3 nm,质量比从0.5:1增加到4:1,CN的平均粒径从220.4 nm减小到172.2 nm;增加到5:1,平均粒径大小为176.9 nm;增加到6:1,平均粒径大小为175.1 nm。可以看出,Cur与甘露醇的质量比增加到1:4后,当甘露醇的用量继续增加时,平均粒径大小并无明显变化。因此,得到了最优的Cur与甘露醇的质量比为4:1。
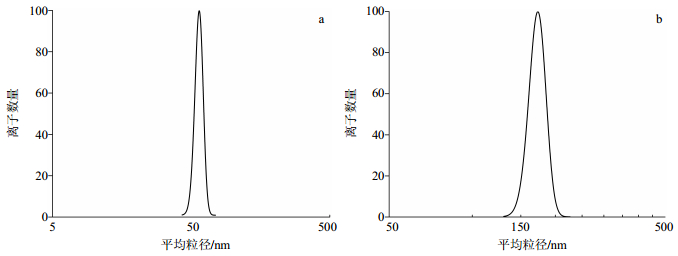
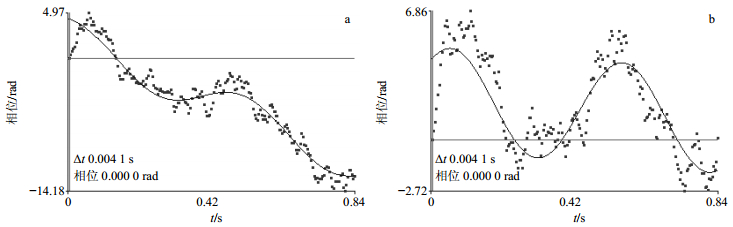
2.3 最优工艺验证及表征综合上述单因素考察结果得出制备CNLP最优工艺:Cur质量浓度8 mg/mL、溶剂与反溶剂比1:5、表面活性剂P80用量0.05%、沉积时间5 min、搅拌速率400 r/min、甘露醇与Cur质量比4:1。在最优条件下制备CNLP,其正态分布曲线如图 1所示,图 1-a为CN混悬液,其平均粒径为(50.9±2.3)nm,图 1-b为CNLP经过复溶后样品,其平均粒径为(172.2±4.6)nm;CN混悬液和CNLP复溶液Zeta电位如图 2所示,其电位为(-15.1±2.9)和(-19.7±3.7)mV;SEM图谱如图 3所示,图 3-a为Cur原粉,呈不规则的大块状,粒径在20μm左右。图 3-b为CN冻干粉,呈不规则的均匀的块状结构,粒径在170 nm左右,与原粉相比粒径明显减小。从以上CNLP的形态来看,由激光粒度仪测得的CNLP平均粒径是基本一致的。甘露醇作为冻干保护剂时,会将CN均匀地分散开,而不会破坏粒子结构,在冻干过程中起到框架支撑作用,能够很好地将CN分散均匀。在冷冻干燥过程中,粒径产生团聚,导致粒径增大,因此,冻干粉复溶后的平均粒径大于混悬液平均粒径。
|
图 1 CN混悬液(a)和CNLP复溶液(b)的平均粒径正态分布曲线(n=3) Fig.1 Normal distribution curves of mean particle size of CN suspension (a) and redispersion fluid of CNLP (b) (n=3) |
|
图 2 CN混悬液(a)和CNLP复溶液(b)的Zeta电位图(n=3) Fig.2 Zeta potential diagrams of CN suspension (a) and redispersion fluid CNLP (b) (n=3) |

|
图 3 Cur原粉(a)和CNLP (b)的SEM图谱 Fig.3 SEM graphs of raw curcumin powder (a) and CNLP (b) |
2.4 体外溶出检测 2.4.1 HPLC色谱分析条件
液相色谱柱Diamonsil反相C18(150 mm×4.6 mm,5μm);流动相为乙腈-4%冰乙酸水溶液(48:52),柱温30℃,检测波长430 nm,体积流量1.0 mL/min,进样量20μL。
2.4.2 饱和溶解度检测本研究采用去离子水、人工胃液和人工肠液作为溶出介质。人工胃液配制方法:用5 mL 37%盐酸和1 000 mL的去离子水制成混合溶液。人工肠液的配制方法:将6.8 g/L磷酸二氢钾加水500 mL溶解,用氢氧化钠将溶液的pH值调至6.8,加水稀释至1 000 mL。
将过量的Cur原粉、CNLP和物理混合物(Cur、甘露醇、P80的比例和CNLP相同)分别加入到2 mL溶出介质(去离子水、人工胃液、人工肠液)中,水浴温度(37.0±0.5)℃,搅拌速率100 r/min,连续搅拌48 h后,取1 mL样品,再以10 000 r/min的速率离心5 min,取上清液20μL进行HPLC检测。检测分析条件按照“2.4.1”项色谱条件检测。实验重复3次,取平均值。
如表 1所示,根据标准曲线计算回归方程Y=135 472 582.065 6 X-100 339.948 7(R2=0.999 9),得出Cur原粉、CNLP和物理混合物(Cur、甘露醇、P80)在不同溶出介质中的饱和溶解度。在去离子水溶出介质中,Cur原粉、CNLP和物理混合物的饱和溶解度分别为15.44、636.4、16.35μg/mL,CNLP饱和溶解度是原粉的41.32倍;在人工胃液溶出介质中,Cur原粉、CNLP和物理混合物的饱和溶解度分别为52.38、91.23、50.02μg/mL,CNLP饱和溶解度是原粉的1.74倍;在人工肠液溶出介质中,Cur原粉、CNLP和物理混合物的饱和溶解度分别为5.47、22.48、8.03μg/mL,CNLP饱和溶解度是原粉的4.11倍。因此,可以看出能够改变粒径大小的因素并不是加了甘露醇和P80的原因,而是通过反溶剂法的重结晶过程来改变Cur粒径大小的,加入P80的原因是起到表面活性剂的作用,增加了重结晶过程中粒子的表面活性,起到分散作用,而加入甘露醇的原因是在冻干过程中为了防止粒子的聚合,起到框架支撑作用。从而使得到的CNLP粒径小、比表面积大,在去离子水、人工胃液、人工肠液中的饱和溶解度远高于原粉,因此服用同样剂量的药物,纳米粒能够更好地在体内吸收、发挥药效。
|
|
表 1 Cur原粉、CNLP和物理混合物的饱和溶解度 Table 1 Saturated solubility of raw curcumin powder, CNLP, and physical mixture |
2.4.3 溶出度检测
将去离子水、人工胃液和人工肠液作为溶出介质,搅拌速度100 r/min,水浴温度(37.0±0.5)℃。称取26 mg Cur原粉和Cur质量为26 mg的CNLP分别加入200 mL去离子水中,称取5.2 mg Cur原粉和Cur质量为5.2 mg的CNLP分别加入200 mL人工胃液中,称取3 mg Cur原粉和Cur质量为3 mg的CNLP分别加入200 mL人工肠液中,并且在10、20、30、45、60、90、180、240、360、480、600、720 min时间点上进行溶出取点。每次取5 mL,每次取完样品溶液后重新添加5 mL溶出介质,再以10 000 r/min的速率离心5 min,取上清液20μL直接进行HPLC检测,检测分析条件按照“2.4.1”项色谱条件检测。实验重复3次,取平均值。然后计算出Cur原粉和CNLP在3种不同介质中的累积溶出率。
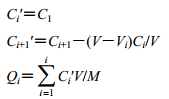
|
C1表示第1个取样点药物质量浓度,Ci表示每个时间点中取样样品中的药物质量浓度,Ci′为每个时间间隔药物质量浓度增加量,V为溶出介质的总体积,Vi为每次取样体积,M为药物质量,Qi为每个取样点上溶出速率
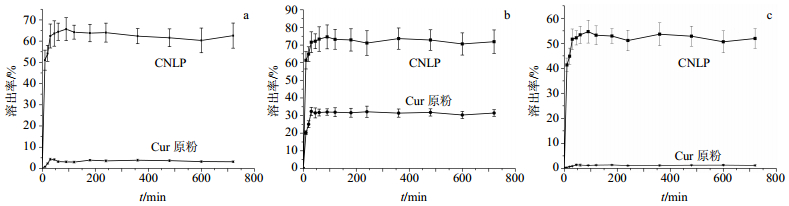
由于物理混合方法(Cur原粉、甘露醇和P80)不能提高Cur在3种介质中的溶解度,排除了干扰因素。所以本课题只做了Cur原粉和CNLP在3种介质中的溶出实验。图 4-a为Cur原粉和CNLP在水中溶出曲线,在溶解度实验开始30 min内,Cur原粉的溶出率为4.3%,CNLP的溶出率已经达到了62.4%,是原粉的14.51倍。图 4-b为Cur原粉和CNLP在人工胃液中的溶出曲线,在溶解度实验开始90 min内,Cur原粉的溶出率为32.02%,CNLP的溶出率已经达到了74.65%,是原粉的2.33倍。图 4-c为Cur原粉和CNLP在人工肠液中的溶出曲线,在溶解度实验开始90 min内,Cur原粉的溶出率为1.22%,CNLP的溶出率已经达到了54.65%,是原粉的44.79倍。在3种溶出介质中,CNLP的溶出率较原粉均有显著提升,这应归因于CNLP的粒径减小、比表面积大,增加了Cur的溶解度。Noyes-Whitney方程指出,药物的溶解速度与药物在溶剂中的表面积呈正比[24]。因为该药纳米粉的粒径减小,增大了与溶出介质接触的表面积,所以与Cur原粉相比,低结晶度和药物粒径小的CNLP有较高的溶解速率和溶解度,可以使CNLP能够更好地在体内吸收,提高了Cur在体内的生物利用度,为其体外与体内相关性分析提供了有利依据。
|
图 4 CNLP和Cur原粉在去离子水(a)、人工胃液(b)和人工肠液(c)中溶出曲线 Fig.4 Dissolution profiles of CNLP and raw curcumin powder in deionized water (a), simulated gastric fluid (b), and simulated intestinal fluid (c) |
3 讨论
本实验利用单因素实验对CNLP的制备工艺进行优化。采用反溶剂法对药物溶液质量浓度、表面活性剂用量、溶剂与反溶剂比、沉积时间、搅拌速率、冻干保护剂用量6个因素进行考察研究,总结出CNLP的最优制备条件如下:药物溶液质量浓度为8 mg/mL、表面活性剂用量为0.05%、溶剂与反溶剂比为1:5、沉积时间为5 min、搅拌速率为400 r/min、Cur与甘露醇的质量比为1:4。在上述最优条件下,所得CNLP复溶后的平均粒径为172.2 nm。通过溶解度检测,在去离子水中,CNLP的饱和溶解度是原粉的41.32倍;在人工胃液溶出介质中,CNLP饱和溶解度是原粉的1.74倍;在人工肠液溶出介质中,CNLP饱和溶解度是原粉的4.11倍。通过溶出率检测,同等时间内,在去离子水中,CNLP的溶出率是原粉的14.51倍;在人工胃液中,CNLP的溶出率是原粉的2.33倍;在人工肠液中,CNLP的溶出率是原粉的44.79倍。通过反溶剂法得到的CNLP粒径小,在去离子水、人工胃液、人工肠液中的溶解度和溶出速率远高于原粉。
本实验以水溶性差药物Cur为研究对象,考察了反溶剂法制备CNLP的可行性,并确定了最佳制备工艺条件。CNLP的粒径的减小增大了药物的比表面积,从而带来了溶解度和溶出率的提高,使得药物更好被吸收。本研究为提高Cur类药物的生物利用度提出了新思路。
| [1] | 余美荣, 蒋福升, 丁志山. 姜黄素的研究进展[J]. 中草药 , 2009, 40 (5) :828–831. |
| [2] | Guo L D, Chen X J, Hu Y H, et al. Curcumin inhibits proliferation and induces apoptosis of human colorectal cancer cells by activating the mitochondria apoptotic pathway[J]. Phytother Res , 2013, 27 (3) :422–430. DOI:10.1002/ptr.v27.3 |
| [3] | 刘春艳.姜黄的化学成分研究[D].沈阳:沈阳药科大学, 2008. |
| [4] | 袁鹏, 陈莹, 肖发, 等. 姜黄素的生物活性及在食品中的应用[J]. 食品工业科技 , 2012, 33 (14) :371–375. |
| [5] | 赵丽艳, 余秀娟, 韩天云, 等. 姜黄素神经保护作用研究进展[J]. 神经药理学报 , 2012, 2 (2) :58–64. |
| [6] | Agnihotri N, Mishra P C. Scavenging mechanism of curcumin toward the hydroxyl radical: A theoretical study of reactions producing ferulic acid and vanillin[J]. J Phys Chem A , 2011, 115 (49) :14221–14232. DOI:10.1021/jp209318f |
| [7] | 许东晖, 王胜, 金晶, 等. 姜黄素的药理作用研究进展[J]. 中草药 , 2005, 36 (11) :1737–1740. |
| [8] | 郑玉强, 邓立普. 姜黄素药理作用研究进展[J]. 辽宁中医药大学学报 , 2011, 13 (2) :212–214. |
| [9] | 胡铭, 翟延君, 刘洋. 纳米中药技术的应用与前景评析[J]. 中医药学刊 , 2002, 20 (2) :163–165. |
| [10] | 王春战, 景华. 姜黄素抗炎抗氧化作用的研究进展[J]. 医学研究生学报 , 2012, 25 (6) :658–660. |
| [11] | 杨雁, 钟杰, 沈志刚, 等. 头孢拉定微粉化的研究[J]. 北京化工大学学报 , 2004, 31 (3) :15–17. |
| [12] | 宋湘玲.反溶剂重结晶法制备超细萘普生颗粒的研究[D].北京:北京化工大学, 2007. |
| [13] | 胡婷婷, 乐园, 降立川, 等. 反溶剂重结晶法制备布地奈德超细颗粒及其肺部给药体外评价[J]. 高校化学工程学报 , 2009, 23 (1) :99–104. |
| [14] | 许文佳, 赵修华, 祖元刚, 等. 反溶剂法制备甘草酸纳米粒的表征与体外透皮特性研究[J]. 中草药 , 2014, 45 (8) :1068–1071. |
| [15] | 赵修华, 刘影, 王卫国, 等. 微粉化反式肉桂酸的反溶剂重结晶法制备与表征[J]. 中草药 , 2014, 45 (15) :2165–2171. |
| [16] | 孟路华, 赵怡, 潘黎军, 等. 维生素A-姜黄素脂质体的制备及细胞毒性研究[J]. 中国药学杂志 , 2011, 46 (14) :1104–1107. |
| [17] | Song F, Zhang L, Yu H X, et al. The mechanism underlying proliferation-inhibitory and apoptosis-inducing effects of curcumin on papillary thyroid cancer cells[J]. Food Chem , 2012, 132 (1) :43–50. DOI:10.1016/j.foodchem.2011.10.024 |
| [18] | 李秀英, 郑力, 姜同英, 等. 姜黄素鼻用微乳凝胶剂的制备及性质考察[J]. 沈阳药科大学学报 , 2010, 27 (2) :98–104. |
| [19] | 刘延敏, 王传胜, 韩刚, 等. 姜黄素固体分散体的制备及体外溶出度测定[J]. 哈尔滨医科大学学报 , 2006, 40 (4) :327–328. |
| [20] | 孙冬妮, 吴烨, 牛垒, 等. 姜黄素长循环固体脂质纳米粒的制备及其理化性质[J]. 中国药剂学杂志 , 2011, 9 (6) :105–112. |
| [21] | 苏旬, 贺秀丽, 刘秀菊, 等. 姜黄素的临床研究进展[J]. 食品与药品 , 2012, 14 (5) :193–198. |
| [22] | Tripanichkul W, Jaroensuppaperch E O. Curcumin protects nigrostriatal dopaminergic neurons and reduces glial activation in 6-hydroxydopamine hemiparkinsonian mice model[J]. Int J Neurosci , 2012, 122 (5) :263–270. DOI:10.3109/00207454.2011.648760 |
| [23] | 曲秋莲, 张英鸽. 纳米技术和材料在医学上应用的现状与展望[J]. 东南大学学报 , 2011, 30 (1) :157–163. |
| [24] | 谢玉洁, 王洁欣, 乐园, 等. 反溶剂重结晶法制备阿奇霉素超细粉体[J]. 北京化工大学学报 , 2011, 38 (3) :17–21. |
 2016, Vol. 47
2016, Vol. 47


