2. 广东医学院, 广东 东莞 523808
2. Guangdong Medical College, Dongguan 523808, China
介孔硅纳米粒子(mesoporous silica nanoparticles,MSNs)是20世纪90年代迅速兴起的一种新型有序介孔纳米材料,具有纳米孔道结构规则、孔径可在2~50 nm连续可调、表面基团易于修饰、生物相容性良好等优点,目前以MSNs为基础的多功能传输载体研究非常广泛[1-4]。通过MSNs表面功能化修饰,利用官能化的高分子、纳米粒子、蛋白质等作为纳米阀门,将药物封装在孔道内部实现药物因pH值、生物环境等条件变化,实现在组织内部的可控制释放[5-6]。但是,由于其粒径较大,这一类传输载体在水溶液中容易聚集、沉淀,从而限制其应用。聚乙二醇(PEG)具有良好的生物相容性、生物安全性和水溶性,利用PEG化学修饰纳米粒子、纳米胶束,可提高载体的水分散性和缓释能力[7-8]。丹参素是从丹参中提取的一种水溶性的有效成分,具有舒张血管、保护心肌细胞、抗炎、抗氧化作用[7, 9]。但是丹参素在碱性条件下易发生自氧化,并且有研究发现丹参素生物利用度较低[8]。为了提高丹参素的稳定性和循环释放时间,本研究通过点击化学法,在MSNs表面引入PEG链段,制备了一系列负载丹参素的MSNs-PEG传输载体,并系统考察了该传输载体的形态及药物的释放规律。
1 仪器与材料Nicolet MX-1E红外光谱(FTIR)仪,德国Bruker公司;JEM-100CX透射电子显微镜(TEM),日本电子株式会社;Zeta PALS电位分析仪,美国Brookhaven;Rigaku Ultima IV diffractometer射线粉末衍射(XRD),日本理学株式会社;TU1900紫外分光光度计,北京普析仪器有限公司。
3-氯丙基三乙氧基硅烷(CPTES)、正硅酸乙酯(TEOS)、十六烷基三甲基溴化铵(CTAB)、叠氮化钠、五水硫酸铜、抗坏血酸钠、对甲苯磺酰氯(TsCl)等购于安耐吉化学试剂公司;聚乙二醇(PEG,相对分子质量25 000)、聚乙烯酰亚胺(PEI,相对分子质量25 000)、2-炔丙胺购于Sigma-Aldrich公司;胎牛血清、杜氏改良液(DMEM液)、青霉素-链霉素、四甲基偶氮唑蓝(MTT)和胰蛋白酶购于美国Gibco公司;丹参素钠,相对分子质量220.16,质量分数99%,广州市药品检验所,批号090843-201309;其他试剂用为分析纯。
2 方法与结果 2.1 MSNs-PEG纳米传输载体的制备 2.1.1 合成含叠氮基的MSNs(MSN-N3)3-叠氮基丙基三乙氧基硅烷(APTES)的合成采用文献方法[10]。1.0 g CTAB溶于480 mL水与3.5 mL 2.0 mol/L NaOH溶液中,升温至70℃,分别滴加5.0 mL(22 mmol)TEOS和不同比例APTES(TEOS-APTES 100∶5、100∶7.5、100∶10,分别命名为MSN-N35、MSN-N37.5、MSN-N310),升温至70℃,剧烈搅拌反应2 h。反应完毕,滤过沉淀物,用甲醇洗涤,将得到的产物分散在含有2 mL 37%浓盐酸的50 mL乙醇中,80℃剧烈搅拌10 h,除去CTAB,最后滤过沉淀,真空干燥,即得[10]。
2.1.2 合成端基含炔基的PEG(炔基修饰PEG)取2.0 g PEG(0.08 mmol)溶于20 mL CH2Cl2,加入到含0.38 g TsCl的吡啶(8.0 mL)溶液中,充分混合,室温反应24 h。反应完毕后,用50 mL 3 mol/L HCl萃取,有机层加入碳酸氢钠剧烈搅拌,滤过,滤液蒸干得白色粉末状粗产品。40℃搅拌下将产物溶于10 mL四氢呋喃(THF)中,滴至乙醚中,析出沉淀后滤过,真空干燥。产物与0.50 mL炔丙胺于100℃密闭反应24 h,然后冷却至室温,用CH2Cl2 20 mL萃取,饱和Na2CO3溶液反复洗涤3次后,旋转除去溶剂,真空干燥,即得[11]。
2.1.3 PEG接枝MSNs(MSNs-PEG)将0.50 g MSN-N3分散于8 mL含0.33 g(0.02 mmol)炔基修饰PEG的二甲基甲酰胺(DMF)溶液中,在室温、氮气环境中搅拌2 h。然后,先后注入0.10 mL硫酸铜(9 mg,0.03 mmol)水溶液和0.15 mL抗坏血酸钠(25 mg)水溶液,50℃、氮气条件下搅拌反应24 h[12]。离心分离,蒸馏水反复分散洗涤离心3次,除去未反应的PEG,沉淀冷冻干燥,即得。根据MSN-N3样品中叠氮基的不同接枝量,PEG接枝MSNs分别命名为MSNs-PEG5、MSNs-PEG7.5、MSNs-PEG10。
2.2 FTIR表征MSNs-PEG样品研磨成粉末,KBr压片,FTIR表征测试样品中基团的变化。图 1为MSN-N3(MSN-N35、MSN-N37.5、MSN-N310)和MSNs-PEG(MSNs-PEG5、MSNs-PEG7.5、MSNs-PEG10)的FTIR光谱。由图 1-A所示,通过TEOS前驱体与含叠氮基的硅烷偶联剂共水解缩合后,在2 110 cm-1处出现叠氮基的振动吸收峰,并且随着叠氮基数量的提高,2 110 cm-1处的吸收峰强度也随之提高,这表明通过共水解的方法,能够有效、可控地在纳米粒子中引入叠氮基[13-14]。点击化学反应后,FTIR(图 1-B)显示2 110 cm-1处的吸收峰消失,这说明纳米粒子中的叠氮基已经充分反应,并且在1 450 cm-1处出现新的吸收峰,对应为点击化学反应生成的1, 2, 3-咪唑环震动吸收峰。FTIR表明,通过化学点击法,PEG分子链成功接枝到纳米粒子。热失重数据分析表明,PEG接枝到纳米载体的量(质量分数)可达20%左右,且接枝量(质量分数)随着叠氮基数量的升高而升高。
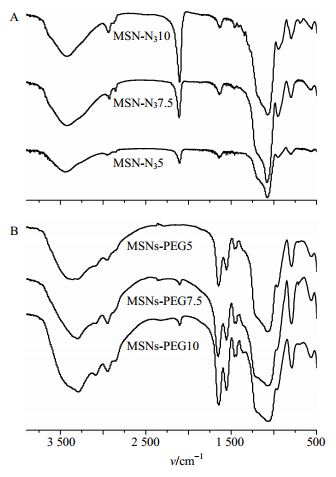
|
图 1 MSN-N3 (A)和MSNs-PEG (B)样品的FTIR图 Fig.1 FTIR spectra of MSN-N3 (A) and MSNs-PEG (B) samples |
2.3 MSNs-PEG形态表征
将样品粉末超声分散在水中。取适量滴加到铜网上,TEM观察纳米粒子形态;通过Zeta电位分析仪测定纳米粒子的粒径;样品研磨成粉末,XRD表征材料的有序结构,Cu靶辐射,1°~10°散射角观察。图 2为不同PEG接枝量的MSNs-PEG纳米粒子(MSNs-PEG5、MSNs-PEG7.5、MSNs-PEG10)的TEM照片,从图 2-A可以看出,通过溶胶-凝胶法制得的MSNs粒径分散均匀,约100 nm左右,并且表面具有明显的孔道结构,药物分子可以封装到这些孔道中,提高载体的负载能力。由图 2-B~D可以看出,MSNs接枝PEG分子链后,可以清楚地观察到纳米粒子表面的聚合物层,粒子与粒子之间产生了一定的粘连,这也充分说明了PEG分子链成功接枝到MSNs纳米粒子上。同时在纳米粒子表面能够清楚地观察到平行条带,这表明纳米粒子接枝后,载体仍然能够有效地维持纳米粒子的介孔结构。
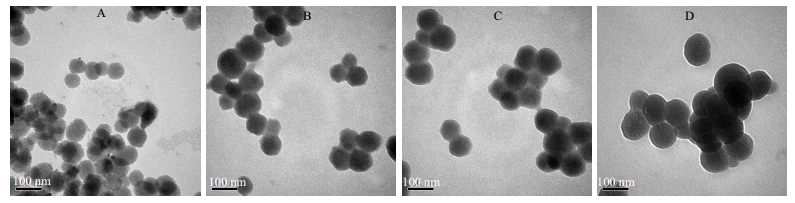
|
图 2 MSN-N3 (A)、MSNs-PEG5 (B)、MSNs-PEG7.5 (C)和MSNs-PEG10 (D)样品的TEM照片 Fig.2 TEM images of MSN-N3 (A), MSNs-PEG5 (B), MSNs-PEG7.5 (C), and MSNs-PEG10 (D) |
粒度分析结果显示MSNs、MSNs-PEG5、MSNs-PEG7.5、MSNs-PEG10的平均粒径分别为(106.0±18.7)、(118.0±22.5)、(126.0±17.1)、(136.0±10.9)nm,表明随着PEG接枝量的提高,纳米粒子的粒径随之提高,粒径可控制在150 nm左右。MSNs-PEG的Zeta电位均趋向于0 mV,主要是由于亲水性的PEG链能在MSNs的外层形成中性的PEG水化层,降低纳米胶束的电负性,能够有效地提高MSNs-PEG纳米粒子在水溶液中的稳定性。
XRD(图 3)显示了纳米传输载体在100、110、200有3个面,这也说明点击化学反应并没有破坏纳米粒子有序结构,纳米粒子接枝PEG后,依然能够保持粒子的介孔结构[15]。
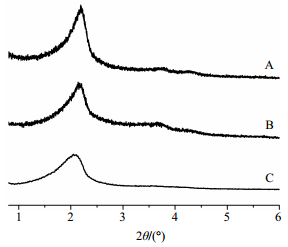
|
图 3 MSNs-PEG5 (A)、MSNs-PEG7.5 (B)和MSNs-PEG10 (C)样品的XRD图 Fig.3 XRD patterns of MSNs-PEG5 (A), MSNs-PEG7.5 (B), and MSNs-PEG10 (C) |
2.4 MSNs-PEG安全性考察
MTT法测定载体的体外细胞毒性。将293T细胞接种于含有DMEM(含10%胎牛血清)的96孔细胞培养板(1×104细胞/孔)中,每孔培养基终体积为200μL,37℃、5% CO2环境下培养24 h,待细胞长到80%左右,吸去培养液,加入无血清培养液,在细胞孔中加入不同质量浓度的载体溶液,每个浓度组设5个复孔。24 h后,每孔加入20μL MTT,继续培养箱内孵育,4 h后将培养基和MTT吸出,加入150μL DMSO,摇床摇匀15 min,在酶标仪上490 nm波长处检测吸光度(A490)值。根据下面的公式计算细胞存活率:细胞存活率=A490样品/A490对照,其中A490样品、A490对照分别在MSNs-PEG和聚乙烯酰亚胺(PEI)下获得。结果如图 4所示,由图 4可以看出,PEG化的MSNs显示出较低的细胞毒性和良好的生物相容性,细胞的存活率可以维持在90%以上,说明纳米粒子不会影响细胞的生长。并且从图 4中可以看出,在不同浓度样品溶液中,细胞存活率基本随着PEG接枝量的提高而提高,这也说明了在载体中引入PEG分子链,能够有效提高MSNs-PEG传输载体的生物安全性和降低细胞毒性。
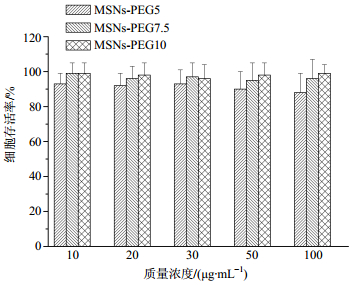
|
图 4 MTT法评价MSNs-PEG纳米粒子的安全性 Fig.4 Safity evaluation of various MSNs-PEG by MTT |
2.5 丹参素/MSNs-PEG载体制备及丹参素的定量分析 2.5.1 负载丹参素载体的制备
取PEG不同接枝量的MSNs-PEG样品50 mg,分散于5 mL含丹参素的甲醇溶液(丹参素质量浓度10.0 mg/mL)中,避光搅拌24 h,离心收集沉淀,以甲醇洗涤载体,除去未被吸附的丹参素,所得样品冷冻干燥,即得负载丹参素的丹参素/MSNs-PEG载体,4℃冰箱保存,备用。
2.5.2 丹参素标准曲线绘制丹参素定量测定方法参考课题组前期工作进行[8]:精密称取丹参素钠对照品10 mg,溶于10 mL甲醇中。分别精密吸取对照品溶液0.1、0.2、0.4、0.6、0.8、1.0 mL于10 mL量瓶中,加水稀释至刻度,摇匀。紫外分光光度计280 nm处测定A值,绘制标准曲线,进行线性回归得回归方程Y=102.71 X+8.242,r=0.999 9,线性范围为10.2~102.0μg/mL。
2.5.3 精密度试验精密吸取丹参素低、中、高质量浓度(10.2、51.0、102.0μg/mL)对照品溶液3 mL,分别于1 d内测定5次,连续测定3 d,记录A值,计算日内及日间精密度。日内精密度RSD分别为0.92%、1.15%、1.67%,日间精密度RSD分别为1.07%、0.88%、0.92%,符合方法学要求。
2.5.4 稳定性试验分别称取不同负载丹参素的载体0.10 g,加入pH 7.4的PBS缓冲液10 mL,在37℃水浴中释放。吸取释放液的供试品溶液,分别测定0、0.5、1、2、4、7、10 h时A值。结果表明,A值的RSD为1.63%,表明在10 h内样品溶液稳定性良好。
2.5.5 重复性试验精密吸取同一批丹参素/PEG-MSNs释放液的供试品溶液3 mL,连续测定5次,测定A值,RSD为1.89%。
2.5.6 加样回收率试验精密量取5份已测定的丹参素/MSNs-PEG释放液所制备的的供试品溶液2.5 mL,加入含丹参素10.2μg/mL的对照品溶液0.5 mL,摇匀制成5份供试液,分别测定A值,计算回收率,丹参素的平均回收率为(99.60±0.97)%,RSD为1.29%。
2.5.7 包封率及载药量的测定采用“碱破壳”方法测定载药量,利用标准曲线计算出丹参素的载药量和包封率,其载药量和包封率分别为6.8%和22.8%。具体步骤如下:称取20 mg丹参素/MSNs-PEG,加入20 mL 0.20 mol/L的NaOH溶液中,震荡反应24 h,用紫外-可见分光光度计测定A值,根据标准曲线计算丹参素的质量浓度,分别按照下面的公式计算丹参素/MSNs-PEG颗粒的载药量和包封率,重复实验3次取平均值。

|
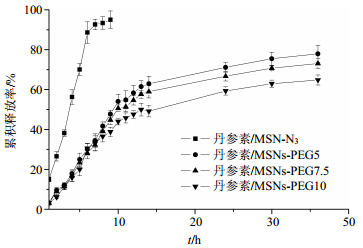
分别称取负载丹参素的载体0.10 g,加入pH 7.4的PBS缓冲液10 mL,在37℃水浴中进行释放。分别于1、2、3、4、5、6、7、8、9、10、11、12、24、36 h取样3 mL,同时用pH 7.4的PBS缓冲液补足取出量。每个样品取3个重复样品进行测定。以时间为横坐标,药物的累积释放率为纵坐标作图,结果见图 5。
|
图 5 MSNs-PEG纳米传输载体负载丹参素的累积释放率(n=3) Fig.5 Cumulative release rate of drug released from MSNs-PEG nanocarriers (n=3) |
控制和延缓药物的释放可提高药物的疗效,因而药物的释放速率是评价药物传递系统的一个重要指标。采用美国FDA推荐使用的相似因子(f2)法评价体外释放曲线差异,以考察其内在质量的相似性[16-17]。f2数值的大小量度了2条释放曲线之间累积释放率的相似性。f2越小,表明2条释放曲线差异越大,如果f2<50,可认为2条释放曲线具有不同的释放特点。以丹参素/MSN-N3释放曲线为参比,丹参素/MSNs-PEG5、丹参素/MSNs-PEG7.5和丹参素/MSNs-PEG10的f2分别为23.6、21.7和19.5,这个结果表明,PEG接枝到MSN粒子上,极大地改变了丹参素的释放规律。
从图 5中可以看出,随着PEG接枝量的增加,丹参素的累积释放率急剧下降。从累积释放曲线可看出,没有PEG修饰过的MSNs,丹参素的释放速度非常快,在前5 h时,累积释放率已经超过70%,处于爆释状态[18],10 h左右时,药物释放已经基本达到平衡。而PEG接枝MSNs后,使丹参素的释放速度明显得到控制,释药曲线相对比较平稳,在10 h时,累积释放率达到50%左右,并且随着PEG接枝量的提高,10 h时的累积释放率下降到40%左右。这表明增加PEG接枝量的提高,可以有效控制药物的释放速率,降低药物初期的爆释。
3 讨论MSNs接枝PEG的接枝量主要是通过MSNs中叠氮基的数量来控制,而叠氮基是通过硅烷偶联剂与前驱体共水解缩合的方法定量引入。从理论上讲,叠氮基的数量可以在很大的范围内调节,但是实验中发现,含有叠氮基的硅烷偶联剂质量分数超过15%时,会导致纳米粒子的介孔结构消失,TEM照片很难观察到粒子表面的有序结构。因此在制备传输载体时,控制硅烷偶联剂的质量分数不超过10%,保持MSNs的结构基本一致。
FTIR是表征PEG链段能否有效接枝到MSNs粒子上的有力测试手段,通过表征样品中叠氮基的数量,可以确定MSNs粒子中叠氮基反应程度。从FTIR测试结果看,MSNs粒子中叠氮基基本消失,这说明定量引入的叠氮基,可以定量的引入PEG链段。TEM和XRD测试结果表明,PEG能够有效接枝到MSNs上,并且能够保持纳米粒子的介孔特性;粒度分析结果显示,PEG修饰的介孔硅纳米粒子粒径保持在100~150 nm。有效的粒径控制和PEG的引入,使纳米粒子在水中具有良好的水分散性和稳定性。
通过负载丹参素发现,纳米粒子的介孔结构能够大量负载丹参素,这有利于提高载体的负载率和负载效率,为高效的传输载体提供了基础。亲水性的PEG接枝MSNs粒子,在纳米粒子外层形成水化层,能够有效提高MSNs-PEG纳米粒子在水溶液中稳定性,而且PEG的接枝,改变了药物的释放规律,能够有效延长丹参素的释放时间,并随着PEG接枝量的提高,能够有效控制丹参素的释放速度。
| [1] | Argyo C, Weiss V, Bräuchle C, et al. Multifunctional mesoporous silica nanoparticles as a universal platform for drug delivery[J]. Chem Mater , 2014, 26 (1) :435–451. DOI:10.1021/cm402592t |
| [2] | Goel S Y, Chen F, Hong H, et al. EGF121 conjugated mesoporous silica nanoparticle: A tumor targeted drug delivery system[J]. ACS Appl Mater Interfaces , 2014, 6 (23) :21677–21685. DOI:10.1021/am506849p |
| [3] | Lee J E, Lee N, Kim T, et al. Multifunctional mesoporous silica nanocomposite nanoparticles for theranostic applications[J]. Acc Chem Res , 2011, 44 (10) :893–902. DOI:10.1021/ar2000259 |
| [4] | 唐佳民, 张瑞涛. 介孔二氧化硅纳米粒的研究进展[J]. 现代药物与临床 , 2015, 30 (11) :1422–1426. |
| [5] | 李菲菲, 张馨欣, 郭仕艳, 等. pH敏感性的脂质-介孔硅核/壳纳米粒作为抗肿瘤药物新型载体的初步研究[J]. 药学学报 , 2013, 48 (2) :291–297. |
| [6] | Lin J T, Wang C, Wang G H. Mesoporous silica nanoparticles with controlled loading of cationic dendrimer for gene delivery[J]. Mater Res Express , 2014, 1 (3) :035403. DOI:10.1088/2053-1591/1/3/035403 |
| [7] | 徐元超, 杨屹, 杜立波, 等. 丹参素自氧化与促氧化机理[J]. 物理化学学报 , 2010, 26 (7) :1737–1741. |
| [8] | 赵广荣, 田莉莉, 王长松. 丹参素的抗癌活性研究[J]. 药物评价研究 , 2010, 33 (3) :180–182. |
| [9] | 林坚涛, 张衍宁, 黄浩, 等. 静电纺丝法制备丹参素-聚己内酯纳米纤维支架[J]. 中草药 , 2014, 45 (13) :1850–1855. |
| [10] | Schlossbauer A, Schaffert D, Kecht J, et al. Click chemistry for high-density biofunctionalization of mesoporous silica[J]. J Am Chem Soc , 2008, 130 (38) :12558–12559. DOI:10.1021/ja803018w |
| [11] | Oliveira J R, Martins M C L, Mafra L, et al. Synthesis of an O-alkynyl-chitosan and its chemoselective conjugation with aPEG-like amino-azide through click chemistry[J]. Carbohydr Polym , 2011, 87 (1) :240–249. |
| [12] | Deng J J, Zhou Y F, Xu B, et al. Dendronized chitosan derivative as a biocompatible gene delivery carrier[J]. Biomacromolecules , 2011, 12 (3) :642–649. DOI:10.1021/bm101303f |
| [13] | Zhang G G, Liu J, Yang Q Z, et al. Disulfide-containing brushed polyethylenimine derivative synthesized by click chemistry for nonviral gene delivery[J]. Bioconjugate Chem , 2012, 23 (6) :1290–1299. DOI:10.1021/bc300133r |
| [14] | Deng J J, Li N, Mai K J, et al. Star-shaped polymers consisting of a cyclodextrin core and poly(amidoamine) dendron arms: binding and release studies with methotrexate and siRNA[J]. J Mater Chem , 2011, 21 (14) :5273–5281. DOI:10.1039/c0jm03030a |
| [15] | Chen Y, Chen H R, Zhang S J. Multifunctional mesoporous nanoellipsoids for biological bimodal imaging and magnetically targeted delivery of anticancer drugs[J]. Adv Funct Mater , 2011, 21 (2) :270–278. DOI:10.1002/adfm.201001495 |
| [16] | 祝丽欣, 陈芝, 郭莹, 等. f2相似因子法评价银杏酮酯缓释微丸大类成分总黄酮和各类成分的体外释放相关性研究[J]. 中草药 , 2015, 46 (23) :3482–3489. |
| [17] | 谢沐风. 溶出曲线相似性的评价方法[J]. 中国医药工业杂志 , 2009, 40 (4) :308–310. |
| [18] | 李玉慧, 袁亚莉, 徐文慧, 等. 两种介孔硅材料对布洛芬控制释放的研究[J]. 应用化工 , 2015, 44 (1) :30–34. |
 2016, Vol. 47
2016, Vol. 47


