2. 重庆市食品药品检验所, 重庆 401121
2. Chongqing Food and Drug Control Research Institute, Chongqing 401121, China
小大黄Rheum pumilum Maxim.为蓼科(Polygonaceae)大黄属Rheum L.砂生组小黄系多年生小草本植物的干燥根。夏末初秋花期采收,洗净,干燥即得。始载于《藏药标准》,藏药名曲玛孜,《中华本草》《全国中草药汇编》等均有收载。小大黄生于海拔3 000~4 300 m的山坡或灌丛下,分布于甘肃、青海、四川及西藏等省区,具有清热、消渴、除烦、泻黄水和恶性腹水之功效,可以用于黄水病、恶性腹水、心热烦躁、口干舌燥等[1]。目前对小大黄的相关研究较少,尤其是较全面的化学成分研究还未见报道,目前仅郑俊华等[2]使用HPLC对小大黄根与根茎中3种水溶性蒽醌苷做了定量分析。UPLC-Q-Exactive四级杆-静电场轨道阱高分辨质谱具有将四极杆离子选择和Orbitrap高分辨扫描结合,能够对复杂基质中多种痕量组分进行鉴定、定性和确认,是分析中药复杂系统的有力工具之一[3]。本研究采用UPLC-Q-Exactive四级杆-静电场轨道阱高分辨质谱联用技术对小大黄的化学成分进行较全面的定性分析,共鉴定了34个化学成分,包括蒽醌类11个、酚/酰基糖苷类4个、鞣质前体及鞣质类3个、二苯乙烯类9个、黄酮类2个、萘苷类3个、苯丁酮类2个,其中7个成分经与对照品比对而准确鉴定,28个化学成分为该植物中首次报道。为小大黄进一步的物质基础研究奠定基础。
1 仪器与材料 1.1 仪器UPLC-Q-Exactive四级杆-静电场轨道阱高分辨质谱(赛默飞世尔科技公司,美国);Ultimate 3000超高效液相色谱系统(戴安公司,美国);ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7μm,沃特世科技有限公司,美国);HX-200型高速中药粉碎机(浙江省永康市溪岸五金药具厂);ESJ200-4万分之一电子天平(沈阳龙腾电子有限公司);BT25S十万分之一电子天平(北京赛多利斯科学仪器有限公司);KQ5200E型超声波清洗器(昆山超声仪器有限公司)。
1.2 药材与试剂植物材料小大黄采集于四川省康定县雅家梗,经中国医学科学院北京协和医学院药用植物研究所黄林芳教授鉴定为小大黄Rheum pumilum Maxim.。采收后净制取根,40℃烘干保存。色谱纯甲醇(默克公司,美国),色谱纯甲酸(西格玛奥德里奇,美国),均为LC-MS级,水为纯净水(Milli-Q SP Regent Water system,美国),甲醇为分析纯(质量分数≥99.5%)。土大黄苷(批号141209)、脱氧土大黄苷(批号150820)、大黄素-8-O-β-D-吡喃葡萄糖苷(批号141209)对照品(成都曼思特生物科技有限公司);大黄酸(110757-200206)、芦荟大黄素(110795-201308)、槲皮素(110081-201509)、木犀草素(110520-200504)对照品(中国食品药品检定研究院),7种对照品质量分数均≥98%。
2 方法 2.1 供试品溶液的制备取干燥后小大黄根,粉碎,过65目筛后备用。将得到的干燥粉末精确称取1.002 g,置50 mL具塞锥形瓶中,精密量取加入甲醇25 mL,密封称定质量,在室温下超声处理1 h,待冷却至室温,再用甲醇补足减失质量,摇匀,滤过即得。
2.2 对照品溶液的制备分别精密称取芦荟大黄素、大黄酸、槲皮素、木犀草素、大黄素-8-O-β-D-吡喃葡糖糖苷、土大黄苷、脱氧土大黄苷对照品适量,置于5 mL量瓶中,加入甲醇溶解定容,制备单一对照品储备液,混合对照品溶液储备液均由各对照品储备液混合并稀释得到,均置于4℃保存。
2.3 分析条件色谱条件:色谱柱为ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7μm),流动相为甲醇(A)-0.1%的甲酸水溶液(B)。梯度洗脱:0~2 min,5%~15% A;2~5 min,15%~25% A;5~8 min,25%~35% A;8~12 min,35%~45% A;12~20 min,45%~55% A;20~25 min,55%~85% A;25~30 min,85%~95% A;30~32 min,95% A;32~32.1 min,95%~5% A;32.1~35 min,5% A;体积流量为0. 3 mL/min;进样室温度10℃;柱温35℃;进样量2μL。
质谱条件:离子源为HESI源,负离子检测模式,鞘气压力206.8 kPa;辅助气体积流量10 L/min;喷雾电压2.00 kV;离子传输管温度320℃;辅助气温度350℃;扫描模式:Full MS/dd-MS2,Full MS分辨率70 000,dd-MS2分辨率17 500,扫描范围m/z 80~1 200。MS/MS模式时,所用碰撞能为阶梯能量:30、40 eV。
2.4 数据处理使用Xcalibur 3.0软件(赛默飞科技有限公司,美国)进行质谱数据处理,通过高分辨率质谱信息推导其可能的分子式,质谱偏差范围δ≤5×10−6。
根据实验所得结果,结合中医药资料库(http://tcm.Cmu.edu.tw/zh-tw/Review.php)和中药的潜在目标数据库(http://tcm.zju.edu.cn)构建了大黄属的化学成分相关信息数据库,包含化学成分的中英文名称、分子式、相对分子质量、CAS号等。
3 结果与分析为了检测到更全面的物质信息,对提取溶剂、色谱条件、质谱条件等进行了优化,选择最优的条件对小大黄及其对照品进行质谱分析,在基峰离子流图负离子模式下显示更为丰富的信息,故选择负离子模式进行分析(除2个黄酮类成分外),总离子流图见图 1。通过UPLC-Q-Exactive四级杆-静电场轨道阱高分辨质谱,从小大黄的质谱总离子流图中选择响应较为明显的峰进行分析,共鉴定34种化合物。在这34种化合物中包括蒽醌类11个、酚/酰基糖苷类4个、鞣质前体及鞣质类3个、二苯乙烯类9个、黄酮类2个、萘苷类3个、苯丁酮类2个。其中,7个化合物通过与对照品进行比较明确识别。被鉴定化合物的相对保留时间、相对分子质量、分子式、一级质谱数据及二级质谱碎片离子见表 1。
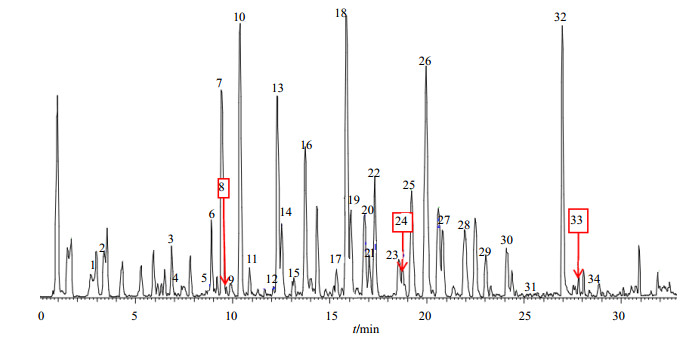
|
图 1 小大黄的总离子流图(负离子模式) Fig.1 Total ion chromatogram for roots of R. pumilum (negative ion mode) |
|
|
表 1 UPLC-Q-Exactive四级杆-静电场轨道阱高分辨质谱对小大黄中化学成分的鉴定分析(除21和23外均为负离子模式) Table 1 Identificationand analysis on chemical constituents from roots of R. pumilum by UHPLC-quadrupole-orbit trapMS (negative ion mode except 21 and 23) |
3.1 蒽醌类化合物的鉴别
蒽醌类化合物分子中,酚羟基上的O原子和苯环间存在p-π共轭,其共轭体系结构决定了其分子的稳定。其质谱选择性离子碰撞诱导解离中,失去母核基团中的CO但留存共轭体系是主要裂解方式;且其侧链R3、R6也是较为活跃的裂解部位,侧链取代基(主要为羟基、甲基、甲氧基、羧基等)容易以O、H2O、CH3、CH2、CO2等中性小分子片段的形式离去,见图 2。其糖苷类化合物一般先失去糖基,再继续蒽醌类化合物的共性反应。本实验中,对峰30、31、32、33、34(即芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚)进行裂解途径分析,见图 3。
|
图 2 蒽醌类化合物质谱裂解部位 Fig.2 MS Fragmentation position of anthraquinones |
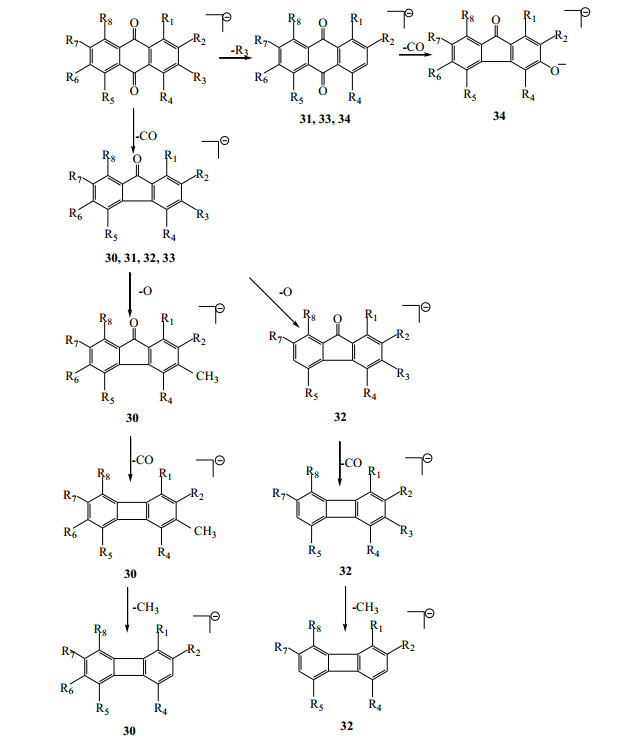
|
图 3 小大黄中部分蒽醌类化合物质谱裂解途径推导(负离子模式) Fig.3 Possible fragmentation pathway of some anthraquinones (negative ion mode) in roots of R. pumilum |
峰31 m/z 283.061 9、峰33 m/z 253.050 9、峰34 m/z 283.061 9由蒽醌侧链R3部位裂解,峰31 m/z 239.071 7即在R3部位失去1分子CO2所得;峰33 m/z 239.026 7由分子离子峰失去1个-CH3所得;峰34 m/z 268.038 2由分子离子峰R3部位失去1个-CH3所得;峰34 m/z 268.038 2继续失去1分子CO得m/z 240.043 0。另1种[M-H]−裂解途径为峰30 m/z 269.046 1、峰31 m/z 283.061 9、峰32 m/z 269.046 0、峰33 m/z 253.050 9失去1分子中性分子CO后的碎片离子分别为峰30 m/z 241.043 0、峰31 m/z 255.082 6、峰32 m/z 241.050 9和峰33 m/z 225.055 6。峰30与峰32裂解途径相似,在失去1分子中性CO之后继而失去1个O产生碎片峰30 m/z 225.055 6、峰32 m/z 225.055 7;再继续失去1分子CO得到峰30 m/z 197.060 5、峰32 m/z 197.060 1,最终失去1个-CH3即得峰30 m/z 182.036 5和峰32 m/z 182.064 7。
3.2 酚/酰基糖苷类化合物中1号峰的鉴别在负离子模式下,1号峰在一级图谱中给出m/z 331.067 8,为准分子离子峰[M-H]−。在二级质谱中,[M-H]−依次丢失2分子的C2H4O2和1分子的C2H2O,出现m/z 271.046 6 [M-H-C2H4O2]−,m/z 211.024 7 [M-H-2C2H4O2]−和m/z 169.013 5 [M-H-2C2H4O2-C2H2O]−的碎片离子;m/z 169.013 5 [M-H-2C2H4O2-C2H2O]−分别丢失1分子CO2和1分子H2O,产生碎片离子m/z 125.023 4 [M-H-2C2H4O2-C2H2O-CO2]−和m/z 151.003 5 [M-H-2C2H4O2-C2H2O-H2O]−。根据负离子模式下精确相对分子质量和二级质谱碎片信息,及与文献报道[4]比较,鉴定1号峰为没食子酸-4-O-β-D-吡喃葡萄糖。负离子模式下质谱裂解规律见图 4。
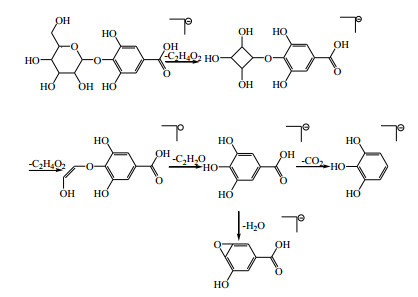
|
图 4 没食子酸-4-O-β-D-吡喃葡萄糖苷裂解途径(负离子模式) Fig.4 Fragmentation pathway of gallic acid-4-O-β-D-glucopyranoside (negative ion mode) |
3.3 二苯乙烯类化合物中14号峰的鉴别
在负离子模式下,14号峰在一级图谱中给出准分子离子峰[M-H]− m/z 541.136 5。在二级质谱中,[M-H]−有2种裂解方式,1种发生裂解丢失1分子gallate和1分子葡萄糖,出现m/z 227.071 4 [M-H-gallate-Glc]−的碎片离子;另1种[M-H]−发生裂解,失去中性分子C14H10O2和1分子H2O,产生m/z 313.057 5的碎片离子,随后失去1个中性分子C6H8O4,出现m/z 169.013 5 [M-H-C14H10O2-H2O-C6H8O4]−,继续失去1分子CO2,得到m/z 125.023 3 [M-H-C20H20O7-CO2]−碎片离子;m/z 169.013 5 [M-H-C14H10O2-H2O-C6H8O4]−还可以失去1分子H2O,产生m/z 151.002 8碎片离子。根据负离子模式下精确相对分子质量和二级质谱碎片信息,及与文献报道[4]比较,鉴定14号峰为白藜芦醇-4′-O-β-D-(6″-O-没食子酰基)-吡喃葡萄糖。负离子模式下质谱裂解规律见图 5。
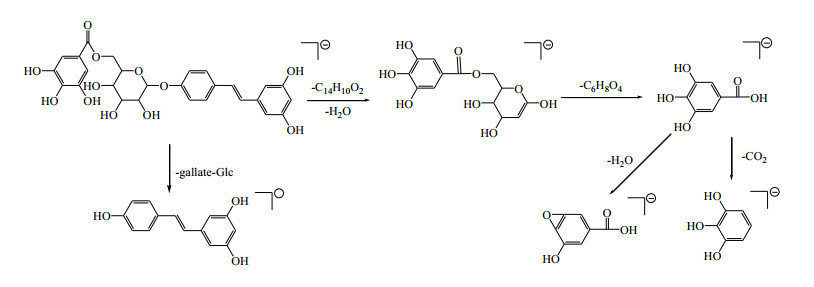
|
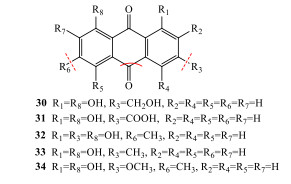
图 5 白藜芦醇-4′-O-β-D-(6″-O-没食子酰基)-吡喃葡萄糖苷裂解途径(负离子模式) Fig.5 Fragmentation pathway of resveratrol-4′-O-β-D-(6″-O-galloyl)-glucopyranoside (negative ion mode) |
3.4 萘苷类化合物中22号峰的鉴别
在负离子模式下,22号峰在一级图谱中给出m/z 407.135 6,为准分子离子峰[M-H]−,在二级质谱中,[M-H]−发生裂解先丢失1分子葡萄糖产生碎片离子峰m/z 245.082 2,随后依次丢失2CH3•和3CO,出现m/z 230.058 6 [M-H-CH3]−, m/z 215.034 6 [M-H-2CH3]−和m/z 159.043 5 [M-H-2CH3-2CO]−, m/z 131.049 5 [M-H-2CH3-3CO]−碎片离子。根据负离子模式下精确相对分子质量和二级质谱碎片信息,及与文献报道[4]比较,鉴定22号峰为决明酮-8-O-β-D-吡喃葡萄糖苷。负离子模式下质谱裂解规律见图 6。
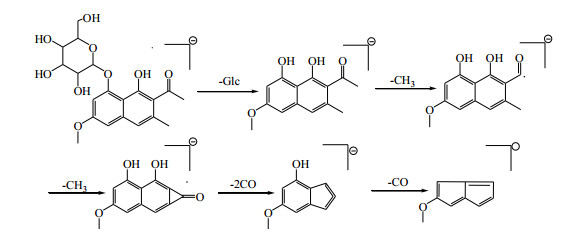
|
图 6 决明酮-8-O-β-D-吡喃葡萄糖苷裂解途径(负离子模式) Fig.6 Fragmentation pathway of torachrysone-8-O-β-D-glucopyranoside (negative ion mode) |
3.5 苯丁酮类化合物中11号峰的鉴别
在负离子模式下,11号峰在一级图谱中给出m/z 477.141 5,为准分子离子峰[M-H]−,在二级质谱中,[M-H]−发生裂解丢失1个中性分子C10H10O和1分子H2O,产生m/z 313.057 6的碎片离子;随后失去1个中性分子C6H8O4和1分子CO2,出现m/z 169.013 5和125.023 4离子。根据负离子模式下精确相对分子质量和二级质谱碎片信息,及与对照品和文献报道[4]比较,鉴定11号峰为莲花掌苷。负离子模式下质谱裂解规律见图 7。
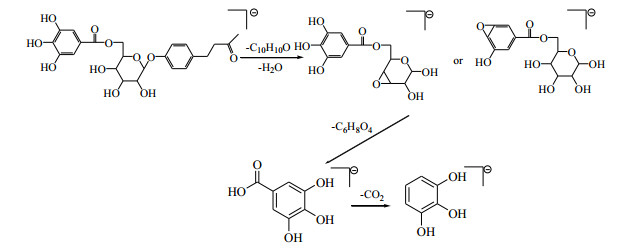
|
图 7 莲花掌苷裂解途径(负离子模式) Fig.7 Fragmentation pathway of lindleyin (negative ion mode) |
4 讨论
本实验通过建立小大黄成分数据库、检索公共数据库及确认等基础上,结合UPLC-Q-Exactive四级杆-静电场轨道阱,共鉴定了34种化合物。在这34种化合物中包括蒽醌类11个、酚/酰基糖苷类4个、鞣质前体及鞣质类3个、二苯乙烯类9个、黄酮类2个、萘苷类3个、苯丁酮类2个,其中除大黄酸、大黄酸8-O-β-D-吡喃葡萄糖苷、大黄素-8-O-β-D-吡喃葡萄糖苷、大黄酚-8-O-β-D-吡喃葡萄糖苷、莲花掌苷、儿茶素葡萄糖苷[10] 6个成分外,其他28个化学成分均为首次在小大黄中鉴定。
大黄属植物在藏医药中使用历史悠久,入药品种也较多,其中小大黄一般列为下品(藏药名:曲玛孜),并认为小大黄功效较弱[11]。本研究发现《中国药典》2015年版大黄项下定量测定中的芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚在小大黄中均被检测到,其中除大黄酸外的4个《中国药典》指标成分首次被报道,鉴定出的34种成分也与大黄属其他植物成分种类相近,说明藏医用小大黄与大黄的功效上差异需要更进一步研究。
UPLC-Q-Exactive四级杆-静电场轨道阱高分辨质谱联用技术,采用全扫描和正负离子切换模式进行测定,通过提取一级质谱的精确质量数进行定性和定量,自动触发二级全扫描质谱进一步提高定性的准确性,与传统的三重四级杆质谱相比较,具有ng/L至μg/L的检出限度、更高的分辨率,可以显著消除样品基质的干扰[3]。这些性能特点可以实现高灵敏度准确定性,并用于准确可靠的中草药中小分子化合物筛查。本研究对小大黄小分子化学成分群首次使用该技术进行快速分析,采用Q-Exactive的正负切换扫描模式,一次进样同时采集不同离子化的数据,结合建立的小大黄数据库,分析对照品的裂解规律,使用少量对照品即可快速分析鉴定出多个小大黄化学成分,有利于明确小大黄的物质基础,表明该方法在中草药多成分组快速分析领域具较强的能力,值得推广使用。
| [1] | 罗达尚. 新修晶珠本草[M]. 成都: 四川出版集团四川科学技术出版社, 2004 . |
| [2] | 郑俊华, 张立力, 楼之岑. 大黄属植物化学成分分析:十种大黄属植物的根与根茎中水溶性蒽苷的高压液相色谱法定量分析[J]. 冶金医药情报 , 1990, 7 (3) :92–93. |
| [3] | 王勇为. 确证定量分析新工具——Thermo Scientific Q-Exactive台式四级杆-轨道阱高分辨质谱[J]. 现代科学仪器 , 2011, 10 (5) :138–140. |
| [4] | 高亮亮.唐古特大黄、药用大黄和掌叶大黄的化学成分和生物活性研究[D].北京:北京协和医学院药用植物研究所, 2012. |
| [5] | 刘国强, 董静, 王弘, 等. 4种儿茶素类化合物电喷雾质谱裂解规律的研究[J]. 高等学校化学学报 , 2009, 8 (30) :1566–1570. |
| [6] | 张彩宁.中药虎杖雌激素活性成分及其物质基础研究[D].大连:中国科学院大连化学物理研究所, 2006. |
| [7] | 刘若冰, 刘灿辉. 四黄泻火片中土大黄苷的定性鉴别[J]. 中医药导报 , 2013, 10 (19) :88–91. |
| [8] | 段和祥, 罗文艳, 杨毅生, 等. 蒌蒿醋酸乙酯部位化学成分研究[J]. 中草药 , 2015, 46 (10) :1441–1444. |
| [9] | 马小红, 沈少林, 韩凤梅, 等. 大黄葸醌类化合物电喷雾质谱研究[J]. 湖北大学学报:自然科学版 , 2006, 12 (28) :403–406. |
| [10] | 郑俊华, 果德安. 大黄的现代研究[M]. 北京: 北京大学医学出版社, 2007 . |
| [11] | 罗达尚. 西藏地区大黄属植物的研究[J]. 中草药 , 1996 (增刊(27)) :171–173. |
 2016, Vol. 47
2016, Vol. 47


