皂角刺Gleditsiae Spina为双子叶豆科(Leguminosae)皂荚属Gleditsiae L.植物皂荚Gleditsia sinensis Lam.的干燥棘刺,又名皂刺、皂荚刺、天丁、皂角针、皂针。该植物广泛分布于中国、日本和韩国以及东南亚地区,我国主要产于江苏、湖北、河南、河北等地,全年均可采收,民间及临床应用历史悠久。据中医药文献记载,皂角刺具有消肿排脓、解毒和杀虫的功效[1-3],临床用于痈疽肿毒均有较好的治疗效果。现代药理学研究证明,皂角刺作为抗癌中药之一,可用于多种肿瘤的治疗[3-5]。
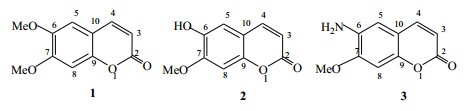
前期文献报道显示,皂角刺中主要为三萜及皂苷[4-7]、黄酮[4, 8]、酚酸[9-10]、刺囊酸糖苷[11-13]等药效成分。为进一步阐明皂角刺的抗肿瘤活性成分,本课题组对皂角刺的脂溶性化学成分作了系统研究。通过理化常数及波谱分析对分离得到的化合物进行了结构鉴定。前期曾报道了皂角刺中二氢黄酮醇类化合物的研究[14],本实验继续对河南伏牛山产的皂角刺进行研究,从其90%乙醇提取物的醋酸乙酯部位分离得到3个香豆素类化合物(结构见图 1),分别鉴定为滨蒿内酯(scoparone,1)、异东莨菪内酯(isoscopoletin,2)和6-氨基-7-甲氧基香豆素(6-amino-7-methoxycoumarin,3)。其中,化合物3为新的香豆素类化合物,命名为皂角香豆素A。化合物1~2为首次从该植物中分离得到。细胞毒活性研究显示化合物2对肺癌A549细胞有较强的增殖抑制活性。
|
图 1 化合物1~3的结构式 Fig.1 Structures of compounds 1—3 |
1 仪器与材料
高效液相-离子阱-飞行时间质谱仪(日本岛津公司);Avance 400 MHz超导核磁共振仪(瑞士Bruker公司);UV-2401紫外光谱仪(日本岛津公司);Thermo Flash EA1112型元素分析仪(美国热电集团Thermo Electron);反相半制备高相液相色谱仪(semi-preparative RP-HPLC,美国Waters 600),LH-20凝胶填料(日本三菱公司);薄层色谱硅胶GF254和柱色谱用硅胶80~100、200~300目(青岛海洋化工厂生产);其他试剂均为分析纯。
人肝癌(HepG2)、食管癌(EC109)、肺癌(A549)3种细胞株,由本实验室保存;新生牛血清,上海洛神生物技术有限公司;四甲基偶氮唑盐(MTT)和DMSO,Amresco公司;顺铂,江苏豪森药业股份有限公司。
皂角刺于2013年9月采自河南洛阳嵩县九店乡基地提供的出口原产地品种。原材料由河南科技大学农学院侯典云博士鉴定为豆科植物皂荚Gleditsia sinensis Lam.的棘刺。植物标本(ZJ-TCB-201309)存放于河南科技大学伏牛山药用植物标本馆内。
2 提取与分离干燥皂角刺10.0 kg,粉碎,用90%乙醇回流提取3次,合并提取液,室温下静置48 h。提取液减压浓缩得皂角刺乙醇浸膏共0.6 kg。浸膏中加水搅拌,使浸膏溶解完全,滤去不溶物后,依次用石油醚和醋酸乙酯萃取。醋酸乙酯部位回收溶剂后,得醋酸乙酯浸膏143 g。醋酸乙酯浸膏用硅胶柱色谱分离,经石油醚-醋酸乙酯(10:1、8:2、6:4、1:1、4:6、2:8)洗脱,收集馏份;其中收集的6:4的馏份用环己烷-丙酮(10:1、8:2、6:4、1:1、4:6、2:8)梯度洗脱,收集馏份;其中收集的8:2的馏份经三氯甲烷-甲醇(9:1、7:1、7:3、5:4、1:1、4:5、3:7、1:7)梯度洗脱,收集合并为三氯甲烷-甲醇9:1的洗脱液馏份中,有黄色固体析出,固液分离后,经丙酮重结晶得到淡黄色粒状物,为化合物1(32.0 mg)。固体析出后的母液部分被浓缩后,经Sephadex LH-20进一步分离得到化合物2(28.4 mg)。取三氯甲烷-甲醇的7:1的馏份,进一步反复用高效液相制备色谱(RP-HPLC)分离纯化,采用ODS C-18反相色谱柱(YMC-PACK ODS-A,250 mm×15 mm,5 m)等度洗脱,洗脱剂为甲醇-水(90:10),体积流量为10 mL/min,示差检测器检测,经多次重复分离得化合物3(16.3 mg)。
3 结构鉴定化合物1:淡黄色结晶(丙酮),mp 144~145℃。1H-NMR (400 MHz, CD3OD) δH: 7.85 (1H, d, J=9.4 Hz, H-3), 7.11 (1H, s, H-5), 6.77 (1H, s, H-8), 6.20 (1H, d, J=9.4 Hz, H-4), 3.87 (3H, s, -OCH3), 3.66 (3H, s, -OCH3);13C-NMR (100 MHz, CD3OD) δC: 162.1 (C-2), 153.0 (C-7), 151.6 (C-9), 146.6 (C-6), 143.6 (C-4), 112.7 (C-3), 112.1 (C-10), 109.3 (C-5), 102.4 (C-8), 56.0 (-OCH3), 53.0 (-OCH3)。以上数据与文献报道一致[15],故鉴定化合物1为滨蒿内酯。
化合物2:白色针晶(甲醇),mp 206~208℃。1HNMR (400 MHz, CD3OD) δH: 7.84 (1H, d, J=9.4 Hz, H-3), 7.10 (1H, s, H-5), 6.75 (1H, s, H-8), 6.18 (1H, d, J=9.4 Hz, H-4), 3.90 (3H, s, -OCH3), 6.90 (1H, br, -OH);13C-NMR (100 MHz, CD3OD) δC: 164.0 (C-2), 152.9 (C-7), 151.4 (C-9), 147.1 (C-6), 146.2 (C-4), 112.5 (C-3), 112.7 (C-10), 109.0 (C-5), 104.0 (C-8), 56.8 (-OCH3)。其核磁共振图谱与化合物1非常相似,相比化合物1明显少了1个甲氧基信号在δH3.66和δC 53.0 (-OCH3),提示化合物2是化合物1的衍生物。ESI-MS m/z: [M-H]− 191.16,相对分子质量为192,分子式为C10H8O4。综合以上光谱数据,结合文献报道[16-17],故鉴定化合物2为异东莨菪内酯。
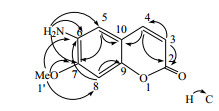
化合物3:淡黄色胶状物。HR-ESI-MS给出准分子离子峰m/z 191.058 5 [M]+(计算值191.058 2),提示化合物中含有奇数个N原子。元素分析(C:62.80,H:4.76,N:7.34,O:25.10)显示该化合物中含有10个碳、9个H、1个N和3个O原子,结合1H-NMR、13C-NMR和DEPT谱,确定化合物3的分子式为C10H9NO3。比较化合物3与化合物1的核磁共振图谱,可以明显观察到有类似的1组6, 7-二取代香豆素母核的信号(C-2~C-10;H-3、H-4、H-5和H-8)[17]、和1个甲氧基信号(C-1′和H-1′)及1个-NH2基活泼氢信号δH 3.84 (2H, br)等,见表 1。化合物3中的2个取代基的位置进一步通过HMBC谱确定。在HMBC谱(图 2)中,观测到了甲基氢H-1′与C-6、C-7、C-8相关以及氨基上的氢与C-5、C-6、C-7信号相关,可确定化合物3中的甲氧基和氨基官能团分别取代在香豆素母核的C-7和C-6位上[18-19]。综上谱学数据分析和文献对照[17-19],化合物3的结构确定为6-氨基-7-甲氧基-香豆素。经文献检索,化合物3是1个新化合物,命名为皂角香豆素A。
|
|
表 1 化合物3的1H-NMR和13C-NMR (400/100 MHz, MeOD)波谱数据归属 Table 1 1H-NMR and 13C-NMR data assignment of compound 3 (400/100 MHz, MeOD) |
|
图 2 化合物3的HMBC相关 Fig.2 HMBC correlation of compound 3 |
4 化合物的细胞毒活性
采用MTT法[20]对化合物进行肝癌(HepG2)、食管癌(EC109)、肺癌(A549)3种细胞株的体外细胞毒活性测定。结果发现,化合物2对人肺癌A-549细胞有较强的增殖抑制活性,其IC50值为34.47μg/mL,阳性对照顺铂的IC50值为11.50μg/mL。
5 讨论香豆素类化合物广泛分布于植物界中,其生理药理活性具有多样性。尤其香豆素类化合物相队分子质量较小,合成相对简单,生物利用度高,近年来的研究发现,香豆素类化合物在啮齿类动物中存在着明显的毒性作用,且具有种属和位点特异性,因此由于香豆素及其衍生物结构的特殊性,其药理及毒理作用成为国内外持续研究的热点。另据文献报道,化合物1和化合物异莨菪内酯无论是他们自身的抗菌、抗病毒和抗癌等生物活性,还是作为药物中间体和天然化合物对照品,都有着广泛的应用[19]。综上研究推断该类化合物可能同样为皂角刺细胞毒活性的主要成分之一。
| [1] | 中国药典[S].一部. 2015. |
| [2] | 宋立仁. 中华本草纲要[M]. 上海: 上海科学技术出版社, 1999 . |
| [3] | 陈国平. 中国抗癌中草药[M]. 上海: 上海科学技术出版社, 1984 . |
| [4] | 徐哲, 赵晓頔, 王漪檬. 皂角刺抗肿瘤活性成分的分离鉴定与活性测定[J]. 沈阳药科大学学报 , 2008, 25 (2) :108–110. |
| [5] | Zhang Z Z, Kazuo K, Jia Z H, et al. Triterpenoidal saponins from Gleditsia sinensis[J]. Phytochemistry , 1999, 52 (4) :715–722. DOI:10.1016/S0031-9422(99)00238-1 |
| [6] | Li W H, Zhang X M, Tian R R, et al. A new anti-HIV lupine acid from Gleditsia sinensis Lam[J]. J Asian Nat Prod Res , 2007, 9 (6) :551–555. DOI:10.1080/10286020600883419 |
| [7] | Lim J C, Park J H, Budesinsky M, et al. Antimutagenic constituents from the thorns of Gleditsia sinensis[J]. Chem Pharm Bull , 2005, 53 (5) :561–564. DOI:10.1248/cpb.53.561 |
| [8] | 李万华, 李琴, 王小刚, 等. 皂角刺中黄酮类化学成分的分离鉴定[J]. 西北大学学报:自然科学版 , 2005, 35 (6) :763–765. |
| [9] | Zhou L G, Li D, Gou J, et al. Antibacterial phenolic compounds from the spines of Gleditsia sinensis Lam[J]. Nat Prod Res , 2007, 21 (4) :283–291. DOI:10.1080/14786410701192637 |
| [10] | Xian Y X, Zhou H L, Wang X, et al. Anti-liver cancer constituents from the thorns of Gleditsia sinensis[J]. Phytochem Lett , 2015, 13 :343–347. DOI:10.1016/j.phytol.2015.07.018 |
| [11] | 李万华, 傅建熙, 范代娣. 皂角刺化学成分的研究皂甙成分的研究[J]. 西北大学学报:自然科学版 , 2000, 30 (2) :137–138. |
| [12] | Zhou L G, Li D, Jian W B, et al. Two ellagic acid glycosides from Gleditsia sinensis Lam[J]. Nat Prod Res , 2007, 21 (4) :303–309. DOI:10.1080/14786410701192702 |
| [13] | Wang J H, Tang J, Li D, et al. Chemical constituents and bioactivity of Gleditsia plants[J]. Chin Wild Plant Res , 2008, 27 (6) :1–3. |
| [14] | 曹冉冉, 高嘉屿, 尹卫平, 等. 皂角刺中二氢黄酮醇类化合物及其细胞毒活性研究[J]. 中草药 , 2016, 47 (5) :707–711. |
| [15] | 刘应杰, 陈竹, 叶小利, 等. 紫薯中6, 7-二甲氧基香豆素和5-羟甲基糠醛的分离鉴定[J]. 西南师范大学学报:自然科学版 , 2013, 38 (1) :85–89. |
| [16] | 吴文标, 盛德贤, 吕世安, 等. 马铃薯块茎中的6-羟基-7-甲氧基香豆素的分离和鉴定[J]. 中国马铃薯 , 1999, 13 (2) :79–80. |
| [17] | 梁晓天, 刘春雪, 姬政, 等. 莨菪亭及异莨菪亭的合成[J]. 中国医药工业杂志 , 1983, 14 (4) :6–7. |
| [18] | 龚运怀. 天然有机化合物的13C核磁共振化学位移[M]. 昆明: 云南科技出版社, 1986 . |
| [19] | Mulwad V V, Dalvi M B, Mahaddalkar B S. Synthesis of some antimicrobial pyranocarbazomycin[J]. Indian J Chem, Sec B: Org Chem Including Med Chem , 2002, 41B (7) :1477–1479. |
| [20] | Hu Q F, Zhou B, Ye Y Q, et al. Cytotoxic deoxybenzoins and diphenylethylenes from Arundina graminifolia[J]. J Nat Prod , 2013, 76 (10) :1854–1859. DOI:10.1021/np400379u |
 2016, Vol. 47
2016, Vol. 47


