2. 成都大学药学与生物工程学院, 四川 成都 610106 ;
3. 四川大学华西药学院, 四川 成都 610041
2. School of Pharmacy and Bioengineering, Chengdu University, Chengdu 610106, China ;
3. West China School of Pharmacy, Sichuan University, Chengdu 610041, China
姜黄Curcuma Longa Rhizoma为姜黄属植物姜黄Curcuma longa L.的干燥根茎,主产于中国,是我国传统中医药常用药物,具有破血行气、通经止痛之功效。研究表明,以姜黄素(curcumin)、脱甲氧基姜黄素(demethoxycurcumin,DMC)、双脱甲氧基姜黄素(bisdemethoxycurcumin,BDMC)为代表的姜黄素类化合物,以及倍半萜类化合物是姜黄的主要化学成分,目前国内外已经从姜黄中分离得到了10多个不同类型的姜黄素类[1-4]以及二十多个倍半萜类化合物[5-6]。大量的现代药理研究表明,姜黄及其主要化学成分具有广泛的药理活性,包括抗氧化、抗炎症、抗肿瘤及抗老年痴呆症等[7-11]。
为了更深入了解姜黄的化学成分,寻找更多的姜黄素类新化合物,并从中发现具有药用价值的先导性化合物,本实验建立了基于LC-MS分析技术和多种柱色谱技术的中药导向分离方法,以“寻找-定位-纯化-鉴定”为研究思路从姜黄根茎95%甲醇提取物中发现1个具有姜黄素类成分骨架结构的新化合物,通过定位该新化合物所在的提取物流分并进行富集,采用MCI小孔树脂、ODS-C18反相柱色谱及RP-HPLC色谱技术将其分离纯化,并通过NMR技术进行结构鉴定,最终确认新化合物为姜黄素-没药烷型倍半萜二聚体新化合物3, 4′′′-epoxy-5′′′-C-(1α, 2β, 3β-bisabola-4, 10-diene-9-one)-(2→5′′′)-curcumin(1),命名为姜萜素G。体外细胞毒活性检测表明该化合物对HepG2、A549和CT-26肿瘤细胞表现出较强的细胞毒活性。
1 材料与仪器Agilent1100高效液相色谱仪(Agilent Technologies,德国),配有四元泵溶剂洗脱系统,自动进样器及紫外检测仪;Finnigan LCQ Advantage离子肼质谱仪(Thermo Finnigan,San Jose,CA,美国),ESI;YMC-Pack-ODS-A C18 reversed column(250 mm×4.6 mm,5μm)色谱柱及Agilent Zorbax SB-C18(12.5 mm×4.6 mm,5μm)保护柱。核磁共振光谱仪:INOVA-500(1H-NMR 500 MHz,13C-NMR 125 MHz)和JEOL JNM-AL300(1H-NMR 300 MHz,13C-NMR 75 MHz)核磁共振仪;高分辨质谱仪:Bruker APEX IV FT-MS;Varian Cary 300 UV紫外-可见光分光光度仪;Thermo Nicolet Avatar傅里叶红外光谱仪;半制备HPLC分析仪:岛津LC-8AHPLC色谱系统;YMC ODS-A半制备色谱柱(250 mm×10 mm,5μm);Horiba SEPA-300型数字旋光仪。
常规提取分离用甲醇、醋酸乙酯、丙酮、氯仿等均为分析纯,制备用乙腈为色谱纯,成都科龙化工厂产品;去离子水由纯净水经Millipore Simplicity纯水系统制备。小孔树脂(MCI-GEL)购自成都科贸有限公司;ODS反相色谱填料均在成都迪维乐普公司购买;柱色谱用凝胶Sephadex LH-20(25~100μm)为Pharmacia公司产品;薄层色谱用硅胶GF254购自青岛海洋化工厂。
本实验姜黄样品于2013年12月采自四川乐山犍为县,药材标本(编号201312)经西华大学制药工程系何宇新教授鉴定为姜黄Curcuma longa L.的干燥根茎。
2 新化合物的导向发现 2.1 药材提取物流分的分段处理将1 kg姜黄药材干燥后粉碎到40目,以10倍量95%甲醇,加热回流提取3次,每次2 h,合并3次提取液,减压浓缩得浸膏200 g。以甲醇-氯仿(3:4、9:10、99:1)经MCI-GEL梯度洗脱,分别获得流分1~3。将流分1~3经LC-MS检测,寻找姜黄素类新化合物。
2.2 LC-MS检测条件流动相:乙腈(A)-0.1%甲酸溶液(B);洗脱程序:0~30 min,40%~50% A;30~35 min,50%~65% A;35~42 min,65%~70% A;42~55 min,70% A;55~60 min,70%~100% A;柱温30℃;体积流量1.0 mL/min;检测波长425 nm。质谱参数设定:ESI电离源,扫描模式:负离子扫描;扫描范围m/z 120~1 200;源电压4.0 kV;毛细管温度320℃;毛细管电压30.0 V;透镜补偿电压−40.0 V;源裂解电压10.0 V。
2.3 姜黄素类化合物特征性质谱裂解规律及UV吸收实验结果表明在(−) ESI-MS/MS模式下,姜黄素的特征性裂解行为:m/z 367→217→173 [M-H]−,而作为二苯基庚酸类化合物,拥有不饱和双键,其在UV下的特征性最大吸收波长位于425 nm,与已有报道一致[12-13]。
2.4 流分1~3的LC-MS质谱分析对流分1、2中的色谱峰进行了质谱检测,实验结果表明流分1和2中色谱峰的相对分子质量、质谱裂解规律和已报道姜黄素类化合物包括姜黄素、脱甲氧基姜黄素、双脱甲氧基姜黄素等相对分子质量一致[14],没有发现新的姜黄素类天然产物。在流分3的分析中,本实验以导向分离的思路发现1个新的姜黄素类天然产物(化合物1),过程如下:(1)化合物1的UV λmax为426 nm,为姜黄素类化合物的特征吸收,见图 1;(2)化合物1的分子离子峰为m/z 583 [M-H]−(图 1),大于已知姜黄素的分子离子峰m/z 367 [M-H]−,在MS2裂解中发现化合物1的碎片离子具有[M-H]− m/z 217、[M-H]− m/z 173的姜黄素结构的特征碎片离子,证明化合物1是一个具有姜黄素类化合物骨架结构、但相对分子质量远比姜黄素更大的化合物;(3)对已报道的姜黄素类化合物数据库进行全面的文献检索和查询,没有任何文献报道类似结构的化合物在自然界中分离得到。
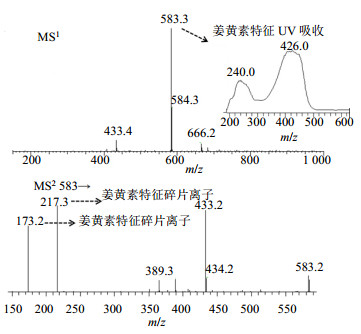
|
图 1 化合物1的MS1、MS2图谱及最大UV吸收波长 Fig.1 MS1, MS2 spectra, and UVmax of compound 1 |
综合以上信息,推测化合物1是一个具有姜黄素母核结构的化合物,并且具有更大的相对分子质量和更复杂的结构,所以将化合物1作为目标化合物进行分离纯化。
3 提取与分离采用中压柱色谱系统,将“2.1”项中流分3浸膏用ODS反相色谱柱经甲醇-水(40:60、55:45、60:40、75:25和95:5)洗脱,得到5个洗脱部位:FIII-1(0.5 g)、FIII-2(1.5 g)、FIII-3(2 g)、FIII-4(1.5 g)和FIII-5(1 g)。FIII-4(1.5 g)和FIII-5(1 g)进一步以甲醇为洗脱液,在Sephadex LH-20凝胶柱色谱上除杂,得到FIII-4-3(400 mg)、FIII-5-3(200 mg)、FIII-5-4(20 mg)。再将3个洗脱部位以HPLC制备液相色谱(岛津LC-8AHPLC色谱系统;YMC ODS-A柱,250 mm×10 mm,5μm)在乙腈-水系统中制备分离。洗脱部位FIII-5-4(20 mg)经制备液相色谱得到化合物1(12 mg,乙腈-水48:52,体积流量3.0 mL/min,tR=160 min)。
4 结构鉴定化合物1为黄色无定形粉末,经高分辨质谱(HR-ESI-MS)测定m/z 607.266 69 [M+Na]+(计算值607.266 62),得出分子式为C36H40O7,不饱和度为17,mp 93~98℃;[α]D25 −219°(c 0.15, CH3OH);(nm): 426 nm;IR波谱显示3 423 cm−1的1个自由羟基强吸收,1 718,1 627 cm−1的2个羰基的吸收峰,以及1 512 cm−1的苯环吸收峰。13C-NMR数据(表 1)与DEPT波谱数据同样表明该化合物有36个C信号,包括6个甲基碳(2个甲氧基碳同在δC 55.4处)、2个亚甲基、4个次甲基、12个亚乙烯基以及12个季碳(包括3个羰基碳δC 183.6, 183.6, 199.1)。1H-NMR总共发现12个烯属氢原子,其中2对反式-α, β-不饱和双键(δH 6.58, d, J=15.6 Hz和δH7.47, d, J=15.6 Hz; δH 6.60, d, J=15.6 Hz和δH 7.53, d, J=15.6 Hz);1组ABX系统氢原子(δH 7.20, s; δH 6.76, d, J=8.4 Hz; δH 7.05, d, J=8.4 Hz),再加上1个烯属单氢(δH5.87, s),以上部分核磁数据与姜黄素骨架的特征信号相近[12],且在LC-MS分析中已证明化合物1具有姜黄素的骨架结构,因此为了快速准确地鉴定复杂化合物1的结构,将姜黄素与化合物1姜黄素类骨架部分的13C、1H-NMR数据进行比对。
|
|
表 1 化合物1与已知化合物的13C-NMR和1H-NMR数据 Table 1 13C-NMR and 1H-NMR data of compound 1 and known curcumin |
由表 1中数据可知,化合物1姜黄素类骨架部分与姜黄素的13C-NMR数据除C-5′′′外,其余几乎完全吻合。化合物1的C-5′′′(δC 132.8)相比姜黄素C-5′′′(δC 115)向低场位移。此外,在化合物1的苯环b中,发现ABX系统的1H-NMR信号消失,只存在2个烯氢质子的信号,化学位移分别为δH7.12和7.13,见表 1。在1H-NMR数据中,与姜黄素数据相比,发现化合物1的H-5′′′信号缺失。以上证据表明,化合物1姜黄素骨架部分在苯环b的5′′′位存在一个取代,不但造成H-5′′′的信号缺失,同时使C-5′′′信号发生位移。
除化合物1姜黄素骨架部分的13C-NMR与1H-NMR信号外,其余信号皆来自于化合物1的侧链取代基团,经过分析发现其13C-NMR和1H-NMR数据与已知化合物类似,故将两者数据进行对比,以确定结构。通过与文献进行比对[6],发现其与没药烷型倍半萜(bisabolane):2-methoxy-5-hydroxybisabola-3, 10-diene-9-one相近。结合HSQC数据,将化合物1的倍半萜类侧链中的13C-NMR与1H-NMR数据归属如下:2个三取代乙烯基和2个季碳[δC 127.1 (δH 5.71, d, J=4.8 Hz), δC 130.3, δC 123.7 (δH 5.88, s), δC 153.5];1个羰基酮碳(δC 199.1);2个亚甲基[δC 23.4 (δH 1.77, m;δH 1.89, m);δC 49.8 (δH 2.21, dd, J=6.2, 15.2 Hz;δH2.25, dd, J=7.6, 15.2 Hz)];4个次甲基[δC 84.7 (δH 4.75, d, J=7.2 Hz);δC 42.9 (δH 3.11, dd, J=7.2, 11.0 Hz);δC 38.9 (δH 1.35, dt, J=3.8, 11.0 Hz); δC 27.6 (δH 2.41, m)];4个甲基[δC 13.6 (δH 0.89, d, J=6.8 Hz); δC 19.5 (δH 1.84, s); δC 19.9 (δH 1.77, s); δC 26.5 (δH 1.62, s)]。
姜黄素骨架与倍半萜骨架的取代位点是该化合物结构鉴定的关键,在图 2中,由1H-1H COSY相关可知,在倍半萜部分的六元环中存在1个H-6 (δH1.77/1.89)→H-1 [δH 1.35 (dt, J=3.8, 11.0 Hz)]→H-2 [δH 3.11 (dd, J=7.2, 11.0 Hz)→H-3 [δH 4.75 (d,J=7.2 Hz)]的可旋转的质子偶合系统,其相互位置由1H-1H COSY以及HMBC远程相关得以确认,见图 2。进一步将H-2 (δH 3.11)与H-3 (δH 4.75);C-2 (δH 42.9)与C-3 (δH 84.7)的信号加以分析发现,H-3与C-3的信号较H-2与C-2处于更低场,3位应连接1个较强的亲电子基团;此外,在HMBC中发现H-3到C-4′′′(δC 150.2)微弱的远程相关;以及H-2同时与C-5′′′、C-6′′′和C-4′′′极强的远程相关信号,见图 2。加上此前已发现姜黄素骨架部分的5′′′位存在一个取代,造成H-5′′′的信号缺失,以上的数据证明了化合物1中C-3与C-4′′′以3→4′′′的“C-O-C”键方式相连,而C-2与C-5′′′以2→5′′′的“C-C”键方式相连。综上所述,化合物1中的姜黄素骨架部分和倍半萜骨架部分同时以“C-O-C”键和“C-C”键方式相连使其形成了1个新的呋喃五元环(2-3-O-4′′′-5′′′)。
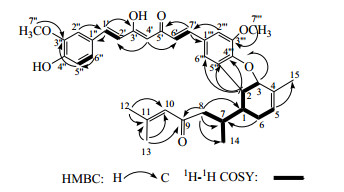
|
图 2 化合物1的结构和主要HMBC及1H-1H COSY相关 Fig.2 Structure and key HMBC, and 1H-1H COSY correlations of compound 1 |
化合物1的NOESY实验结果为倍半萜骨架部分相对构型的确立提供了直接依据,结构见图 3。在图谱中,发现明显的H-2与H-3、H-1与H-7的信号相关,证明了H-2与H-3、H-1与H-7之间分别处于顺式构型(cis),而H-3与H-1之间无任何NOE相关处于反式构型(trans)。因此,结合以上证据,化合物1的结构为姜黄素骨架部分与倍半萜侧链部分通过呋喃五元环以“C-O-C”键和“C-C”键相连,确定为3, 4′′′-epoxy-5′′′-C-(1α, 2β, 3β-bisabola-4, 10-diene-9-one)-(2→5′′′)-curcumin;命名为姜萜素G。
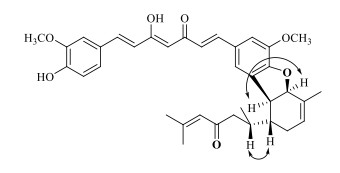
|
图 3 化合物1的NOESY相关 Fig.3 NOESY correlations of compound 1 |
5 化合物细胞毒活性
由于文献报道姜黄素类化合物具有显著的抗肿瘤活性,本研究采用改良的MTT细胞毒活性测定法[15],以姜黄素、DMC、BDMC为对照,对化合物1进行了细胞毒活性筛选,所测试的细胞株为HepG2、A549和CT-26(表 2)。结果表明,化合物1对所选3种肿瘤细胞株的IC50值均小于10μmol/L,并优于已报道的3种主要姜黄素类化合物:姜黄素、DMC及BDMC[1-2],其中对HepG2和CT-26有较高的细胞毒活性,IC50值分别为4.82、5.40μmol/L。
|
|
表 2 化合物1的细胞毒活性 Table 2 Cytotoxic activity of compound 1 |
6 讨论
本实验采用基于LC-MS技术的导向分离法,从姜黄的提取物中发现了具有姜黄素骨架与倍半萜骨架的新化合物1,经提取分离后结构鉴定为3, 4′′′-epoxy-5′′′-C-(1α, 2β, 3β-bisabola-4, 10-diene-9-one)-(2→5′′′)-curcumin;命名为姜萜素G。该化合物的姜黄素与倍半萜部分经过缀合形成呋喃五元环,尚未见已有文献报道类似结构,其可能的生源合成途径见图 4。在本研究中,化合物1的手性碳(C-1/2/3/7)相对构型得到了初步确认,课题组正在累积化合物1质量,将在后续研究中通过X单晶衍射实验进一步确认化合物1的绝对构型。
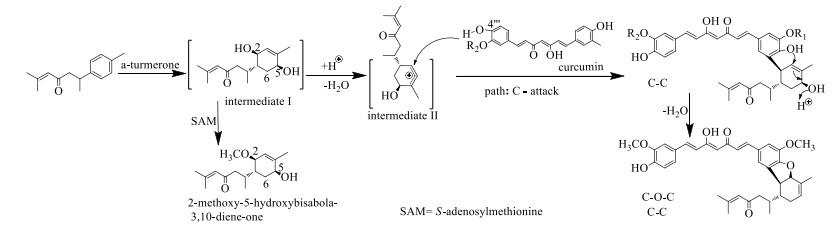
|
图 4 化合物1可能的生源合成途径 Fig.4 Proposed biosynthetic pathway for compound 1 |
| [1] | Syu W, Shen C, Don M, et al. Cytotoxicity of curcuminoids and some novel compounds from Curcuma zedoaria[J]. J Nat Prod , 1999, 61 (12) :1531–1534. |
| [2] | Roth G N, Chandra A, Nair M G. Novel bioactivities of Curcuma longa constituents[J]. J Nat Prod , 1998, 61 (4) :542–545. DOI:10.1021/np970459f |
| [3] | Park S, Kim D S H L. Discovery of natural products from Curcuma longa that protect cells from beta-amyloid insult: A drug discovery effort against Alzheimer's disease[J]. J Nat Prod , 2002, 65 (9) :1227–1231. DOI:10.1021/np010039x |
| [4] | Li W, Wang S, Feng J, et al. Structure elucidation and NMR assignments for curcuminoids from the rhizomes of Curcuma longa[J]. Magn Reson Chem , 2009, 47 (10) :902–908. DOI:10.1002/mrc.v47:10 |
| [5] | Jayaprakasha G K, Rao L J M, Sakariah K K. Chemistry and biological activities of C. longa[J]. Trends Food Sci Technol , 2005, 16 (12) :533–548. DOI:10.1016/j.tifs.2005.08.006 |
| [6] | Li W, Feng J, Xiao Y, et al. Three novel terpenoids from the rhizomes of Curcuma longa[J]. J Asian Nat Prod Res , 2009, 11 (6) :568–574. |
| [7] | Kim H Y, Park E J, Joe E, et al. Curcumin suppresses Janus Kinase-STAT inflammatory signaling through activation of Src homology 2 domain-containing tyrosine phosphatase 2 in brain microglia[J]. J Immunol , 2003, 171 (11) :6072–6079. DOI:10.4049/jimmunol.171.11.6072 |
| [8] | Jayaprakasha G K, Rao L J, Sakariah K K. Antioxidant activities of curcumin, demethoxycurcumin and bisdemethoxycurcumin[J]. Food Chem , 2006, 98 (4) :720–724. DOI:10.1016/j.foodchem.2005.06.037 |
| [9] | Kunnumakkara A B, Anand P, Aggarwal B B. Curcumin inhibits proliferation, invasion, angiogenesis and metastasis of different cancers through interaction with multiple cell signaling proteins[J]. Cancer Lett , 2008, 269 (2) :199–225. DOI:10.1016/j.canlet.2008.03.009 |
| [10] | Shishodia S, Potdar P, Gairola C G, et al. Curcumin (diferuloylmethane) down-regulates cigarette smoke-induced NF-κB activation through inhibition of IkBalpha kinase in human lung epithelial cells: Correlation with suppression of COX-2, MMP-9 and cyclin D1[J]. Carcinogenesis , 2003, 24 (7) :1269–1279. DOI:10.1093/carcin/bgg078 |
| [11] | 罗廷顺, 李洪文, 刘正文, 等. 姜黄素的提取分离与药理作用研究进展[J]. 现代药物与临床 , 2011, 26 (2) :102–107. |
| [12] | Pedersen U, Rasmussen P B, Lawesson S O. Synthesis of naturally occurring curcuminoids and related compounds[J]. Liebigs Ann Chem , 1985, 1985 (8) :1557–1569. DOI:10.1002/(ISSN)1099-0690 |
| [13] | Jiang H, Somogyi A, Jacobsen N E, et al. Analysis of curcuminoids by positive and negative electrospray ionization and tandem mass spectrometry[J]. Rapid Commun Mass Spectrom , 2006, 20 (6) :1001–1012. DOI:10.1002/(ISSN)1097-0231 |
| [14] | Jiang H, Timmermann B N, Gang D R. Use of liquid chromatography-electrospray ionization tandem mass spectrometry to identify diarylheptanoids in turmeric (Curcuma longa L.) rhizome[J]. J Chromatogr A , 2006, 1111 (1) :21–31. DOI:10.1016/j.chroma.2006.01.103 |
| [15] | Gao X M, Wang R R, Niu D Y, et al. Bioactive dibenzocyclooctadiene dibenzocyclooctadiene lignans from the stems of Schisandra neglecta[J]. J Nat Prod , 2013, 76 (6) :1052–1057. DOI:10.1021/np400070x |
 2016, Vol. 47
2016, Vol. 47

