2. 中国科学院兰州化学物理研究所, 中国科学院西北特色植物资源化学重点实验室, 甘肃 兰州 730000
2. Key Laboratory of Chemistry of Northwestern Plant Resources, Lanzhou Institute of Chemical Physics, Chinese Academy of Sciences, Lanzhou 730000, China
芫花Genkwa Flos为瑞香科(Thymelaeaceae)植物芫花Daphne genkwa Sied. et Zucc.的干燥花蕾,主要分布于长江流域诸省与黄河流域的部分地区。作为我国传统中药,芫花具有泻水逐饮、解毒杀虫的功效;用于水肿胀满、胸腹积水、痰饮积聚、气逆喘咳、二便不利,外治疥癣秃疮、冻疮[1]。现代药理研究表明,芫花具有镇咳祛痰、引产、抗肿瘤、抗炎、杀虫、调节免疫功能等作用[2-3]。其所含化学成分种类多样,主要为香豆素类、木脂素类、二萜原酸酯类和常见的黄酮类[2, 4-7]。本研究从芫花花蕾95%乙醇提取物的石油醚萃取部分中分离得到3个木脂素类成分(图 1),分别鉴定为落叶松树脂醇-9-O-三十五烷酸酯(lariciresinol-9-O-pentatriacontanoate,1),松脂醇(pinoresinol,2),4-羟基芝麻素(4-hydroxysesamin,3),其中化合物1为新的四氢呋喃型木脂素类成分,化合物3为首次从该植物中分离得到。
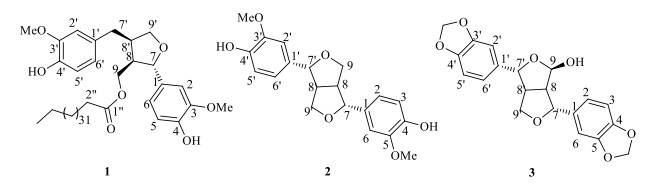
|
图 1 化合物1~3的结构 Fig.1 ptructures of compounds 1-3 |
1 仪器与材料
Varian INOVA-400 MHz超导核磁共振波谱仪(美国Varian公司),TMS为内标;Bruker APEX II高分辨率电喷雾质谱仪(德国Bruker公司);WFH-203(ZF-1)三用紫外分析仪(上海精科实业有限公司);METTLER-AE100电子分析天平(瑞士Mettler公司);柱色谱及薄层色谱硅胶(青岛海洋化工集团有限公司);所用溶剂为分析纯。
药材购买自兰州黄河药材市场,植物样品由中国科学院西北特色植物资源化学重点实验室戚欢阳副研究员鉴定为芫花Daphne genkwa Sied. et Zucc.,标本(YH2010S001)存贮于中国科学院兰州化学物理研究所甘肃省天然药物重点实验室。
2 提取与分离将芫花花蕾9.3 kg粉碎后,用10倍量95%乙醇室温浸泡提取3次,每次7 d,合并提取液,减压浓缩得总浸膏680 g,以水混悬,依次用石油醚、醋酸乙酯、正丁醇萃取,减压浓缩得各部分浸膏。取石油醚萃取浸膏(150 g),经硅胶柱色谱分离,以石油醚-醋酸乙酯(30:1→0:1)进行梯度洗脱,根据薄层检测结果合并相同馏份,共得到7个组分:A(30:1)、B(15:1)、C(8:1)、D(4:1)、E(2:1)、F(1:1)、G(0:1)。组分D经硅胶柱色谱,以石油醚-醋酸乙酯(5:1)和石油醚-丙酮(10:1)作为流动相反复洗脱,得到化合物3(8.2 mg)。组分F经硅胶柱色谱,以氯仿-醋酸乙酯(10:1)为洗脱剂洗脱,得到3个部分C1~C3。C1部分以石油醚-丙酮(5:1)为洗脱剂,经硅胶柱色谱反复分离,得到化合物1(18.0 mg)。C3部分以石油醚-丙酮(5:1)为洗脱剂,经硅胶柱色谱反复分离,得到化合物2(16.5 mg)。
3 结构鉴定化合物1:白色无定形粉末,10%硫酸-乙醇溶液喷雾加热后显紫红色。[α]D20 +15 (c 0.35, CHCl3),HR-ESI-MS m/z: 887.643 5 [M+Na]+(计算值887.643 1,C55H92O7Na),结合13C-NMR和DEPT谱可确定其分子式为C55H92O7,不饱和度为10。1H NMR (400 MHz, CDCl3)、13C-NMR和DEPT (100 MHz, CDCl3)数据见表 1。
|
|
表 1 化合物1的1H-NMR和13C-NMR数据 Table 1 1H-NMR and 13C-NMR data for compound 1 |
1H-NMR谱显示有6个苯环上的氢信号δH 6.66~6.88 (6H, m),1个连氧次甲基δH 4.63 (1H, d, J=6.4 Hz),2个连氧亚甲基δH 4.36 (1H, dd, J=11.2, 7.2 Hz)和4.18 (1H, dd, J=11.2, 7.2 Hz), 4.05 (1H, dd, J=8.4, 6.8 Hz)和3.73 (1H, dd, J=8.4, 6.8 Hz),2个连氧甲基信号δH3.89和3.87,1组长链结构特征信号δH 2.26, 1.57, 1.26, 0.88;13C-NMR和DEPT谱显示有1个羰基信号δC173.4,6个双键季碳信号和6个双键CH信号,1个连氧次甲基信号δC 83.0,2个连氧亚甲基信号δC72.3和62.5,2个甲氧基碳信号δC 55.6,以及1组脂肪酸酯链特征信号δC 173.4, 34.1, 31.8, 29.6~29.1, 24.5, 22.6, 14.2;由于该化合物的不饱和度为10,可推断该分子中仍存在1个环状结构。通过1H-1H COSY相关(图 2)可连接出片段-C7-C8 (C9)-C8′(C9′)-C7-。由以上数据分析结合文献检索,可初步推测其为1个连有长链脂肪酸酯的7, 9′-单环氧的四氢呋喃木脂素类化合物。与已知化合物落叶松树脂醇[7]的NMR数据相比较,化合物1中增加了1组长链脂肪酸酯信号,且C-9和C-8的碳信号分别发生低场和高场位移。在HMBC谱(图 2)中,2个甲氧基氢信号δH 3.89和3.87分别与C-3 (δC 145.1)和C-3′(δC 144.7)存在相关,证明2个甲氧基分别连接在C-3和3′位。此外,羰基碳C-1″(δC 173.4)与H-9之间存在远程相关,表明长链脂肪酸酯应连接于C-9位;结合高分辨质谱数据可推测该脂肪酸酯链上的碳原子个数为35。在NOESY谱(图 2)中,H-8与H-8′,H-7′与H-9存在NOE效应,表明H-8和H-8′位于同一侧;根据H-7质子为双峰,且耦合常数为6.4 Hz,推测H-7与H-8处于异侧;从而确定了化合物1的相对构型。综上所述,该化合物结构被鉴定为落叶松树脂醇-9-O-三十五烷酸酯,为1个新的四氢呋喃木脂素类化合物。
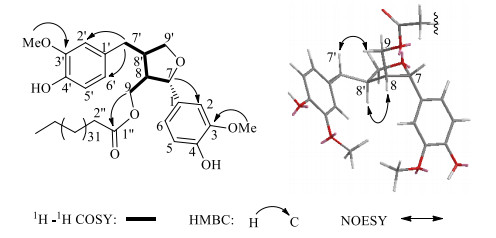
|
图 2 化合物1主要的1H-1H COSY、HMBC和NOESY相关 Fig.2 Key 1H-1H COSY, HMBC, and NOESY correlations for compound 1 |
化合物2,白色无定形粉末,10%硫酸-乙醇溶液喷雾加热后显紫红色。1H-NMR (400 MHz, CDC13) δ: 6.80~6.89 (6H, m, Ar-H), 5.61 (2H, s, -OH×2), 4.73 (2H, d, J=4.0 Hz, H-7, 7′), 4.24 (2H, dd, J=6.8, 9.2 Hz, H-9a, 9′a), 3.88 (6H, s, -OCH3×2), 3.86 (2H, dd, J=9.2, 3.6 Hz, H-9b, 9′b), 3.10 (2H, m, H-8, 8′);13C-NMR和DEPT (100 MHz, CDCl3) δ: 132.9 (s, C-1), 108.6 (d, C-2), 146.7 (s, C-3), 145.2 (s, C-4), 114.3 (d, C-5), 118.9 (d, C-6), 85.8 (d, C-7), 54.2 (d, C-8), 71.6 (t, C-9), 132.9 (s, C-1′), 108.6 (d, C-2′), 146.7 (s, C-3′), 14 5.2 (s, C-4′), 114.3 (d, C-5′), 118.9 (d, C-6′), 85.8 (d, C-7′), 54.2 (d, C-8′), 71.6 (d, C-9′), 55.9 (q, -OCH3×2)。以上数据与文献报道基本一致[7],故鉴定化合物2为松脂醇。
化合物3,白色无定形粉末,10%硫酸-乙醇溶液喷雾加热后显紫红色。1H-NMR (400 MHz, CD3COCD3) δ: 6.76~7.14 (6H, m, Ar-H), 5.98 (2H, s, -OCH2O-), 5.97 (2H, s, -OCH2O-), 5.66 (1H, d, J=6.4 Hz, H-9), 5.57 (1H, d, J=6.4 Hz, -OH), 4.89 (1H, d, J=8.8 Hz, H-7′), 4.80 (1H, d, J=9.6 Hz, H-7), 4.22 (1H, dd, J=8.0, 12.0 Hz, H-9′a), 4.01 (1H, dd, J=3.6, 12.0 Hz, H-9′b), 3.10 (1H, m, H-8′), 2.82 (1H, m, H-8);13C-NMR和DEPT (100 MHz, CD3COCD3) δ: 137.5 (s, C-1), 106.9 (d, C-2), 147.6 (s, C-3), 148.6 (s, C-4), 108.5 (d, C-5), 119.8 (d, C-6), 83.9 (d, C-7), 63.6 (d, C-8), 102.3 (t, C-9), 138.5 (s, C-1′), 107.6 (d, C-2′), 147.8 (s, C-3′), 148.7 (s, C-4′), 108.6 (d, C-5′), 120.3 (d, C-6′), 87.8 (d, C-7′), 54.7 (d, C-8′), 72.6 (d, C-9′), 101.7 (t, -OCH2O-), 101.8 (t, -OCH2O-)。以上数据与文献报道基本一致[8],故鉴定化合物3为4-羟基芝麻素,该化合物为首次从该植物中分离得到。
| [1] | 中国药典[S].一部. 2015. |
| [2] | 李玲芝, 宋少江, 高品一. 芫花的化学成分及药理作用研究进展[J]. 沈阳药科大学学报 , 2007, 24 (9) :587–592. |
| [3] | 张保献, 原思通, 张静修, 等. 芫花的现代研究概况[J]. 中国中医药信息杂志 , 1995, 2 (10) :21–24. |
| [4] | 郑维发, 石枫. 芫花根中新双香豆素的分离与鉴定[J]. 药学学报 , 2004, 39 (12) :990–992. |
| [5] | Wang R, Li J Y, Qi H Y, et al. Two new tigliane diterpene esters from the flower buds of Daphne genkwa[J]. J Asian Nat Prod Res , 2013, 15 (5) :502–506. DOI:10.1080/10286020.2013.786703 |
| [6] | Jiang H L, Wang R, Li J Y, et al. A new highly oxygenated daphnane diterpene esters from the flower buds of Daphne genkwa[J]. Nat Prod Res , 2015, 29 (20) :1878–1883. DOI:10.1080/14786419.2015.1009459 |
| [7] | Okunishi T, Umezawa T, Shimada M, et al. Isolation and enzymatic formation of lignans of Daphne genkwa and Daphne odora[J]. J Wood Sci , 2001, 47 (5) :383–388. DOI:10.1007/BF00766790 |
| [8] | Anjaneyulu A S R, Madhusudhana R A, Rao K V, et al. Novel hydroxy lignans from the heartwood of Gmelina arborea[J]. Tetrahedron , 1977, 33 (1) :133–143. DOI:10.1016/0040-4020(77)80444-4 |
 2016, Vol. 47
2016, Vol. 47


