大黄叶为蓼科(Polygonaceae)植物大黄Rheum officinale Baill的干燥叶,其原植物的根及根茎作为传统中药大黄临床应用,《中国药典》2015年版收载为中药大黄正品之一[1]。现代研究表明,大黄叶具有清热解毒、活血消肿、泻下、止血、生肌、收敛、抗炎、等传统功效与生理活性,主要含有蒽醌类、酚类、鞣质、氨基酸、微量元素等化学成分[2-6]。大黄叶在民间有使用习惯,在藏族医药学中,大黄的叶和柄,习称“秋久”,性温,可治培根病等多种疾病,与大黄的药理作用和化学成分有类似之处[7]。
大黄为中药大黄的主要来源之一,在我国已有多年应用历史。作为药用植物资源,药用大黄叶相对于其根及根茎不仅资源丰富,而且生长快、采收期长,更重要的是大黄叶资源开发和利用具有可持续性,如能对其研究开发利用,将产生很大的经济效益和社会效益。目前尚未见有关大黄叶多成分定量测定报道。为使该资源进一步地充分利用,本实验通过对陕西省镇巴县大黄叶中相关化学成分进行测定,初步探索与其根及根茎中成分的差异性,为大黄叶开发利用提供科学依据。
1 仪器及材料 1.1 仪器Waters 2695高效液相色谱仪(美国Waters公司),包括四元超高压溶剂系统、自动进样恒温样品管理器,Waters2998 PAD检测器,Empower色谱工作站;GB204型电子分析天平(北京赛多利斯仪器系统有限公司);KQ-200KED超声波清洗机(江苏昆山市超声仪器有限公司)。
1.2 材料对照品没食子酸(批号122811,质量分数大于99%)、番泻苷B(批号11z15,质量分数大于98%)购自天津西玛科技有限公司;大黄素(批号110795-200505,质量分数大于98%)、大黄酚(批号110796-200615,质量分数大于99%)、大黄酸(批号0757-200206,质量分数大于99%)、大黄素甲醚(批号110758-200610,质量分数大于98%)、芦荟大黄素(批号03071201,质量分数大于99%)、大黄酚-1-O-葡萄糖苷(批号110796-200615,质量分数大于98%)、大黄素-8-O-葡萄糖苷(批号10756-200110,质量分数大于98%)购自中国 食品药品检定研究院。色谱甲醇(批号20150603)上海泰坦科技有限公司;娃哈哈纯净水(批号20150702)杭州娃哈哈集团有限公司;其他试剂均为分析纯。
大黄叶22批样品于2015年8月上旬均采自陕西省镇巴县,经陕西中医药大学胡本祥教授鉴定均为大黄Rheum officinale Baill的叶。大黄叶片样品采集信息见表 1。
|
|
表 1 22批样品采集信息 Table 1 Collected information of 22 samples |
2 方法和结果 2.1 色谱条件
武本C18色谱柱(250 mm×4.6 mm,5 μm);流动相由甲醇(A)和0.2%乙酸水(B)组成,梯度洗脱(0~5 min,5%~15% A;5~15 min,15%~30% A;15~25 min,30%~35% A;25~31 min,35%~42% A;31~46 min,42%~53% A;46~66 min,53%~68% A;66~75 min,68%~100% A;75~85 min,100% A),检测波长260 nm,柱温30 ℃,体积流量1.0 mL/min。进样量为10 μL。在上述色谱条件下分析,理论板数按各个成分计算均不低于5 000,与相邻组分峰的分离度均大于1.5,色谱峰对称因子均在0.95~1.05。典型色谱图见图 1。
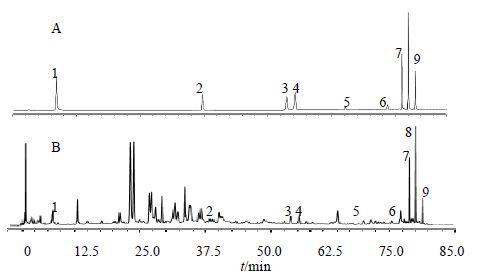
|
图 1 混合对照品 (A) 及样品 (B) HPLC图 Fig.1 HPLC of mixed reference substances (A) and sample (B) |
2.2 溶液的制备 2.2.1 对照品溶液制备
分别取没食子酸、番泻苷B、大黄酚-1-O-葡萄糖苷、大黄素-8-O-葡萄糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚9种对照品适量,精密称定,分别置10 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,制成质量浓度分别1.010、1.030、0.202、0.224、0.015、0.010、0.191、0.702、0.025 mg/mL的对照品储备液,分别精密量取上述对照品储备液1 mL至10 mL量瓶中,用甲醇稀释10倍,摇匀,得质量浓度分别为101.0、103.0、20.2、22.4、1.5、1.0、19.1、70.2、2.5 μg/mL没食子酸、番泻苷B、大黄酚-1-O-葡萄糖苷、大黄素-8-O-葡萄糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的混合对照品储备液。4 ℃保存备用。
2.2.2 供试品溶液制备取大黄干燥叶,研细(过60目筛),混匀,取1 g,精密称定,置具50 mL塞锥形瓶中,精密加入45 mL甲醇,称定质量。超声处理(功率500 W,频率40 kHz)30 min,放至室温,加甲醇至刻度,摇匀,滤过,取续滤液过0.45 μm微孔滤膜,作为供试品溶液,待测。
2.3 方法学考察 2.3.1 线性关系考察精密量取混合对照品储备液0.1、0.4、0.8、1.6、2.0、3.0 mL,分别置10 mL量瓶中,加甲醇稀释至刻度,摇匀,得系列混合对照品溶液。按照“2.1”项下色谱条件分别进样10 μL,记录色谱图。分别以对照品溶液质量浓度为横坐标(X),峰面积为纵坐标(Y),进行线性回归,9种待测成分的线性回归方程、线性范围和相关系数(r),见表 2。
|
|
表 2 9种成分回归方程及线性范围 Table 2 Regression equations and linear ranges of nine constituents |
2.3.2 精密度试验
取混合对照品溶液,每次进样5 μL,连续进样6次,记录没食子酸、番泻苷B、大黄酚-1-O-葡萄糖苷、大黄素-8-O-葡萄糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的峰面积积分值,计算RSD,分别为0.92%、2.18%、1.76%、1.86%、2.08%、1.42%、0.86%、0.68%、1.56%,表明仪器精密度良好。
2.3.3 稳定性试验精密吸取同8号样品的供试品溶液,分别于制备后的0、2、4、8、16、24 h进样10 μL测定,记录没食子酸、番泻苷B、大黄酚-1-O-葡萄糖苷、大黄素-8-O-葡萄糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的峰面积积分值,计算RSD,分别为1.48%、1.76%、2.36%、3.24%、2.62%、1.46%、2.12%、0.89%、1.24%,表明供试品溶液在24 h内稳定。
2.3.4 重复性试验取8号大黄干燥叶粉末样品6份,精密称定,按“2.2.2”项下方法平行制备供试品溶液,分别进样,测定峰面积。计算没食子酸、番泻苷B、大黄酚-1-O-葡萄糖苷、大黄素-8-O-葡萄糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚平均质量分数的RSD,分别为2.15%、2.82%、2.16%、1.72%、2.24%、2.56%、1.82%、1.62%和1.48%,结果表明方法的重复性良好。
2.3.5 加样回收率试验取8号大黄叶样品粉末(过6号筛)各约0.5 g 6份,精密称定,分别加入低、中、高3个质量浓度的对照品溶液(分别相当于大黄叶原有质量分数的80%、100%、120%),每一质量浓度取2份,按“2.2.2”项下方法制备,根据测得量和加入量计算各成分的加样回收率和RSD。结果没食子酸、番泻苷B、大黄酚-1-O-葡萄糖苷、大黄素-8-O-葡萄糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚的的平均回收率分别为98.26%、97.66%、 96.38%、95.76%、 98.64%、96.82%、98.36%、95.84%和96.26%,RSD分别为2.36%、1.84%、1.46%、1.72%、2.43%、2.36%、1.96%、2.03%和1.64%。
2.4 样品测定取22批待测大黄干燥叶样品各20 g,研成细粉,过60目筛。精密称取各样品约1 g,每个样品平行称2份,按“2.2.2”项下方法制备供试品溶液,并按“2.1”项下色谱条件进行9种化学成分的定量分析,测定各成分峰面积,代入回归方程,计算各成分在样品中的质量分数。结果见表 3。进一步分析结果,1、2、3年生的大黄叶中9种化学成分量,其中游离型蒽醌总量的平均值分别为0.757 5、0.816 5、0.686 2 mg/g;结合型蒽醌总量的平均值分别为0.111 4、0.072 8、0.074 4 mg/g;没食子酸的平均值分别为0.085 5、0.122 3、0.094 9mg/g;番泻苷B的平均值分别为0.564 8、0.389 1、0.291 0mg/g。
|
|
表 3 22批样品中9种成分的测定结果 (n = 3) Table 3 Determination of nine constituents in 22 batches of samples (n = 3) |
3 讨论 3.1 测定成分的筛选
现代研究表明,大黄中主要含有蒽醌类、酚类、鞣质类、氨基酸等多种化学成分,其中没食子酸、(+)-儿茶素、番泻苷A、番泻苷B、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚等的生物活性比较显著[8-10]。根据同一种植物不同器官中化学成分积累的近似性,以及前期预试验结果分析,为了合理开发利用大黄叶片资源,综合分析本实验确定同时检测没食子酸、番泻苷B、大黄酚-1-O-葡萄糖苷、大黄素-8-O-葡萄糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚9种成分[11]。
3.2 色谱条件选择本实验分别考察了乙腈-0.05%乙酸水、乙腈-0.1%乙酸水、乙腈-0.2%乙酸水;甲醇-0.05%乙酸水,甲醇-0.1%乙酸水,甲醇-0.2%乙酸水等色谱条件。甲醇-0.2%乙酸水梯度洗脱时,色谱峰分离度良好,最终选择甲醇-0.2%乙酸水的色谱条件研究大黄叶中化学成分。采用PDA检测器在200~400 nm对检测波长进行了考察;结果表明,检测波长在260 nm时色谱图所包含的信息量较大,杂质干扰较少,线性关系和重复性良好,各色谱峰分离较好,参考文献报道[11-12],故本实验选择检测波长为260 nm。
3.3 样品提取方法考察以9种成分的提取率为指标,考察了2种提取溶剂甲醇和乙醇,结果表明甲醇优于乙醇;考察了甲醇回流、超声2种提取方法,结果表明两者无明显差异;考察了甲醇超声提取30、45、60 min 3种提取时间,结果表明三者也无明显差异。综合分析,提取方法最终确定为甲醇超声30 min。
3.4 结果分析从测定结果分析,1、2、3年生的大黄叶中9种化学成分量,其中游离型蒽醌总量的平均值分别为0.757 5、0.816 5、0.686 2 mg/g,其中2年生的最高;结合型蒽醌总量的平均值分别为0.111 4、0.072 8、0.074 4 mg/g,其中1年生的最高;没食子酸的平均值分别为0.085 5、0.122 3、0.094 9mg/g,其中2年生最高;番泻苷B的平均值分别为0.564 8、0.389 1、0.291 0mg/g,其中1年生最高;分析其原因与生长年限有关,同时还与大黄化学成分在其地上、地下部位的积累和转运规律相关。至于光照、水分、伴生物等其他因素有待进一步研究分析。
另外,与《中国药典》2015年版对大黄药材中游离蒽醌总量要求不能低于0.20%要求比较,大黄叶中的游离蒽醌总量超过0.20%,这将为大黄叶的开发应用提供理论依据。
| [1] | 中国药典 [S]. 一部. 2015. |
| [2] | 兰志琼, 卢先明, 蒋桂华, 等. 大黄叶泻下、止血作用的实验研究[J]. 中药材 , 2005, 28 (3) :204–206. |
| [3] | 兰志琼, 卢先明, 蒋桂华. 大黄叶中蒽醌及鞣质类成分动态规律研究[J]. 时珍国医国药 , 2007, 18 (12) :3068–3069. |
| [4] | 黄剑, 邓良基, 范巧佳, 等. 掌叶大黄叶资源的开发与利用[J]. 中国资源综合利用 , 2004, 23 (7) :15–17. |
| [5] | 熊辉岩, 张晓峰, 谭大风, 等. 大黄属三种植物不同部分提取物清除羟基自由基的体外实验研究[J]. 食品科学 , 2003, 24 (1) :128–130. |
| [6] | 李天才, 陈桂琛, 周国英, 等. 种植青海大黄叶中矿物质元素研究[J]. 广东微量元素科学 , 2003, 10 (5) :39–40. |
| [7] | 国家中医药管理局《中华本草》编委会. 中华本草 (第五卷)[M]. 上海: 上海科学技术出版社, 1999 . |
| [8] | 王勤, 邸多隆, 蒋生祥, 等. 大黄类药物分析方法研究概况[J]. 中成药 , 2007, 29 (8) :1199. |
| [9] | 孙慧, 朱超, 章弘扬, 等. 大黄及其炮制品的液质联用分析及物质基础比较[J]. 中成药 , 2009, 31 (3) :420–424. |
| [10] | 高晓燕, 卢建秋. HPLC-DAD 法同时测定大黄中7个蒽醌类化合物的含有量[J]. 药物分析杂志 , 2010, 30 (9) :1636–1641. |
| [11] | 毛春芳, 施忠, 罗琳, 等. HPLC法同时测定大黄中芦荟大黄素等11种成分的量[J]. 中草药 , 2014, 45 (16) :2400–2403. |
| [12] | 卫昊, 冯改利, 郑洁, 等. 清蒸和酒蒸对大黄中9种化学成分的影响分析[J]. 中成药 , 2013, 35 (3) :777–780. |
 2016, Vol. 47
2016, Vol. 47

