北细辛Asarum heterotropoldes Fr. Schmidt var. mandshuricum (Maxim.) Kitag.为马兜铃科(Aristolochiaceae)多年生草本植物,又名辽细辛、烟袋锅花、东北细辛、细参等[1],其味辛性温,有祛风散寒、通窍止痛、温肺化痰等作用[2],为我国传统中药。近年来,由于过度采挖和生态环境的破坏以及生长周期长,导致北细辛的野生资源严重匮乏[3]。北细辛人工栽培多采用种子繁殖和分株繁殖2种方式,种子繁殖通常需要5~6年后才可采收而分株繁殖则存在繁殖系数低的问题,一定程度上限制了北细辛的推广应用。比较而言,组织培养具有繁殖速度快、繁殖系数高等特点,可望在短期内繁殖出大量性状一致的优良种苗,以缓解北细辛资源紧缺的局面,目前,已建立细辛属植物如大花细辛、华细辛、汉城细辛和皱花细辛的快繁体系[4-6],而有关北细辛组织培养方面仅有愈伤组织诱导的报道[7-10],
但多以根状茎[7-8]或叶片[9]为外植体,并且尚未建立完善的再生体系。
基于课题组的前期研究结果[10],本研究以北细辛幼嫩叶柄为外植体诱导得到的愈伤组织为试验材料,探讨不同浓度的6-苄基腺嘌呤(6-BA)和萘乙酸(NAA)对愈伤组织增殖的影响,同时筛选愈伤组织再生芽和不定根分化的最适培养条件,建立高效的北细辛再生体系,使北细辛种苗的规模化生产成为可能,为北细辛种质资源的离体保存及可持续利用提供保障。
1 材料与方法 1.1 材料样品取自黑龙江省中医药大学药用植物园和黑龙江省森林植物园药物园,经笔者鉴定为北细辛Asarum heterotropoldes Fr. Schmidt var. mandshuricum (Maxim.) Kitag.。将其幼嫩叶柄经70%乙醇和0.1%升汞处理后用于无菌接种[10]。
1.2 方法 1.2.1 叶柄愈伤组织的诱导与增殖将无菌外植体切成0.5~1.0 cm的小段,接种于添加0.6 mg/L 6-BA和0.15 mg/L NAA的1/2 MS培养基中。出愈后每15天继代1次,继代培养3~4次后移至含不同质量浓度6-BA和NAA的1/2 MS培养基中进行增殖培养。培养基中附加30 g/L蔗糖,调pH至5.8,121 ℃高压湿热灭菌20 min。培养温度(25±1)℃,相对湿度50~60%,光照强度30 μmol/(m2∙s),光照时间16 h/d。
1.2.2 不定芽的诱导及壮苗培养选取嫩绿且结构致密的愈伤组织,以1/2 MS为基本培养基,6-BA和NAA协同使用,以2因素5水平的正交试验进行不定芽诱导,观察并统计不定芽的诱导率及每块愈伤组织产生芽的数量。
不定芽生长4~6周后,从基部切下接种到无激素添加的1/2 MS培养基上进行壮苗培养。
1.2.3 再生芽的生根培养当分离的不定芽长至2~3 cm时,将其接种至添加不同浓度吲哚丁酸(IBA)(0、0.1、0.25、0.5 mol/L)的1/2 MS或1/4 MS生根培养基中,培养30 d后统计生根率、生根数。
1.2.4 移栽炼苗移栽前将再生苗移到自然环境下锻炼2~3 d,然后开口练苗1~2 d。取出再生小苗,用清水洗掉根部附着的培养基,然后移栽至腐殖质、草炭土和蛭石等比例混合的灭菌基质中。保持环境温度20 ℃左右,相对湿度90%~100%。
移栽成活率=移栽成活数/总移栽数
2 结果与分析 2.1 叶柄愈伤组织的增殖以北细辛幼嫩叶柄为外植体,接种于含0.6 mg/L 6-BA和0.15 mg/L NAA的1/2 MS诱导培养基上,培养7~12 d即可诱导出黄绿色的愈伤组织(图 1-a)。继代培养过程中,切口处会逐渐出现褐化现象,愈伤组织生长缓慢(图 1-b)。愈伤组织增殖培养时,不同质量浓度组合的6-BA和NAA影响愈伤组织的增殖状况,由表 1可以看出,6-BA和NAA分别为0.40和0.10 mg/L时,愈伤组织增殖迅速,褐化情况明显改善,且结构致密,颜色深绿(图 1-c)。

|
图 1 北细辛叶柄愈伤组织的器官分化 Fig.1 Organ differentiation from petiole-derived callus of A. heterotropoides |
|
|
表 1 不同质量浓度外源激素对愈伤组织增殖的影响 Table 1 Effects of exogenous hormones at different concentration on callus proliferation |
2.2 北细辛不定芽诱导及壮苗培养
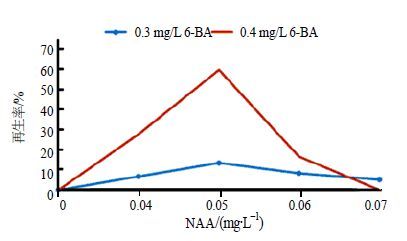
图 2表明,愈伤组织在只添加6-BA的分化培养基中不能诱导出不定芽,而6-BA与NAA组合使用时,可分化出一定数量的再生芽。研究发现,当分化培养基中6-BA的质量浓度高于0.4 mg/L时,愈伤组织严重褐化甚至死亡,不能用于芽的分化培养。0.3 mg/L 6-BA与0.04~0.07 mg/L NAA协同作用,虽可诱导出不定芽,但增殖极其缓慢,继代过程逐渐玻璃化(表 2)。比较而言,在含0.4 mg/L 6-BA和0.05 mg/L NAA的1/2 MS培养基中,不定芽再生率最高,为60%,愈伤组织表面产生大量的不定芽(图 1-d~f),每个愈伤组织大约产生35个不定芽,芽长势较好,可以正常生长展叶,叶色嫩绿(图 1-g~h)。因此,1/2 MS+0.4 mg/L 6-BA+0.05 mg/L NAA是叶柄愈伤组织再生芽分化的最佳培养条件。
|
图 2 不同质量浓度NAA对北细辛不定芽再生率的影响 Fig.2 Effects of NAA at different concentration on adventitious shoot regeneration |
壮苗培养时,再生芽在不添加任何激素的1/2 MS中,叶柄快速伸长生长,叶片增大变厚,叶色由浅绿色变为深绿色(图 1-i)。
|
|
表 2 外源激素对北细辛不定芽分化的影响 Table 2 Effect of different exogenous hormones on adventitious shoot differentiation in A. heterotropoides |
2.3 不同质量浓度IBA对再生芽生根的影响
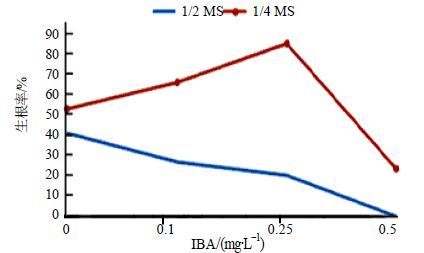
由图 3可以看出,壮苗后的再生芽在有无IBA的1/4 MS或1/2 MS培养基中,均可在再生芽基部出现白色的突起,随后逐渐发育成不定根。比较发现,1/4 MS培养基添加0.25 mg/L IBA时,再生芽的生根率最高,为85.7%,平均生根数为9~10条,出根时间短(表 3),形成的不定根也较粗(图 1-k)。而在1/2 MS培养基中,无论有无IBA,不定根诱导所需天数均较长,且不定根长势较弱,不适于生根培养(图 1-j)。
|
图 3 IBA质量浓度对北细辛生根率的影响 Fig.3 Effects of different concentration of IBA on rooting rate |
|
|
表 3 不同培养条件对北细辛不定根分化的影响 Table 3 Effect of different culturing conditions on adventitious root differentiation in A. heterotropoides |
将驯化后再生苗移栽至腐殖质、草炭土和蛭石等比例混合的基质中,12 d后小苗叶片伸展,并在基部长出新叶(图 1-l);移栽5周后,不定根长出大量侧根。移栽成活率达90%。
3 讨论植物组织培养时植株再生可由外植体直接(丛生苗)或间接(愈伤组织分化)等2种途径获得,
间接途径需先后经历愈伤组织诱导、增殖及分化等过程,其中愈伤组织诱导是再生体系建立的前提,而愈伤组织增殖状况则直接影响着繁殖系数的高低。大量研究表明外源激素在愈伤组织的诱导与增殖中起到重要作用,但它可能只是作为脱分化、再分化等发育信号,还须通过内源激素水平来发挥其调控作用[11]。只有各种外源激素浓度比例适中,才可能保持内源激素的某种平衡,指令特定的细胞分裂或分化。本研究发现,若采用愈伤组织诱导时的激素组合即0.6 mg/L 6-BA和0.15 mg/L NAA,愈伤组织增殖过程将出现褐化现象,继续升高激素质量浓度,愈伤组织褐化更加严重,不利于愈伤组织的增殖。较低的激素组合(0.4 mg/L 6-BA和0.1 mg/L NAA)下增殖的愈伤组织状况良好,可产生一定量的愈伤组织。推测不同外源激素质量浓度配比导致不同的内源激素水平,继而产生不同的增殖效果。
本研究发现紧凑致密、颜色嫩绿的愈伤组织利于再生芽的分化(图 1-c),George等[12]认为器官发生主要在氧气环境不足的条件下进行,Das等[13]则认为紧凑致密的愈伤组织细胞聚集,可以更有效地合成叶绿素,从而为不定芽的生长提供物质基础。外源激素是影响愈伤组织分化的重要因素,较高质量浓度的细胞分裂素促进芽的形成,而同时应配合使用低质量浓度的生长素[14]。北细辛叶柄愈伤组织增殖时6-BA(0.4 mg/L)与NAA(0.1 mg/L)的最佳质量浓度比例为4∶1,再生芽分化时则为8∶1(0.4 mg/L 6-BA和0.05 mg/L NAA),而不含生长素或生长素浓度过低时分化的芽少且长势弱,进一步说明细胞分裂素与生长素比例高利于再生芽的分化。若长时间保持较高质量浓度的细胞分裂素,虽有利于提高增殖系数,但再生芽往往细弱,且不易生根[15]。本研究将剥离的不定芽转接到不添加任何外源激素的1/2 MS培养基中,获得了生长速度快、健壮的再生芽,为成功地生根培养奠定基础。
一般认为矿质元素浓度较低时,有利于生根[16-17]。本研究也发现大量元素量较低的1/4 MS培养基更适合不定根的诱导,与已有的生根培养研究结果一致[18-20]。生长素类NAA与IBA经常用于不定根的诱导,但NAA具有促进细胞分裂扩大的作用,在组织培养过程中容易形成愈伤组织且使材料老化[21-22],而IBA则对不定根的诱导效果较好[23-24]。本研究以0.25 mg/L IBA的生根效果较为理想,根系发育良好、粗壮、无愈伤。生根后的组培苗移栽前须经历炼苗驯化过程,使之逐渐适应自然环境条件。基于本研究完善的再生体系,已成功获得再生植株,使北细辛种质资源保存及新种质创制成为可能。
| [1] | 张亚玉, 王英平, 赵兰坡. 北细辛的研究现状[J]. 特产研究 , 2004 (4) :50–54. |
| [2] | 中国药典 [S]. 一部. 2010. |
| [3] | 王馨, 鸭乔, 杨熊明, 等. 2个灯盏细辛新品种的选育[J]. 中草药 , 2013, 44 (13) :1831–1835. |
| [4] | 李洪林, 付志惠, 康强胜, 等. 大花细辛的组织培养[J]. 植物生理学通讯 , 2005, 41 (6) :784–786. |
| [5] | 詹立平, 张建军, 刘志梅. 细辛组织培养技术研究[J]. 中国当代医药 , 2013, 20 (4) :65–66. |
| [6] | 闫晓慧, 谈锋, 王瑞波, 等. 濒危植物皱花细辛的组织培养[J]. 广东农业科学 , 2013, 40 (7) :149–151. |
| [7] | 段曼姣. 细辛组织快繁技术[J]. 郴州师范高等专科学校学报 , 2001, 22 (2) :120–121. |
| [8] | 萧洪东, 聂磊, 蓝旭东, 等. 细辛组织培养快速繁殖初探[J]. 佛山科学技术学院学报: 自然科学版 , 2004, 22 (2) :67–68. |
| [9] | 南桂仙, 金光德. 细辛组织培养研究[J]. 河北农业科学 , 2009, 13 (7) :39. |
| [10] | 张劲松, 于婷婷, 何朋, 等. 北细辛愈伤组织诱导及其解剖结构观察[J]. 中草药 , 2015, 46 (4) :566–571. |
| [11] | 颜昌敬. 植物组织培养手册[M]. 上海: 上海科学技术出版社, 1990 . |
| [12] | George E F, Sherrington P D. Plant Propagation by Tissue Culture[M]. Eversley: Exegetics Ltd, 1984 . |
| [13] | Das J, Mao A A, Handique P J. Callus-mediated organogenesis and effect of growth regulators on production of different valepotriates in Indian valerian (Valeriana jatamansi Jones[J]. Acta Physiol Planta , 2013, 35 (1) :55–63. |
| [14] | Skoog F, Miller C O. Chemical regulation of growth and organ formation in plant tissues cultured in vitro[J]. Symp Soc Exp Biol , 1957, 11 :118–130. |
| [15] | 肖尊安. 植物生物技术[M]. 北京: 化学工业出版社, 2005 . |
| [16] | Manzanera J, Pardos J. Micropropagation of juvenile and adult Quercus suber L[J]. Plant Cell, Tiss Org Cult , 1990, 21 (1) :1–8. |
| [17] | Purohit S, Dave A, Kukda G. Somatic embryogenesis and plantlet regeneration in ‘safed musli’ (Chlorophytum borivilianum)[J]. Indian J Plant Genet Resour , 1994, 7 (1) :65–71. |
| [18] | 王慧梅, 王文杰, 董凤丽, 等. 影响喜树组织培养苗离体生根的因素[J]. 植物学通报 , 2005, 21 (6) :673–681. |
| [19] | 孙晓敏, 陈争, 李美飞, 等. 光皮桦组织培养离体再生研究[J]. 西北植物学报 , 2012, 32 (3) :604–610. |
| [20] | 徐文华, 陈桂琛, 周国英, 等. 藏药马尿泡离体快繁技术研究[J]. 中草药 , 2009, 40 (2) :297–300. |
| [21] | 李林轩, 吴庆华, 蔡锦源, 等. 五指毛桃组织培养获得再生植株的研究[J]. 中草药 , 2014, 45 (17) :2547–2551. |
| [22] | 赵晓杰, 李晓灿, 宇佳, 等. 生长调节剂和培养方式对匍枝筋骨草生根及β-蜕皮激素量的影响[J]. 中草药 , 2011, 42 (9) :1828–1832. |
| [23] | Fracaro F, Echeverrigaray S. Micropropagation of Cunila galioides, a popular medicinal plant of south Brazil[J]. Plant Cell, Tiss Org Cult , 2001, 64 (1) :1–4. |
| [24] | Rani G, Grover I. In vitro callus induction and regeneration studies in Withania somnifera[J]. Plant Cell, Tiss Org Cult , 1999, 57 (1) :23–27. |
 2016, Vol. 47
2016, Vol. 47


