2. 东北林业大学 林木遗传育种国家重点实验室, 黑龙江 哈尔滨 150040
2. Key Laboratory of Forest Tree Genetic Improvement and Biotechnology of Nation, Northeast Forestry University, Harbin 150040, China
三萜类物质为白桦重要的次生代谢产物,其主要成分白桦酯醇、白桦酯酸和齐墩果酸在增强免疫力、刺激吞噬细胞杀死肿瘤和病毒感染、调脂及保肝等方面有良好的疗效,因此当前白桦中三萜类物质在新药开发中具有巨大潜力[1-3]。
茉莉酸类物质(jasmonates,JAs)和温度胁迫作为诱导子在促进次生代谢产物合成与积累中已得到广泛应用,当前研究其相关信号转导通路下对次生代谢产物合成途径的调控及对植物抗逆性提高的机制[4-6],已成为研究热点。JAs主要包括茉莉酸(jasmonic acid,JA)及其衍生物如茉莉酸甲酯(methyl-jasmonate,MeJA,也称为甲基茉莉酸)[7]。研究表明,JAs在植物中的调控作用主要分为与发育和与胁迫相关的诱导2种,JAs会强烈抑制细胞生长,促进细胞衰老,同时诱导植物相关防御酶活性的提高,促进细胞初生代谢途径向次生代谢途径转换,并通过激活相关调控植物次生代谢产物合成的关键酶基因和转录因子,最终提高目标次生代谢产物的合成与积累[8-13]。罗建平等[14]对怀槐悬浮细胞添加200 μmol/L MeJA后的3~9 d,细胞中异黄酮量比对照明显增加。Hayashi等[15]在研究外源MeJA对甘草组培细胞合成大豆皂苷的影响中,发现甘草细胞在加入100 μmol/L的MeJA培养10 d后β-香树脂醇合酶(BAS)表达量比对照提高11倍,大豆皂苷的量也明显高于对照。施江[16]利用MeJA诱导茶树鲜叶次生代谢产物的研究中发现在MeJA诱导茶树鲜叶24 h后醇类物质变化最为显著,芳樟醇相对量从30.87%增加到37.92%,芳樟醇氧化物II相对量从6.03%增加到9.18%,橙花叔醇相对量从1.47%增加到4.45%。
高温胁迫同样会对植物次生代谢产物的合成产生重要影响,李波等[17]在研究高温胁迫对苜蓿愈伤组织中异黄酮合成与积累的影响中,发现25~35 ℃的温度胁迫下,苜蓿愈伤组织中异黄酮量在25 ℃和30 ℃下最高,其组分量分别增加0.497%和0.570%。本课题组前期研究发现在35~55 ℃分别处理白桦悬浮细胞1、2、4 h后,在50 ℃处理2 h后白桦细胞总三萜量最高。
在本课题组前期的研究中发现50 ℃处理2 h为利用高温胁迫诱导白桦茎段悬浮细胞合成三萜类物质的最优高温处理条件,在此基础上添加信号物质MeJA,探索高温胁迫和MeJA信号互作对其三萜类物质合成及次生代谢相关的生理生化指标的影响,初步探究非生物胁迫对诱导白桦细胞三萜类物质生物合成和积累的相关机制。
1 材料与方法 1.1 材料样品由东北林业大学生命科学学院詹亚光教授鉴定为白桦Betula platyphylla Suk. 组培苗茎段,为诱导愈伤组织的外植体,筛选生长良好的白桦悬浮细胞为材料,每100毫升锥形瓶中装入50 mL的NT液体培养基,并加入3 g白桦悬浮细胞,放入摇床中(转速120 r/min)悬浮培养,培养温度为24~26 ℃,光照强度为2 000 lx。MeJA购自美国Sigma公司。
1.2 方法 1.2.1 白桦悬浮细胞的处理MeJA处理浓度设置4个水平:25、50、100、150 μmol/L;高温胁迫为50 ℃处理2 h。分别在细胞培养的第6、7天进行不同处理,共4组(6dT+7dM、6dM+7dT、6dM和7dM),同时设置对照CK、CK(T1)和CK(T2),不同的处理具体可见表 1。
|
|
表 1 不同MeJA和高温胁迫的处理组合 Table 1 Combinations of different MeJA and high temperature stress |
白桦细胞在细胞培养的第8天统一收获,然后分别称定质量并检测细胞活力大小,丙二醛量,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、苯丙氨酸裂解酶(PAL)和多酚氧化酶(PPO)的活性,总三萜量及采用荧光定量PCR方法检测白桦细胞中三萜合成途径关键酶鲨烯合酶(SS)、鲨烯环氧酶(SE)、羽扇醇合酶(BPW)和β-香树酯醇合酶(BPY)基因的相对表达量。
1.2.2 白桦细胞生长量的测定将不同处理后的白桦茎段悬浮细胞分别用细胞筛滤过,然后用适量蒸馏水冲洗并迅速用滤纸吸去细胞表面水分,最后称量各组细胞鲜质量。
1.2.3 白桦细胞总三萜和丙二醛量的测定白桦细胞总三萜和丙二醛量的测定参考赵微等[18]方法。
1.2.4 白桦细胞活力的测定白桦细胞活力的测定具体参考黄纯农[19]的方法。
1.2.5 白桦细胞SOD、CAT、PAL和PPO活性的测定 1.2.6 白桦三萜合成酶关键基因表达的测定采用实时荧光定量PCR(real-time PCR)反应,RNA的提取,采取及反转录均采用TaKaRa公司生产的试剂盒(RNA Extraction kit和PrimeScript RT reagent Kit),具体操作参见说明书;实时荧光定量PCR反应:使用2×SYBR Premix Ex TaqTM II荧光定量PCR试剂盒,具体操作参见王艳等[22]方法。
2 结果与分析 2.1 MeJA结合高温胁迫对白桦细胞生长量的影响细胞生长量如图 1所示,单独的MeJA(25~150 μmol/L)和高温处理都能抑制白桦细胞鲜质量的增加,其中6dM处理在150 μmol/L的MeJA处理后最低,比空白对照减少38.6%。MeJA结合高温的复合处理对细胞生长的抑制作用比单独的MeJA和高温处理更强烈,其中6dM+7dT处理后细胞生长量最低,以6dM+7dT在MeJA浓度为150 μmol/L时下降最大,分别比空白对照、单独的MeJA和高温处理减少43.2%、7.5%和24.5%。以上结果表明,MeJA和高温胁迫都可抑制细胞生长,且二者的复合处理抑制作用更强。
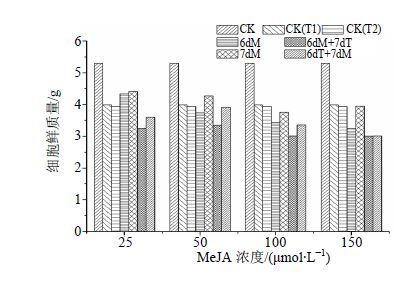
|
图 1 MeJA结合高温胁迫对白桦悬浮培养细胞生长量的影响 Fig.1 Effects of MeJA combined with high temperature stress on growth of birch suspension culture cells |
2.2 MeJA结合高温胁迫对白桦细胞总三萜量的影响
如图 2所示,单独的高温和MeJA处理都能提高白桦细胞总三萜的量,其中CK(T1) 和第6天加入150 μmol/L的MeJA处理后总三萜量最高,分别为68.3和53.5 mg/g,分别比空白对照增加61.5%和26.7%。
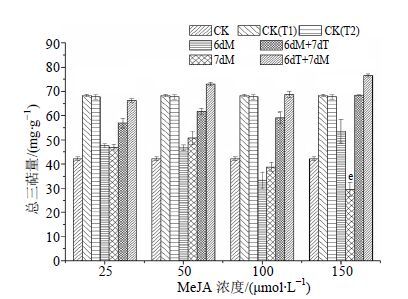
|
图 2 MeJA结合高温胁迫对白桦悬浮培养细胞总三萜积累量的影响 Fig.2 Effects of MeJA combined with high temperature stress on accumulation of total triterpenoid in birch suspension culture cells |
MeJA结合高温的复合处理对细胞总三萜合成的诱导作用比单独的MeJA和高温处理更强,且6dT+7dM处理后的白桦细胞三萜量都较高。其中6dT+7dM处理在MeJA浓度为150 μmol/L时细胞总三萜量最高,为76.6 mg/g,分别比空白对照、单独的MeJA和高温处理增加81.3%、159.9%和13.1%;6dT+7dM处理在MeJA浓度为50 μmol/L时的处理次之,为73.1 mg/g,分别比空白对照、单独的MeJA和高温处理增加72.9%、43.9%和7.9%。以上结果说明MeJA和高温胁迫都能促进白桦细胞三萜的合成,且高温胁迫1 d后加入MeJA处理对白桦总三萜合成的诱导作用最强。
2.3 MeJA结合高温胁迫对白桦细胞活力和丙二醛量的影响单独的MeJA和高温处理都能诱导白桦细胞活力下降,其中CK(T1) 和第7天加入150 μmol/L的MeJA处理后细胞活力最低,分别比空白对照减少85.5%和71.2%(图 3-A)。MeJA结合高温的复合处理后细胞活力明显低于仅加入MeJA的处理和空白对照,但高于单独的高温处理,其中6dM+7dT处理在MeJA浓度为50 μmol/L时细胞活力较单独的高温处理上升最明显,增加189.3%(图 3-A)。丙二醛量在不同的处理后普遍高于空白对照,其中CK(T2) 和第6天加入100 μmol/L的MeJA处理后丙二醛量最高,分别比空白对照增加27.9%和78.0%;6dT+7dM处理在MeJA浓度为150 μmol/L时丙二醛量较高,分别比空白对照、单独的MeJA和高温处理增加42.6%、25.0%和11.5%(图 3-B)。以上结果表明,高温和MeJA处理及二者的复合处理后能抑制细胞活力,促进丙二醛量的增加。
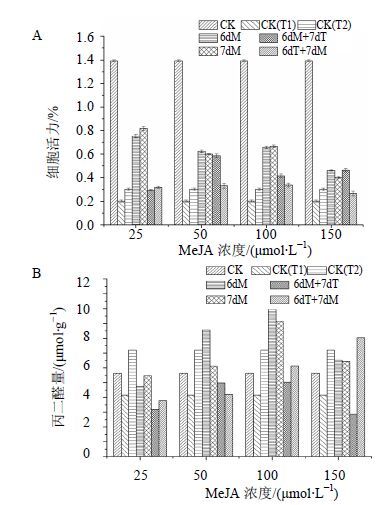
|
图 3 MeJA结合高温胁迫对白桦悬浮培养细胞活力 (A) 和丙二醛量 (B) 的影响 Fig.3 Effects of MeJA combined with high temperature stress on activity of cell viability (A) and content of MDA (B) in birch suspension culture cells |
2.4 MeJA结合高温胁迫对白桦细胞防御酶活性的影响
MeJA和高温及二者的复合处理都能诱导白桦细胞的SOD活性增加,其中CK(T1) 和第6天加入50 μmol/L的MeJA处理后SOD活性最高,分别比空白对照增加51.7%和114.2%(图 4-A);MeJA结合高温的复合处理后SOD活性也较高,其中6dT+7dM处理在MeJA浓度为150 μmol/L时SOD活性上升最大,分别比空白对照、单独的MeJA处理和高温处理增加57.6%、23.7%和60.4%(图 4-A)。单独的MeJA和高温处理后白桦细胞的CAT活性都低于空白对照,其中CK(T1) 和第6天加入25 μmol/L的MeJA处理后CAT活性最低,分别比空白对照减少89.2%和73.9%(图 4-B)。MeJA结合高温的复合处理后CAT活性明显低于空白对照和单独的MeJA处理,但高于单独的高温处理。其中6dT+7dM处理在MeJA浓度为150 μmol/L时CAT活性最高,比单独的高温处理增加12.0%(图 4-B)。单独的MeJA和高温处理都能诱导白桦细胞的PAL活性增加,其中CK(T2) 和第6天加入25 μmol/L的MeJA处理后PAL活性最高,分别比空白对照增加500.0%和633.3%(图 4-C)。
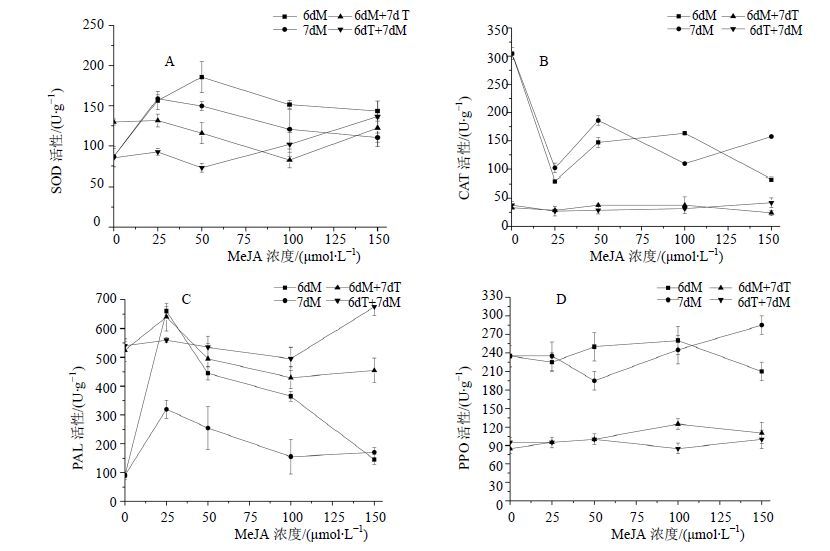
|
图 4 MeJA结合高温胁迫对白桦悬浮培养细胞中SOD (A)、CAT (B)、PAL (C) 和PPO (D) 的影响 Fig.4 Effects of MeJA combinedhigh temperature stress on activity of SOD (A),CAT (B),PAL (C),and PPO (D) inbirch suspension culture cells |
MeJA结合高温的复合处理以6dT+7dM处理在MeJA浓度为150 μmol/L时PAL活性最高,分别比空白对照、单独的MeJA和高温处理增加650.0%、297.1%和25.0%(图 4-C)。高温处理后的白桦细胞PPO活性降低;MeJA处理后PPO活性高于空白对照,其中第7天加入150 μmol/L的MeJA处理后PPO活性最高,比空白对照增加21.3%(图 4-D);MeJA结合高温的复合处理后PPO活性低于空白对照,但比单独的高温处理有所增加,其中6dM+7dT处理在MeJA浓度为100 μmol/L时PPO活性最高,比单独的高温处理增加47.1%(图 4-D)。以上结果表明,MeJA和高温处理及二者的复合处理可能通过调节防御酶(SOD、CAT、PAL和PPO)活性的变化,进一步诱导白桦细胞三萜物质的合成。
2.5 MeJA结合高温胁迫对白桦三萜合成关键酶基因表达的影响单独的MeJA和高温处理都能提高SS基因相对表达量,其中在CK(T1) 和第6天加入100 μmol/L的MeJA后相对表达量最高,分别比空白对照增加93.6%和189.7%(图 5-A)。MeJA结合高温的复合处理后SS基因相对表达量明显高于单独的MeJA和高温处理,且6dT+7dM处理总体都较高,其中6dT+7dM处理在MeJA浓度为25 μmol/L时相对表达量最大,分别比空白对照、单独的MeJA和高温处理增加313.4%、495.6%和338.1%(图 5-A)。单独的MeJA和高温处理都能提高BPW基因相对表达量,其中在CK(T1)和第6天加入25 μmol/L的MeJA处理后BPW基因相对表达量最高,分别比空白对照增加321.6%和1 877.3%(图 5-B)。MeJA结合高温的复合处理后BPW基因相对表达量明显高于单独的MeJA和高温处理,且6dT+7dM处理总体都较高,其中6dT+7dM处理在MeJA浓度为50 μmol/L时表达量最大,分别比空白对照、单独的MeJA和高温处理增加1 111.9%、411.7%和256.9%(图 5-B)。单独的MeJA处理仅在第6天加入50 μmol/L的MeJA后SE基因相对表达量上调,比空白对照增
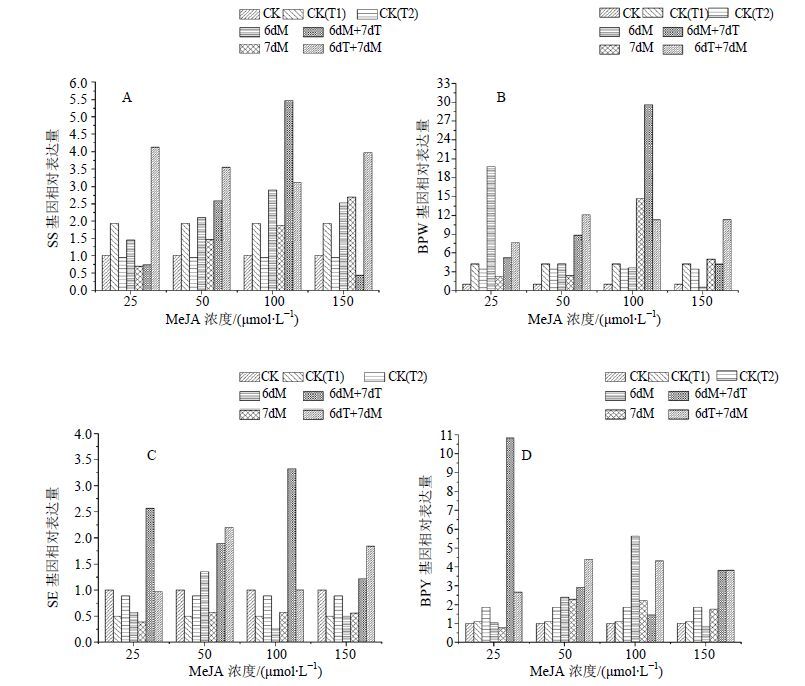
|
图 5 MeJA结合高温胁迫对白桦悬浮培养细胞SS (A)、BPW (B)、SE (C) 和BPY (D) 基因相对表达量的影响 Fig.5 Effects of MeJA combined with high temperature stress on relative expression of SS (A),BPW (B),SE (C),and BPY (D) gene in birch suspension culture cells |
加35.3%。MeJA结合高温的复合处理后SE基因相对表达量明显高于单独的MeJA和高温处理及空白对照,其中6dM+7dT处理在MeJA浓度为100 μmol/L时相对表达量最高,分别比空白对照,单独的MeJA和高温处理增加232.4%、1 209.4%和567.2%。单独的MeJA和高温处理都能提高BPY基因相对表达量,其中在CK(T2) 和第6天加入100 μmol/L的MeJA处理后BPY基因相对表达量最高,分别比空白对照增加85.8%和462.8%。MeJA结合高温的复合处理后BPY基因相对表达量明显高于单独的MeJA和高温处理,且6dT+7dM处理总体都较高,其中6dT+7dM处理在MeJA浓度为50 μmol/L时表达量最大,分别比空白对照、单独的MeJA和高温处理增加339.6%、92.9%和136.6%。以上结果表明,单独的MeJA或高温处理都能诱导SS、BPW和BPY基因的表达上调,且二者的复合处理对SS、BPW、SE和BPY基因的表达的诱导作用更强。
3 讨论高温胁迫和MeJA在促进植物次生代谢合成的研究中已经得到了广泛的应用,在前期的研究[23-25]中发现利用MeJA或高温处理的方法可提高白桦幼树、喜树苗和甘草细胞中次生代谢产物的量。本研究发现白桦细胞在单独的高温和MeJA处理后细胞内总三萜的量也明显增加,而且在第6天高温胁迫后加入MeJA的复合处理(6dT+7dM)后,次生代谢产物总三萜量最高,此时三萜合成关键酶基因中SS、SE、BPW和BPY相对表达量都明显高于其他处理,其中6dT+7dM在MeJA浓度为50和150 μmol/L时总三萜量最高,分别为73.1和76.6 mg/g,分别比空白对照增加72.9%和81.3%,比单独的MeJA处理增加43.9%和159.9%,比单独的高温处理增加7.9%和13.1%(图 2)。SS主要将2分子法呢基二磷酸(FPP)转换成鲨烯,然后在SE作用下进一步生成2,3-氧化鲨烯,最后在不同的三萜合成酶的作用下,合成不同的三萜物质,如BPW合成白桦酯醇和白桦酯酸;BPY合成齐墩果酸等[26-28]。本研究发现在6dT+7dM处理在MeJA浓度为50和150 μmol/L时SS、SE、BPY和BPW基因相对表达量上调,分别比空白对照增加255.3%和297.1%、119.8%和83.7%、339.6%和282.4%、1 111.9%和1 032.6%(图 5),此外,在6dM+7dT在MeJA浓度为100 μmol/L时SS、SE和BPW表达量也明显上调,但三萜量却较低,这可能为在白桦三萜合成的途径中,可能还有其他三萜合成的关键酶基因起到 重要作用。通过施加外源MeJA可以有效提高植物的耐热性,而且MeJA和高温处理会对植物细胞的正常生理代谢产生一系列影响,如引起细胞衰老,活性氧的增加,破坏植物细胞的膜完整性,诱导相关防御酶的启动,从而激活次生代谢产物合成酶关键酶基因表达,最终促进植物次生代谢产物的合成与积累[8, 29-32]。SOD、CAT、PPO和PAL是植物体内重要的防御酶,其中SOD、CAT是植物重要的氧自由基清除酶,SOD将O2−转换为H2O2、CAT能分解H2O2,最终通过二者的协同作用缓解活性氧对植物细胞造成的伤害;PPO也是植物重要的氧化还原酶,其在抵抗微生物的侵染,降低酚类物质对细胞的损害,增强植物抗逆性等方面都具有重要作用;PAL是许多重要次生代谢产物合成的关键酶[33-37]。在本课题组及巩慧玲 [38]的研究中已经发现白桦细胞、马尿泡和烟草愈伤组织在高温处理后可抑制细胞的生长和细胞活力,诱导防御酶(SOD、CAT、APX和POD)活性的增加。在研究中发现在外源的MeJA处理可诱导红豆杉细胞和胀果甘草细胞防御酶SOD、CAT、POD和PAL活性及MDA量的增加[25, 39]。本研究发现单独的MeJA或高温处理都能引起细胞内MDA量、SOD和PAL活性的增加,抑制白桦细胞生长量和细胞活力,与上述研究结果相似。在研究中发现[40-42],在高温胁迫下,通过添加外源MeJA可增加蝴蝶兰、葡萄和萝卜幼苗SOD、CAT和APX的活性,降低细胞的相对电导率、电解质渗透率。本研究发现高温胁迫前后加入MeJA处理,都能提高SOD、CAT、PAL和PPO的活性,其中SOD、CAT和PAL的活性以6dT+7dM在MeJA浓度为150 μmol/L时明显上升,分别比高温处理增加60.4%、12.0%、25.0%(图 4);PPO活性以6dM+7dT处理在MeJA浓度为100 μmol/L时明显上升,比高温处理增加47.1%(图 4-D),与上述研究结果相似。此外,本研究还发现,高温胁迫前加入MeJA的处理,白桦细胞的细胞活力也高于高温处理,以6dM+7dT处理在MeJA浓度为50 μmol/L时明显上升,比高温处理增加189.3%(图 3-A)。
综合上述分析,在高温胁迫后加入MeJA处理后,虽然白桦细胞的生长受到抑制,但细胞活力、SOD、CAT、PAL和PPO的活性比单独高温处理都有不同程度地增加,而且丙二醛的量也低于单独的高温处理,这可能是在高温诱导的基础上,MeJA通过进一步调节下游相关防御酶的活性等防御反应的启动,一方面增强了细胞的耐热性,一方面也诱导了白桦次生代谢产物三萜合成关键酶基因SE、SS、BPW和BPY相对表达量的上调,最终促进细胞三萜物质的合成与积累。
4 结论本研究发现在高温胁迫(50 ℃处理2 h)1 d后再加入MeJA的复合处理对白桦细胞次生代谢产物总三萜合成的诱导作用最强,并以高温胁迫1 d后加入150 μmol/L的MeJA处理最高,此时白桦细胞的防御酶活性、细胞活力及三萜合成酶基因的相对表达量都不同程度高于单独的高温处理,表明在高温胁迫后加入的MeJA通过调节白桦细胞相关的生理生化反应,缓解高温胁迫对细胞的伤害,同时也促进了白桦细胞高效地合成三萜物质。
| [1] | 尹静, 詹亚光, 肖佳雷. 白桦三萜的合成和调控[J]. 植物生理学通讯 , 2009 (5) :520–526. |
| [2] | Kuznetsova T A, Ivanushko L A, Makarenkova I D, et al. Effects of S. officinalis L. Radix triterpene glycosides on innate immunity factors[J]. Bull Exp Biol Med , 2014, 156 (3) :366–369. |
| [3] | Dang Z, Qian K, Ho P, et al. Synthesis of betulinic acid derivatives as entry inhibitors against HIV-1 and bevirimat-resistant HIV-1 variants[J]. Bioorg Med Chem Lett , 2012, 22 (16) :5190–5194. |
| [4] | 郭艳玲, 张鹏英, 郭默然, 等. 次生代谢产物与植物抗病防御反应[J]. 植物生理学报 , 2012, 48 (5) :429–434. |
| [5] | Harms K, Atzorn R, Brash A, et al. Expression of a flax allene oxide synthase cDNA leads to increased endogenous jasmonic acid (JA) levels in transgenic potato plants but not to a corresponding activation of JA-responding genes[J]. Plant Cell Online , 1995, 7 (10) :1645–1654. |
| [6] | Zhao J, Davis L C, Verpoorte R. Elicitor signal transduction leading to production of plant secondary metabolites[J]. Biotechnol Advs , 2005, 23 (4) :283–333. |
| [7] | 蒋科技, 皮妍, 侯嵘, 等. 植物内源茉莉酸类物质的生物合成途径及其生物学意义[J]. 植物学报 , 2010, 45 (2) :137–148. |
| [8] | 蔡昆争, 董桃杏, 徐涛. 茉莉酸类物质 (JAs) 的生理特性及其在逆境胁迫中的抗性作用[J]. 生态环境 , 2006, 15 (2) :397–404. |
| [9] | 李天, 王艳颖, 张馨跃, 等. 茉莉酸甲酯处理对鲜切芹菜生理品质的影响[J]. 食品研究与开发 , 2014, 35 (9) :120–124. |
| [10] | 王艳东, 元英进. 甲基茉莉酮酸对悬浮培养南方红豆杉细胞代谢的影响[J]. 中草药 , 2003, 34 (1) :27–30. |
| [11] | 杨欣, 徐艳红, 魏建和, 等. 几种重要植物次生代谢防御反应物质的生物合成途径及分子调控机制研究进展[J]. 生物技术通讯 , 2013 (2) :285–289. |
| [12] | Pauw B, Memelink J. Jasmonate-responsive gene expression[J]. J Plant Growth Regulat , 2004, 23 (3) :200–210. |
| [13] | Maes L, Van Nieuwerburgh F C W, Zhang Y, et al. Dissection of the phytohormonal regulation of trichome formation and biosynthesis of the antimalarial compound artemisinin in Artemisia annua plants[J]. New Phytol , 2011, 189 (1) :176–189. |
| [14] | 罗建平, 夏宁, 沈国栋, 等. 茉莉酸甲酯、水杨酸和一氧化氮诱导怀槐悬浮细胞合成异黄酮及细胞结构变化[J]. 分子细胞生物学报 , 2006, 39 (5) :438–444. |
| [15] | Hayashi H, Huang P, Inoue K. Up-regulation of soyasaponin biosynthesis by methyl jasmonate in cultured cells of Glycyrrhiza glabra[J]. Plant Cell Physiol , 2003, 44 (4) :404–411. |
| [16] | 施 江. 外源茉莉酸甲酯诱导对茶树鲜叶次生代谢产物的影响 [D]. 北京: 中国农业科学院, 2014. |
| [17] | 李波, 肖静, 李铁, 等. 不同条件对苜蓿愈伤组织异黄酮含量的影响 (简报)[J]. 草地学报 , 2007, 15 (5) :500–502. |
| [18] | 赵微, 尹静, 詹亚光, 等. 温度胁迫对白桦悬浮细胞中三萜积累及防御酶活性的影响[J]. 中国生物工程杂志 , 2013, 33 (2) :34–40. |
| [19] | 黄纯农. 用FDA-PI双色荧光法鉴定大麦原生质体活性[J]. 细胞生物学杂志 , 1988, 10 (3) :133–135. |
| [20] | 逯明辉, 宋慧, 李晓明, 等. 冷害过程中黄瓜叶片SOD、CAT和POD活性的变化[J]. 西北植物学报 , 2005, 25 (8) :1570–1573. |
| [21] | 梁军锋, 薛泉宏, 牛小磊, 等. 7株放线菌在辣椒根部定殖及对辣椒叶片PAL与PPO活性的影响[J]. 西北植物学报 , 2005, 25 (10) :2118–2123. |
| [22] | 王艳, 尹静, 马泓思, 等. 钙离子在介导SA诱导白桦悬浮细胞三萜合成途径中的作用[J]. 北京林业大学学报 , 2014, 36 (2) :51–58. |
| [23] | Zu Y G, Tang Z H, Yu J H, et al. Different responses of camptot hecin and 10-hydroxycamptothecin to heat shock in Camptotheca acuminata seedlings[J]. Acta Bot Sin , 2003, 45 (7) :809–814. |
| [24] | 李春晓, 尹静, 詹亚光, 等. 水分、氮肥及MeJA处理对白桦三萜积累特性的影响[J]. 西北植物学报 , 2012, 23 (1) :155–161. |
| [25] | 杨英, 郑辉, 何峰, 等. 不同浓度茉莉酸甲酯对悬浮培养的胀果甘草细胞合成甘草总黄酮的影响[J]. 云南植物研究 , 2008, 32 (5) :586–592. |
| [26] | 翟俏丽. 真菌诱导子促进白桦悬浮细胞中三萜合成机理的初步研究 [D]. 哈尔滨: 东北林业大学, 2011. |
| [27] | 范桂枝, 詹亚光. 白桦酯醇的研究进展[J]. 中草药 , 2008, 39 (10) :1591–1594. |
| [28] | 赵明文, 钟家禹, 王南, 等. 鲨烯合酶的研究进展[J]. 微生物学报 , 2003 (5) :676–680. |
| [29] | 张乐华, 周广, 孙宝腾, 等. 高温胁迫对两种常绿杜鹃亚属植物幼苗生理生化特性的影响[J]. 植物科学学报 , 2011, 29 (3) :362–369. |
| [30] | 陆续, 江伟民, 唐克轩. 茉莉酸类物质在植物次生代谢调控方面的研究进展[J]. 上海交通大学学报: 农业科学版 , 2012, 29 (6) :87–91. |
| [31] | Gupta N K, Shubhi A, Agarwal V P, et al. Effect of short-term heat stress on growth, physiology and antioxidative defence system in wheat seedlings[J]. Acta Physiologiae Plantarum , 2013, 35 (6) :1837–1842. |
| [32] | WANG S Y. Methyl jasmonate reduces water stress in strawberry[J]. J Plant Growth Regulation , 1999, 18 :127–134. |
| [33] | 王海河, 林奇英, 谢联辉, 等. 黄瓜花叶病毒三个毒株对烟草细胞内防御酶系统及细胞膜通透性的影响[J]. 植物病理学报 , 2001, 31 (1) :43–49. |
| [34] | Ana V, Sanja M J, Branka T. How do plants cope with oxidative stress in nature? A study on the dwarf bearded iris (Iris pumila)[J]. Acta Physiologiae Plantarum , 2015, 37 (1) :1711–1718. |
| [35] | 杜朝昆, 李忠光, 龚明. 水杨酸诱导的玉米幼苗适应高温和低温胁迫的能力与抗氧化酶系统的关系[J]. 植物生理学通讯 , 2005, 41 (1) :19–22. |
| [36] | Rivero R M, Ruiz J M, Garcıa P C, et al. Resistance to cold and heat stress: accumulation of phenolic compounds in tomato and watermelon plants[J]. Plant Sci , 2001, 160 (2) :315–321. |
| [37] | 杨世勇, 王蒙蒙, 谢建春. 茉莉酸对棉花单宁含量和抗虫相关酶活性的诱导效应[J]. 生态学报 , 2013, 33 (5) :1615–1625. |
| [38] | 巩慧玲. 植物愈伤组织对高温胁迫的生理响应及G6PDH对高温适应的调节机理研究 [D]. 兰州: 兰州大学, 2011. |
| [39] | 路明, 王艳东, 许明丽, 等. 甲基茉莉酮酸对悬浮培养南方红豆杉细胞自由基清除系统酶的影响[J]. 中草药 , 2002, 33 (11) :985–988. |
| [40] | 杨华庚, 颜速亮, 陈慧娟, 等. 高温胁迫下外源茉莉酸甲酯、钙和水杨酸对蝴蝶兰幼苗耐热性的影响[J]. 中国农学通报 , 2011 (28) :150–157. |
| [41] | 陈培琴, 郁松林, 詹妍妮. 茉莉酸和高温锻炼对葡萄幼苗耐热性及其抗氧化酶的影响[J]. 生命科学研究 , 2006, 10 (3) :238–243. |
| [42] | 初 敏. 水杨酸和茉莉酸对高温胁迫下萝卜幼苗的缓解效应 [D]. 济南: 山东农业大学, 2012. |
 2016, Vol. 47
2016, Vol. 47


