衰老是生物界广泛存在的现象,也是生命发展的必然。细胞衰老通常是指在正常状况下生物发育成熟后,随年龄增加细胞增殖能力和生理功能逐渐下降,细胞结构、组分逐步退行性变化,趋向死亡的一种不可逆转的现象[1]。赶黄草学名扯根菜Penthorum chinense Pursh,是四川泸州古蔺出产的一种苗家药材。现代研究表明[2-4],赶黄草含多种有效成分,均对肝损伤具保护作用,并对甲肝、乙肝、慢性活动性肝炎具有一定的治疗作用。苗家人以其草入药,可以解肝火、排肝毒,具有清除氧自由基、延缓衰老作用[5]。在这种理论指导下,本实验研究了赶黄草水提浓缩液抗衰老、增强免疫功能、清除自由基等作用及其对细胞衰老信号通路p53/p21蛋白表达的影响,为赶黄草在新食品原料中的开发应用提供科学的实验依据。
1 材料 1.1 药品与试剂赶黄草采自四川古蔺县境内,经西南医科大学药学院税丕先教授鉴定为虎耳草科植物扯根菜Penthorum chinense Pursh的干燥全草。考马斯亮蓝、丙二醛(MDA)、超氧化物歧化酶(SOD)、单胺氧化酶(MAO)检测试剂盒均购自南京建成生物工程研究所;ECL Plus超敏发光、RIPA组织裂解液:碧云天生物技术研究所;一抗p21、一抗p53、β-actin,英国Abcam公司;D-半乳糖,购自上海恒远生物科技有限公司。
1.2 实验动物清洁级昆明种小鼠,体质量(20±2)g,雌雄各半,由西南医科大学实验动物中心提供,合格证号SCXK(川)2013-017。
1.3 仪器756PC紫外-可见分光光度计(上海光谱仪器有限公司);XW-80A旋涡混匀器(江苏海门市其林贝尔仪器制造有限公司);恒温水浴锅(重庆实验设备厂);全自动凝胶成像系统(Bio-Rad公司)。
2 方法 2.1 赶黄草水提浓缩液的制备称取10 kg赶黄草药材,粉碎成粗粉,加蒸馏水100 L,加热至80~90 ℃,浸泡提取30~60 min,滤过,收集提取液,残渣加蒸馏水100 L,加热至80~90 ℃,浸泡提取30~60 min,滤过,合并浸泡提取液,将提取液减压浓缩至5 L即可。水提浓缩液的生药质量浓度为2 g/mL。取芦丁对照品(中国食品药品检定研究院,批号100080-201408),照紫外-可见分光光度法(《中国药典》2015年版一部附录VA)于510 nm处测定,赶黄草水提浓缩液中含总黄酮为98.68 mg/mL。
2.2 分组及造模将50只小鼠适应性喂养1周后,按体质量随机分为5组:对照组,模型组及赶黄草水提浓缩液低、中、高剂量(生药0.167、0.334、0.668 g/kg)组。除对照组外,其他各组均每天颈背部sc 5% D-半乳糖生理盐水溶液25 μL/g,对照组每天颈背部sc等容量的生理盐水,连续注射42 d。各组造模同时开始ig给药,每日给药1次,连续42 d。
2.3 避暗实验[2]于末次给药1 h后,进行行为学实验。记录5 min内小鼠进入暗室的电击次数(错误次数),作为学习获得成绩。24 h后再次测试,记录第1次触电潜伏期(即将小鼠放入明室开始计时,到第1次双足触电时间)和5 min内小鼠进入暗室的电击次数,作为记忆保持成绩。
2.4 脾脏指数的测定行为学测试结束后,将小鼠称体质量,摘眼球取血后,脱臼处死,取脾脏,称质量,计算小鼠脾脏指数,即脾脏指数=脾脏质量(mg)/小鼠体质量(g)。
2.5 生化指标的检测各组小鼠于行为学测试完毕后,摘取小鼠眼球取血约l mL,取血完毕后,脱臼处死小鼠,取小鼠肝组织。血液离心取血清、组织制成10%匀浆置于4℃冰箱储存备用。SOD、MDA、MAO定量测定按试剂盒说明书进行。
2.6 Western blotting检测脑组织p53、p21蛋白的表达取小鼠脑组织,研磨后PBS漂洗2遍,加入组织裂解液,提取细胞总蛋白,BCA法测蛋白量,SDS-PAGE胶电脉,转膜后将PVDF膜进行封闭2 h,p53或p21一抗(1∶1 000稀释)孵育1 h后,加入稀释辣根过氧化物酶(HRP)标记的二抗,室温或4 ℃孵育1 h,用Luminate crescendo western HRP Substrate显影液对膜进行预染,后在Bio-Rad凝胶成像系统内曝光显影,Image Lab 3.0软件分析。
2.7 统计学处理计量资料以x±s表示,采用SPSS 13.0统计软件进行单因素方差分析及组间两两比较。
3 结果 3.1 对避暗实验的影响模型组小鼠sc5% D-半乳糖生理盐水溶液25 μL/g后,5min错误次数及24 h后5min错误次数明显增加,与对照组比较,差异显著(P<0.01),造模成功。赶黄草水提浓缩液高、中剂量组能降低衰老模型小鼠避暗的错误次数,改善其学习及记忆能力,具有明显促智作用,与模型组相比,差异显著(P<0.05、0.01)。结果见表 1。
|
|
表 1 赶黄草水提浓缩液对衰老小鼠避暗试验的影响(x±s,n = 10) Table 1 Effect of concentrated solution of P. chinense on step-through test in aging mice (x±s,n = 10) |
3.2 对衰老小鼠脾脏指数的影响
模型组小鼠sc5% D-半乳糖生理盐水溶液25 μL/g后,脾脏指数降低,与对照组比较,差异显著(P<0.01)。赶黄草水提浓缩液组能增加衰老模型小鼠的脾脏指数,与模型组相比,差异显著(P<0.05、0.01)。结果见图 1。
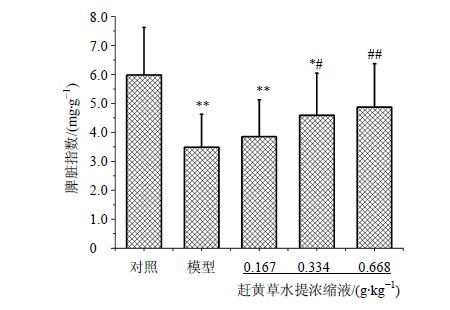
|
图 1 赶黄草水提浓缩液对衰老小鼠脾脏指数的影响(x±s,n = 10) Fig.1 Effect of concentrated solution of P. chinense on spleen index of aging mice (x±s,n = 10) |
3.3 对衰老小鼠血清中SOD、MDA及肝组织中MAO水平的影响
模型组小鼠sc5% D-半乳糖生理盐水溶液25 μL/g后,血清中SOD水平降低,血清中MDA及肝脏中MAO水平升高,与对照组比较,差异显著(P<0.01)。与模型组相比,赶黄草水提浓缩液组均能升高衰老模型小鼠血清中SOD水平,降低MDA及MAO水平(P<0.05、0.01),具有一定的抗氧化作用。结果见表 2。
|
|
表 2 赶黄草水提浓缩液对衰老小鼠血清中SOD、MDA及肝脏中MAO水平的影响 (x±s,n = 10) Table 2 Effect of concentrated solution of P. chinense on SOD and MDA in serum and MAO in liver tissue of aging mice (x±s,n = 10) |
3.4 对p21、p53蛋白表达的影响
Western blotting检测结果表明,赶黄草水提浓缩液能明显降低脑组织中p21、p53蛋白表达,呈现一定的剂量依赖性,与模型组比较,差异显著(P<0.05、0.01)。结果见图 2。
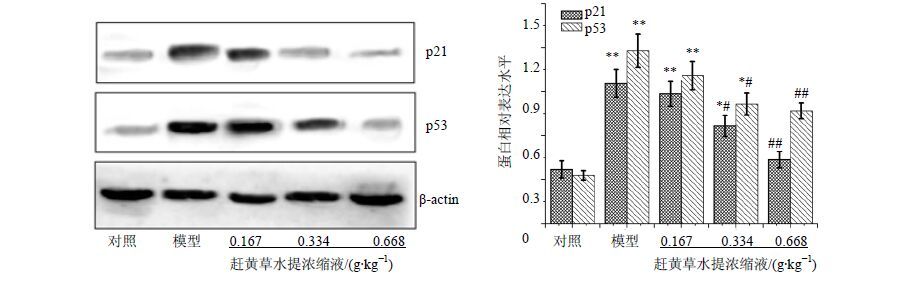
|
图 2 赶黄草水提浓缩液对衰老小鼠脑组织p21和p53蛋白表达的影响 (x±s,n = 10) Fig.2 Effect of concentrated solution of P.chinense on p21 and p53 protein expression in brain tissue of aging mice (x±s,n = 10) |
4 讨论
衰老是一种自然现象,是机体分子、细胞、器官乃至整个机体衰退的生理、病理变化过程。自由基理论认为,细胞的衰老是细胞内发生化学反应过程中有害物质堆积的结果。自由基最终损伤细胞,引起个体衰老。D-半乳糖在正常浓度时可被代谢,但在高浓度时,它可以被催化转化成半乳糖醇、半乳糖氧化酶,产生超氧阴离子与氧自由基[6]。D-半乳糖注射已被广泛用于建立衰老模型,用于抗衰老的研究[7-8]。学习记忆功能与语言、思维、情绪以及运动控制等功能一样,同属于脑的高级功能,其在衰老过程中最易受损。越来越多的证据表明,衰老及由衰老引起的神经退行性疾病阿尔茨海默病(AD)等可导致认知能力特别是空间记忆能力的减退。避暗实验结果发现,赶黄草水提浓缩液能降低衰老模型小鼠避暗的错误次数,改善其学习及记忆能力,揭示其具有明显的抗衰老作用。
SOD能作为超氧阴离子和H2O2清除剂来防止活性氧(ROS)引起的损伤,这可能会导致一些生物标志物的变化[9]。MDA、MAO的产生是氧化过程中出现的主要生物标志物,在脂质过氧化反应的最后阶段其能发起过多的ROS。在肝脏,MDA和MAO浓度的增加能表示发生脂质过氧化反应的程度、组织损伤和破坏的程度。因此,抗氧化防御系统能防止过多的自由基的形成[10]。此外,科学研究发现,衰老是与免疫功能的下降相关。免疫系统已被提议作为生物年龄和寿命的标志,因此,免疫系统功能的降低可能与过量的自由基在老化过程中的出现相关联[11]。本研究发现,赶黄草水提浓缩液不仅升高衰老模型小鼠的脾脏指数、增强机体免疫功能,还能升高衰老模型小鼠血清中SOD水平,降低MDA、MAO的量,具有一定的抗氧化作用。因此,提高衰老小鼠的免疫功能和清除氧自由基是赶黄草水提浓缩液抗衰老的作用机制。
细胞衰老作为衰老的基本过程是借助于信号传导途径实现的,许多细胞因子亦参与到这些信号途径中。其中最经典的细胞衰老途径为p53- p21WAF1/CIP1-Rb,当该途径所涉及的关键调控因子,如细胞周期蛋白依赖激酶抑制蛋白(CKI)p21、细胞周期蛋白、细胞周期蛋白激酶(CDK)、视网膜母细胞瘤蛋白(Rb)等发生改变,细胞将延缓衰老或绕过衰老程序继续增殖[12]。在人类和小鼠细胞中,研究者通过各种技术策略使p53/p21途径失活导致细胞逃逸老化[13]。在细胞中加强p53或p21表达能诱导老化样细胞表型,并且各种刺激信号能诱导p53-p21依赖的细胞老化反应。这些均提示p53在诱导细胞老化中不可缺少[14]。DNA损伤检测点的核心是p53,p53接受上游蛋白传来的DNA损伤信号并传递给下游的效应蛋白,从而使细胞周期停滞,因此p53是DNA损伤反应的中介物。DNA损伤可通过磷酸化p53使其蛋白活性稳定,表达水平上升,并诱导其转录活性。p53活化的一个主要效应分子就是p21,p21水平上调可抑制CDK2和CDK4的活性,它们不能磷酸化pRb,处于低磷酸化状态的pRb结合到E2Fs上,使E2Fs不能与其靶基因结合,细胞不能进入S期,最终导致细胞周期停滞[15]。
Western blotting检测结果表明,赶黄草水提浓缩液能明显下调脑组织中p21、p53的蛋白表达,呈现一定的剂量依赖性,揭示其能通过抑制细胞衰老信号通路p53/p21蛋白的高表达,从而提高衰老小鼠的免疫功能和清除氧自由基能力,延缓机体的衰老。
| [1] | 张大勇, 项晓霞, 陈律, 等. 不同年龄大鼠血清对骨髓间充质干细胞衰老影响的实验研究[J]. 中国细胞生物学学报 , 2011, 33 (10) :1109–1115. |
| [2] | 胡祥宇, 魏嵋, 袁叶飞, 等. 赶黄草对小鼠酒精性脂肪肝的实验研究[J]. 西南军医 , 2015, 17 (3) :288–290. |
| [3] | Ikura Y, Caldwell S H. Lipid droplet-associated proteins in alcoholic liver disease: a potential linkage with hepatocellular damage[J]. Int J Clin Exp Pathol , 2015, 8 (8) :8699–8708. |
| [4] | 肖丽萍, 宋洋洋, 周彦希, 等. 赶黄草抗非酒精性脂肪肝的实验研究[J]. 中国实验方剂学杂志 , 2014, 20 (10) :125–129. |
| [5] | 贺晓华, 许龙, 谈满良, 等. 不同提取方法赶黄草提取物清除DPPH自由基的作用研究[J]. 时珍国医国药 , 2009, 20 (8) :1924–1926. |
| [6] | Kumar A, Prakash A, Dogra S. Protective effect of curcumin (Curcuma longa) against D-galactose-induced senescence in mice[J]. J Asian Nat Prod Res , 2011, 13 (1) :42–55. |
| [7] | 范红艳, 顾饶胜, 王艳春, 等. 大豆异黄酮抗衰老作用研究[J]. 中草药 , 2010, 41 (12) :2054–2057. |
| [8] | Chen H L, Wang C H, Kuo Y W, et al. Antioxidative and hepatoprotective effects of fructo-oligosaccharide in D-galactose-treated Balb/c J mice[J]. Br J Nutr , 2011, 105 (6) :805–809. |
| [9] | Yoo D Y, Kim W, Kim I H, et al. Combination effects of sodium butyrate and pyridoxine treatment on cell proliferation and neuroblast differentiation in the dentate gyrus of D-galactose-induced aging model mice[J]. Neurochem Res , 2012, 37 (1) :223–231. |
| [10] | Oliveira B F, Nogueira-Machado J A, Chaves M M. The role of oxidative stress in the aging process[J]. Sci World J , 2010, 10 (4) :1121–1128. |
| [11] | 段文明. 玉郎伞多糖抗衰老作用及机制研究 [D]. 南宁: 广西医科大学, 2014. |
| [12] | 张涛, 钱济先, 姬振伟, 等. 沉默p53和p21基因延缓髓核细胞衰老退变实验研究[J]. 中国修复重建外科杂志 , 2012, 26 (7) :789–795. |
| [13] | Ben-Porath I, Weinberg R A. The signals and pathways activating cellular senescence[J]. Int J Biochem cell Biol , 2005, 37 (5) :961–976. |
| [14] | Wu X, Gao H, Ke W, et al. VentX trans-Activates p53 and p16ink4a to regulate cellular senescence[J]. J Biol Chem , 2011, 286 (14) :12693–12701. |
| [15] | 蒲秀瑛, 于双, 樊文博, 等. 归芪多糖对衰老细胞周期及p53、p16蛋白的影响[J]. 中医药学报 , 2015, 43 (4) :36–39. |
 2016, Vol. 47
2016, Vol. 47


