2. 兰州军区机关门诊部, 甘肃 兰州 730000
2. Outpatient Department of Lanzhou Military Command of the PLA, Lanzhou 730000, China
红景天苷(salidrosides)是红景天属Rhodiola L. 植物红景天Rhodiolae CrenulataeRadix et Rhizoma的主要有效成分,是一种强抗氧化剂,红景天具有显著的抗缺氧功能,对神经细胞具有明显的保护作用[1-4]。前期研究表明,红景天苷能诱导骨髓间充质干细胞(marrow mesenchymal stem cells,MSCs)向神经元细胞定向分化[5-6],但是其诱导分化作用的机制尚不清楚。骨形态发生蛋白(bone morphogenetic protein,BMP)和Notch信号通路在干细胞向神经元细胞定向分化过程中发挥重要作用。本实验从BMP和Notch信号通路角度探讨红景天苷诱导MSCs向神经元细胞定向分化的分子机制,以期揭示红景天苷诱导MSCs向神经细胞定向分化的效应关系,为进一步利用中药有效成分结合干细胞治疗神经损伤的修复和再生提供理论依据。
1 材料 1.1 细胞小鼠骨髓间充质干细胞D1细胞株,美国ATCC公司,序列号CRL-10915。
1.2 药品与试剂红景天苷对照品(质量分数99.8%,批号N9HD-C53R),中国食品药品检定研究院。D/F12培养基(美国Gibco公司);胎牛血清(杭州四季青公司);Trizol试剂(Invitrogen公司);兔抗小鼠β-tubulin、NSE、MAP2、β-tubulin Ⅲ、Smad1/5/8单克隆抗体(英国Abcam公司);4′,6-二脒基-2-苯基吲哚(DAPI,美国Sigma公司)、γ-分泌酶抑制剂(Noggin,美国Sigma公司)、DAPT(美国Sigma公司)。
1.3 仪器电泳槽、电转仪和酶标仪(美国Bio-Rad公司),荧光定量PCR 7300 system(Applied Biosysterms公司),BX51荧光显微镜(Olympus)。
2 方法 2.1 D1细胞培养、分组及药物处理D1细胞加入含10%胎牛血清的D/F12完全培养液,置37 ℃、5% CO2培养箱中培养,每周更换2次培养液,待细胞80%融合后,2.5 g/L胰酶消化传代培养。D1细胞按照1×105个/cm2接种于96孔培养板中,实验分为对照组、诱导组、阻断组,其中对照组为D/F12完全培养液;诱导组D/F12完全培养液含100 mg/L红景天苷[7];阻断组D/F12完全培养液含10 μmol/L DAPT或10 μmol/L Noggin。阻断组分别或同时加入DAPT和Noggin作用细胞30 min后,加入100 mg/L红景天苷。
2.2 MTT法检测细胞增殖D1细胞以密度1×105个/mL接种于96孔板,37 ℃、5% CO2培养箱中培养24 h。实验分为对照组和诱导组,药物处理同“2.1”项,药物分别处理12、24、48、72 h后吸弃培养基,加入MTT(5 mg/L)20 μL继续孵育4 h,吸弃上清,加入150 μL DMSO溶解紫色结晶。每组设6个复孔,平行设不加细胞只加培养液的空白孔,比色时以空白孔调零,细胞增殖情况以492 nm处吸光度(A)值表示。
2.3 细胞形态观察细胞以密度1×105个/mL接种于6孔培养板中,实验分为5组,对照组(D/F12完全培养液),12、24、48、72 h诱导组(100 mg/L红景天苷)[8]。利用细胞荧光免疫组织化学方法观察细胞形态,具体方法如下:0.1% Triton X-100室温作用10 min;3%的H2O2室温作用20 min;羊血清封闭作用30 min后,加羊抗兔β-tubulin单克隆抗体(1∶1 000),湿盒中4 ℃孵育过夜;0.01 mol/L PBS洗3次后加异硫氰酸荧光素(FITC)标记的羊抗兔多克隆抗体37 ℃孵育30 min,0.01 mol/L PBS洗3次;滴加终质量浓度为5 mg/L的DAPI,室温避光染色10 min,0.01 mol/L PBS洗3次,磷酸甘油缓冲液封片,荧光显微镜观察并拍照。每组抽取3张爬片,随机选择5个视野,按照细胞树突3个以上且长度大于5 μm以上为神经样细胞计数,神经样细胞百分率=神经样细胞数/总细胞数。
2.4 对MSCs细胞Notch1和Jadge1表达的影响D1细胞以密度1×105个/mL接种于6孔培养板中,实验分为5组,对照组(D/F12完全培养液)和12、24、48、72 h诱导组(100 mg/L红景天苷)。利用细胞荧光免疫组织化学方法检测Notch1和Jadge1的表达,具体方法如下:0.1% Triton X-100室温作用10 min;3%的H2O2室温作用20 min;羊血清封闭作用30 min后,加羊抗兔Notch1和Jadge1单克隆抗体(1∶1 000),湿盒中4 ℃孵育过夜;0.01 mol/L PBS洗3次后加FITC标记的羊抗兔多克隆抗体37 ℃孵育30 min,0.01 mol/L PBS洗3次;滴加终质量浓度为5 mg/L的DAPI,室温避光染色10 min,0.01 mol/L PBS洗3次,磷酸甘油缓冲液封片,荧光显微镜观察并拍照。取3张爬片,高倍镜随机选择5个视野并计细胞总数和阳性细胞数,计算细胞阳性率(阳性率=阳性细胞数/细胞总数)。
2.5 对Notch和BMP信号通路的影响D1细胞以密度1×105个/mL接种于6孔培养板中,实验分为3组,对照组、诱导组和阻断组,细胞处理方法同“2.1”项。37 ℃、5% CO2培养箱中培养12~72h,提取RNA进行Real Time-PCR检测;其中对照组为D/F12完全培养液;诱导组D/F12完全培养液含100 mg/L红景天苷;阻断组D/F12完全培养液含10 μmol/L DAPT或10 μmol/L Noggin。阻断组分别或同时加入DAPT和Noggin作用细胞30 min后,加入100 mg/L红景天苷作用细胞24 h,待80%的细胞融合后,分别提取RNA和蛋白质进行相关实验。
2.5.1 Real Time-PCR检测按照Trizol试剂使用说明提取细胞总RNA,紫外分光光度计测定RNA纯度和浓度,取500 ng总RNA,PrimeScriptTM RT-PCR试剂盒合成cDNA,反应体系10 μL,反应条件:37 ℃、15 min;85 ℃、5s;采用荧光定量PCR-7300两步法扩增,反应体系20 μL,PCR反应条件:95 ℃、10 s预变性;95 ℃、5 s;60 ℃、31 s退火。相关引物序列见表 1。分别检测上述基因mRNA的表达水平;基因的相对表达采用2−ΔΔCt公式计算[9]。
|
|
表 1 Real time-PCR反应引物序列 Table 1 Primer sequences of real time-PCR reaction |
2.5.2 Western blotting检测
细胞蛋白提取方法如下:细胞用冷(4 ℃)0.01 mol/L PBS洗3次,每次2 min,加入细胞裂解液500 μL于冰上裂解30 min,反复吹打使其充分裂解后,移入1.5 mL离心管,12 000 r/min,4 ℃离心15min,收集上清,利用二辛可酸法(BCA)测定蛋白浓度。每组取20 μg蛋白,12% SDS-PAGE分离蛋白,运用电转移法将蛋白质转移至PVDF膜。5%脱脂奶粉室温封闭2 h,加兔抗小鼠单克隆抗体NSE、MAP-2、β-tubulin Ⅲ、Smad1/5/8(1∶1 000)一抗,4 ℃孵育过夜,洗膜后分别加HRP标记的羊抗小鼠多克隆抗体(1∶5 000),室温孵育2 h,化学发光法(ECL)显影。应用Image-Pro Plus 6.0软件分析各特异性条带积分A值。
2.6 统计学处理采用SPSS16.0统计软件,单因素方差分析进行数据统计学分析,数据以x±s表示,实验重复3次。
3 结果 3.1 对MSCs增殖和形态的影响MTT法以红景天苷分别诱导D1细胞12、24、48、72 h后测定A值,红景天苷作用24 h时细胞的增殖明显高于12 h,与对照组比较差异不显著(P>0.05);红景天苷作用48 h和72 h时细胞增殖与对照组比较显著降低(P<0.05),结果见图 1。细胞免疫荧光化学染色结果表明,对照组细胞形态多呈多角形或菱形结构,红景天苷诱导24 h时,43.2%的细胞胞体增大,有长短不等的多极树突形成;诱导72 h时,68.4%的细胞胞体明显增大,多极树突数量显著增加,结果见图 2。
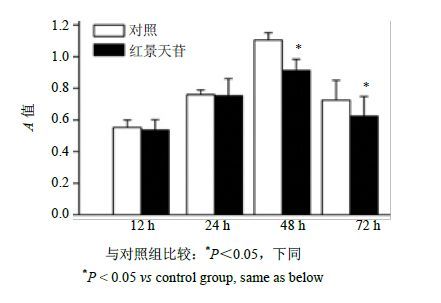
|
图 1 红景天苷对MSCs增殖的影响 (x±s,n = 3) Fig.1 Effect of salidroside on proliferation of MSCs (x±s,n = 3) |
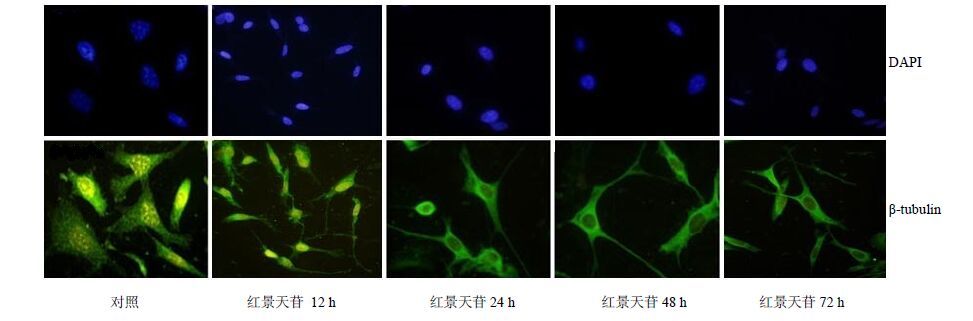
|
图 2 红景天苷对MSCs形态的影响 (免疫荧光化学) Fig.2 Effect of salidroside on morphology of MSCs (IF) |
3.2 通过抑制Notch信号通路促进MSCs向神经元细胞定向分化
荧光免疫细胞化学染色检测显示,Notch1主要定位于细胞胞浆,呈绿色,DAPI标记细胞核呈蓝色。对照组Notch1的阳性表达率为72.3%,红景天苷分别诱导D1细胞12、24、48、72 h后,Notch1阳性表达率分别为25.4%、38.6%、40.2%、42.1%,与对照组比较,红景天苷组Notch1的阳性表达率明显降低(P<0.05),结果见图 3和4。对照组Jadge1的阳性表达率为69.8%,红景天苷分别诱导D1细胞12、24、48、72 h后,Jadge1阳性表达率分别为40.1%、43.3%、42.7%、40.6%,与对照组比较,红景天苷组Jadge1的阳性表达率明显降低(P<0.05),结果见图 3和4。
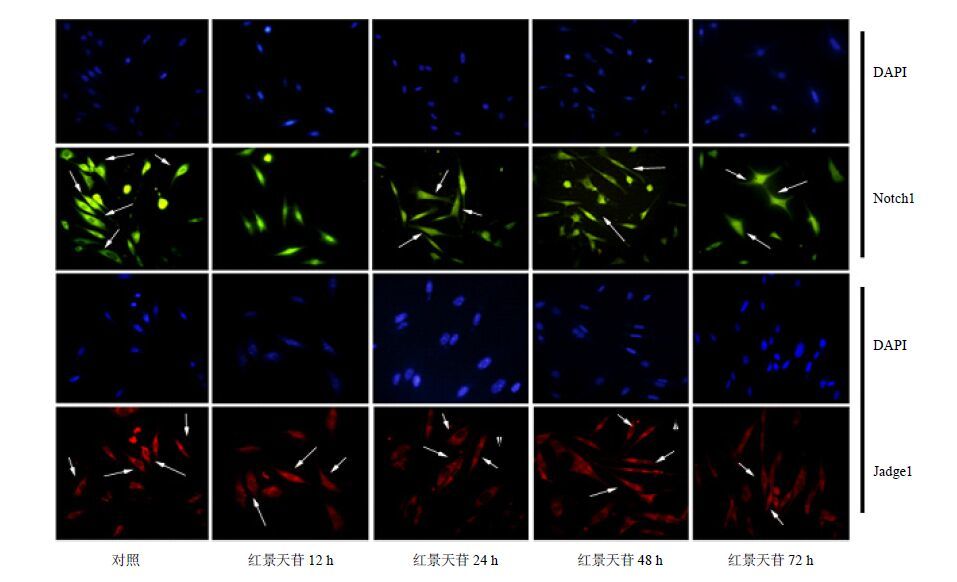
|
图 3 红景天苷对MSCs中Notch1和Jadge1蛋白表达的影响 (免疫荧光化学) Fig.3 Effect of salidroside on expression of Notch1 and Jadge1 protein in MSCs (IF) |
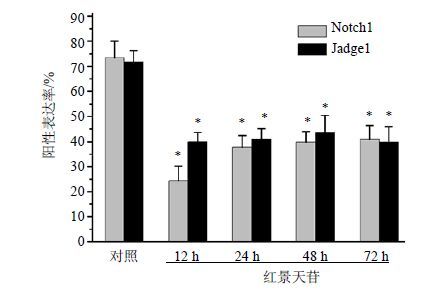
|
图 4 Notch1和Jadge1的阳性表达率 (x±s,n = 3) Fig.4 Positive expression rates percentage of Notch1 and Jadgel (x±s,n = 3) |
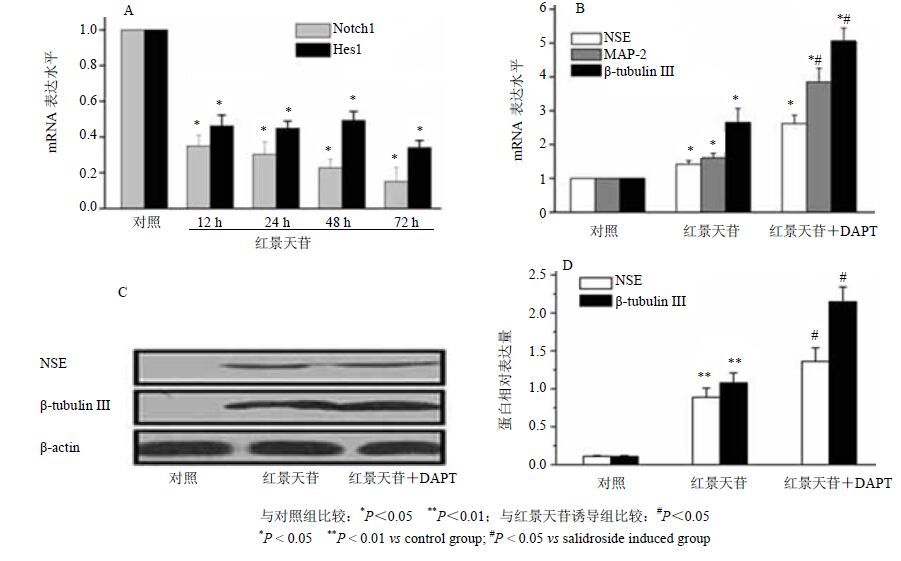
Real-Time PCR结果表明,红景天苷诱导D1细胞12~72 h后,Notch1和Hes1 mRNA的表达水平与对照组比较明显下调(P<0.05),结果见图 5-A;利用特异性阻断剂DAPT阻断Notch信号通路后,NSE、MAP-2和β-tubulin Ⅲ mRNA的表达水平与阻断前比较显著上调(P<0.05),结果见图 5-B。
|
图 5 红景天苷对Notch信号通路的影响 (x±s,n = 3) Fig.5 Effect of salidroside on Notch signal pathway (x±s,n = 3) |
Western blotting检测显示,利用特异性阻断剂DAPT阻断Notch信号通路后,NSE和β-tubulin Ⅲ蛋白的表达水平与阻断前比较显著上调(P<0.05),结果见图 5-C和图 5-D。
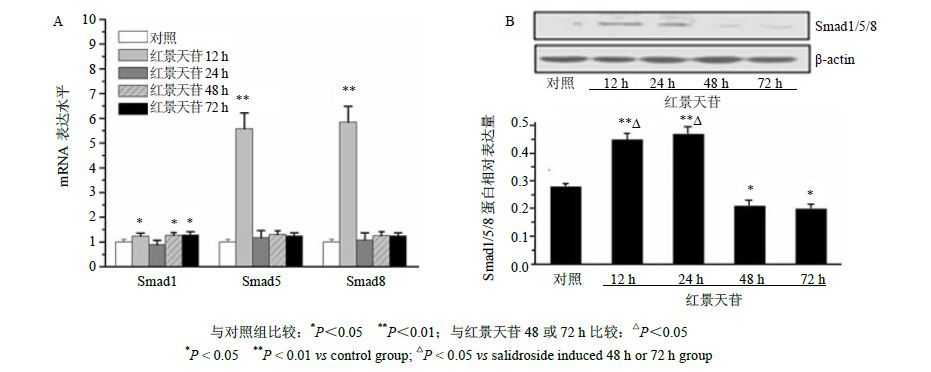
3.3 通过激活BMP信号通路促进MSCs向神经元细胞定向分化Real-Time PCR结果表明,红景天苷诱导D1细胞12、48、72 h时Smad1 mRNA的表达水平与对照组比较上调(P<0.05);12 h时Smad5和Smad8 mRNA的表达水平达到峰值,与对照组比较差异显著(P<0.01),结果见图 6-A。
|
图 6 红景天苷对D1细胞Smad1/5/8 mRNA和蛋白表达的影响 (x±s,n = 3) Fig.6 Effect of salidroside on Smad1/5/8 mRNA and protein expression in D1 cells (x±s,n = 3) |
Western blotting检测显示,红景天苷诱导D1细胞12~72 h时,Smad1/5/8蛋白在12 h和24 h时的表达水平与对照组比较明显上调(P<0.05),与诱导48 h和72 h时比较也显著上调(P<0.05),结果见图 6-B。
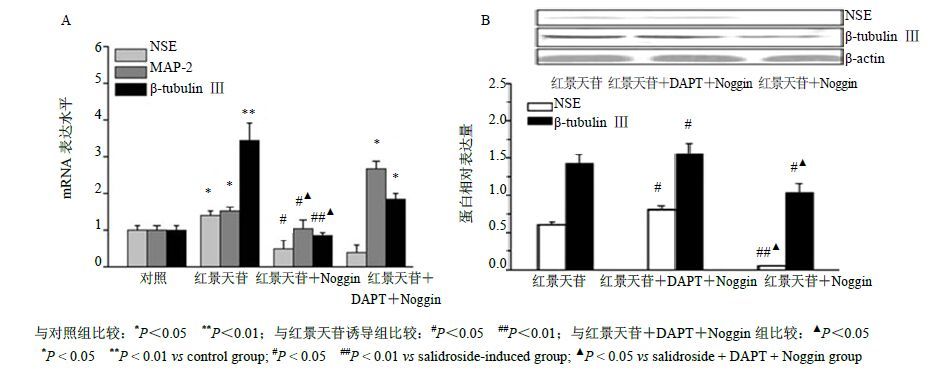
3.4 通过激活BMP信号通路抑制Notch信号通路促进MSCs向神经元细胞定向分化Real-Time PCR检测表明,Noggin阻断BMP信号通路后NSE、MAP-2和β-tubulin Ⅲ mRNA的表达水平与红景天苷诱导组比较显著下调(P<0.05、0.01);同时阻断BMP和Notch信号通路后,NSE和β-tubulin Ⅲ mRNA的表达水平与红景天苷诱导组比较显著下调(P<0.05、0.01),相反MAP-2 mRNA则上调;与单独阻断BMP信号通路组比较MAP-2和β-tubulin Ⅲ mRNA的表达水平显著上调(P<0.05),结果见图 7-A。
|
图 7 阻断Notch和BMP信号通路后红景天苷对NSE、MAP-2、β-tubulin Ⅲ mRNA和NSE、β-tubulin Ⅲ蛋白表达的影响 (x±s,n = 3) Fig.7 Effect of salidroside on expression of NSE,MAP2,β-tubulin Ⅲ mRNA and NSE,β-tubulin Ⅲ protein when blocking Notch signal and BMP pathways (x±s,n = 3) |
Western blotting检测显示,Noggin阻断BMP信号通路后NSE和β-tubulin Ⅲ蛋白的表达水平与红景天苷诱导组比较显著下调(P<0.05);同时阻断BMP和Notch信号通路后,NSE和β-tubulin Ⅲ蛋白的表达水平与红景天苷诱导组比较显著上调(P<0.01),与单独阻断BMP信号通路组比较NSE和β-tubulin Ⅲ蛋白的表达水平显著上调(P<0.05),结果见图 7-B。
4 讨论红景天苷有抑制细胞Ca2+超载、抗凋亡、抗自由基、营养神经细胞、促进神经干细胞向神经元方向分化的能力[10],Notch信号通路普遍存在于各种动物机体中,对组织和器官的发生、特别是新陈代谢自我更新以及细胞分化等多种生命过程起重要的作用[11]。Notch信号通路调控干细胞的自我更新和多种分化潜能。Notch信号通路是一个没有胞内第二信使的简单的信号转导过程,γ-分泌酶作用于Notch信号通路,通过信号级联机制传递到细胞内侧启动下游基因的转录[12-13],抑制Notch信号通路则促进MSCs向神经元轴突的方向延伸,激活Notch信号通路则促进细胞的增殖,并减少细胞的分化[14]。基于Notch信号通路在MSCs分化中的作用,本实验研究了红景天苷诱导MSCs向神经元细胞定向分化中对Notch信号通路的影响,结果显示红景天苷能抑制Notch信号通路中关键信号分子Notch1、Jadge1和Hes1的表达;利用Notch信号通路特异性阻断剂DAPT阻断该信号通路时,能明显抑制神经元细胞标志分子NSE、MAP-2和β-tubulin Ⅲ的表达,该结果提示,红景天苷通过抑制Notch信号通路促进MSCs向神经元细胞定向分化。
BMP是一种具有多功能的转化生长因子,在细胞的生命活动过程中发挥着重要的调节作用。BMP配体与BMP受体特异性识别并结合可能激活下游基因Smad[14-15]。本实验结果显示,红景天苷能明显上调BMP信号通路中关键调节蛋白Smad5和Smad8的表达水平,Smad5和Smad8表达水平的上调主要发生在红景天苷诱导的早期;利用BMP信号通路的特异性阻断剂Noggin阻断该信号通路后,明显抑制了红景天苷促进MSCs神经元细胞的标志分子NSE、MAP-2和β-tubulin Ⅲ的表达,该结果提示红景天苷通过激活BMP信号通路促进MSCs向神经元细胞定向分化。研究还发现同时阻断Notch和BMP信号通路后,MAP-2和β-tubulin Ⅲ的表达水平比单独阻断BMP信号通路显著上调,究其原因可能是由于红景天苷诱导MSCs向神经元细胞定向分化过程中,红景天苷主要通过抑制Notch信号通路实现其诱导的生物学效应,同时红景天苷能激活BMP信号通路影响MSCs向神经元细胞定向分化,然而阻断Notch和BMP信号通路后神经元细胞标志分子NSE、MAP-2和β-tubulin Ⅲ的表达并没有被完全抑制,表明红景天苷的诱导效应是通过多途径影响MSCs的定向分化。
前期研究结果证实,红景天苷诱导MSCs向神经元细胞定向分化过程中,Wnt/β-cantinin和ERK1/2信号通路也参与此过程[16-17],这些研究结果进一步证明了红景天苷的诱导效应与多种信号途径有关。
| [1] | 冉建华, 孙善全, 汪克建, 等. 红景天苷对大鼠缺血性脑水肿的影响[J]. 中草药 , 2008, 39 (8) :1200–1204. |
| [2] | 张明发, 沈雅琴. 红景天苷抗痴呆药理作用研究进展[J]. 药物评价研究 , 2015, 38 (6) :675–681. |
| [3] | Qu Z Q, Zhou Y, Zeng Y S, et al. Protective effects of a rhodiola crenulata extract andsalidroside on hippocampal neurogenesis against streptozotocin-induced neural injury in the rat[J]. PLoS One , 2012, 7 (1) :e29641. |
| [4] | Choe K I, Kwon J H, Park K H, et al. The antioxidant and anti-inflammatory effects of phenolic compounds isolated from the root of Rhodiola sachalinensis A. BOR. [J]. `Molecules, 2012, 17(10): 11484-11494. |
| [5] | Chen Q G, Zeng Y S, Qu Z Q, et al. The effects of Rhodiola rosea extract on 5-HT level, cell proliferation and quantity of neurons at cerebral hippocampus of depressive rats[J]. Phytomedicine , 2009, 16 (9) :830–838. |
| [6] | 张明, 赵红斌, 荔志云, 等. 红景天苷对大鼠BMSCs向胆碱能神经细胞分化的影响[J]. 中国修复重建外科杂志 , 2012, 26 (2) :158–165. |
| [7] | 陈亚男, 刘辉, 赵红斌, 等. 红景天苷诱导骨髓间充质干细胞向神经细胞定向分化的机制研究[J]. 药学学报 , 2013, 48 (8) :1247–1252. |
| [8] | Zhao H B, Ma H, Ha X Q, et al. Salidroside induces rat mesenchymal stem cells to differentiate into dopaminergic neurons[J]. Cell Biol Int , 2014, 38 (4) :462–471. |
| [9] | Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods , 2001, 25 (4) :402–408. |
| [10] | 和梅, 张瑶, 李莹, 等. BDNF和红景天甙对体外神经干细胞向GABA能神经元分化的研究[J]. 黑龙江医药科学 , 2009, 32 (4) :80–82. |
| [11] | Mead T J, Yutzey K E. Notch pathway regulation of neural crest cell development in vivo[J]. Dev Dyn , 2012, 241 (2) :376–389. |
| [12] | Wang S, Kan Q, Sun Y, et al. Caveolin-1 regulates neural differentiation of rat bone mesenchymal stem cells into neurons by modulating Notch signaling[J]. Int J Dev Neurosci , 2013, 31 (1) :30–35. |
| [13] | Greenberg D A, Jin K. Turning neurogenesis up a Notch[J]. Nat Med , 2006, 12 (8) :884–885. |
| [14] | Artavanis-Tsakonas S, Rand M D, Lake R J. Notch signaling: cell fate control and signal integration in development[J]. Science , 1999, 284 (5415) :770–776. |
| [15] | Sieber C, Kopf J, Hiepen C, et al. Recent advances in BMP receptor signaling[J]. Cytokine Growth Factor Rev , 2009, 20 (5/6) :343–355. |
| [16] | Zhang J W, Li L H. BMP signaling and stem cell regulation[J]. Dev Biol , 2005, 284 (1) :1–11. |
| [17] | 朱晓娟, 耿排力, 赵红斌, 等. 红景天苷通过Wnt/β-catenin信号通路影响小鼠骨髓间充质干细胞向神经元细胞定向分化[J]. 激光生物学报 , 2012, 21 (6) :510–516. |
 2016, Vol. 47
2016, Vol. 47

