2. 南京中医药大学 江苏省中药资源产业化过程协同创新中心, 江苏 南京 210023 ;
3. 金陵药业股份有限公司南京金陵制药厂研究所, 江苏 南京 210009
2. Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, Nanjing University of Chinese Medicine, Nanjing 210023, China ;
3. Nanjing Jinling Pharmaceutical Institute, Jinling Pharmaceutical Co., Ltd., Nanjing 210009, China
脉络宁注射液由金陵药业股份有限公司南京金陵制药厂生产,由牛膝、玄参、石斛、金银花4味药材经水提、醇沉、醋酸乙酯精制等工艺处理后而得。为国家级中药保护品种,是防治血栓性闭塞性血管病的中药复方注射液,为国家基本药物目录所保留的8个中药注射液品种之一,已成为全国中医院急诊必备药品。该注射液生产过程产生的废弃物主要有:水提取后4味药的混合药渣、乙醇沉淀物、醋酸乙酯萃取后剩余物及制药过程产生的大量废水。中药资源产业化过程中废弃的植物根系、地上茎叶、药渣、深加工过程废弃物等不仅造成严重的资源浪费,而且会造成严重的环境污染问题。针对这一社会问题,探索中药废弃物的资源化利用策略与模式势在必行[1]。根据中药废弃物的来源与组成特征,其利用策略主要有:传统非药用部位多途径利用、中药材与中药饮片加工过程废弃物回收利用和中药资源深加工过程废弃物回收利用[2-3]。在本实验室前期研究中发现,乙醇沉淀物富含多糖、蛋白质等大分子物质,据文献报道,牛膝、金银花和石斛多糖均有免疫活性,故本研究以大生产中所产生的乙醇沉淀废弃物为研究对象,对其进行活性跟踪分离,以期对其实现资源化利用[4-7]。
水提醇沉是中药制药生产的通用技术,由此而生成的半固体物料因含有大量糖类等大分子物质,稠厚、黏度大,极难干燥,不但限制了其再利用,还成为中药行业污染环境,浪费资源的共有技术难题。采用超滤膜分离多糖,与传统的多糖分离方法(如乙醇分级沉淀和凝胶渗透色谱法)相比,不仅分离过程简单,省时高效,节能,无相变,能避免生物活性成分损失[8];同时能够提高多糖纯度,富集有效部位。另外,在清洗使用得当时可以长期连续使用并保持较恒定的产量和分离效果,在相当低的压力差下仍具有高流通率。膜科学技术因具有节约、清洁、安全等优势可作为中药废弃物资源化的重要选择之一[9-10]。本研究将膜技术与制药过程废弃物资源化开发有机结合,对于提升中药产业竞争力,促进中药产业的性能优化与升级,推进中药资源可持续发展具有重要意义。
1 仪器与材料Waters 2695高效液相色谱仪,美国Waters公司,Waters 2424 ELSD检测器,Waters 2998 PDA检测器;Allegra64R Centrifuge高速冷冻离心机,美国贝克曼库尔特有限公司;Libro AEL-40SM十万分之一电子分析天平,日本岛津公司;EnSpire酶标仪,美国PerkinElmer公司;切向流过滤系统,美国GE公司;超滤膜,美国GE公司;材质PES,截留相对分子质量(MW)为3×103、1×104、3×104、1×105、3×105,滤膜有效面积为0.1 m2。
脉络宁注射液乙醇沉淀物来源于金陵药业股份有限公司南京金陵制药厂。98%浓硫酸,批号81007,上海凌峰化学试剂有限公司;5%苯酚,广州金华大化学试剂有限公司,批号20150119;无水葡萄糖对照品,批号7B8L-257Z,中国食品药品检定研究院;RPMI 1640培养液,批号G40307,上海源培生物科技有限公司;DMEM培养液,批号K40308,上海源培生物科技有限公司;红细胞裂解液,Biosharp公司,批号65098010;双抗(批号H20210)、胰酶(批号B40301)、胎牛血清(批号JC30131),Sigma公司;CCK-8试剂盒,Vazyme公司,批号A311-02;BCA蛋白质浓度测定试剂盒(批号P0012)、NO测定试剂盒(批号S0021),上海碧云天生物技术有限公司;氯仿、无水乙醇、正丁醇(分析纯);水为超纯水。雄性昆明种小鼠,SPF级,体质量(20±2)g,由上海杰思捷动物有限公司提供,合格证号SCXK2015-0006。RAW 264.7细胞株,由中国科学院细胞库提供。
2 方法与结果 2.1 脉络宁注射液乙醇沉淀物粗多糖的超滤膜分离 2.1.1 预处理取一定量冻干的脉络宁注射液乙醇沉淀物,加蒸馏水溶解稀释制备成质量浓度为20 mg/mL的溶液,5 000 r/min离心10 min,取上清液即得富含多糖的溶液(以下简称为MFP)。
2.1.2 不同MW区段MFP样品的制备按参考文献的方法[11-12],在25 ℃,入口压力0.3 MPa,出口压力0.1 MPa下,分别用截留MW 3×105、1×105、3×104、1×104、3×103的超滤膜将MFP分离为不同MW区段多糖,共得MFP1(MW<3×103)、MFP2(MW 3×103~1×104)、MFP3(MW 1×104~3×104)、MFP4(MW 3×104~1×105)、MFP5(MW 1×105~3×105)、MFP6(MW>3×105)6个部位。各部位分别浓缩,冷冻干燥,称定质量,计算得率(ω)。
| $\omega ={{W}_{0}}/W$ |
W0为各MW段多糖的质量,W为超滤前多糖的质量
2.2 多糖的定量测定采用苯酚-硫酸法[13]测定不同MW区段MFP样品中多糖的量,各分离部位MFP1~MFP6中的多糖测定结果见表 1。
|
|
表 1 各分离部位的成分测定结果 Table 1 Composition results of different separation parts of MFP |
2.3 蛋白质的定量测定
采用考马斯亮蓝G-250染色法[14]测定不同MW区段MFP样品的蛋白质的量,各分离部位MFP1~MFP6中蛋白质测定结果见表 1。由表 1的研究结果可知,MFP3、MFP4、MFP5 3部分多糖得率较高,其多糖的量也较其他部分较高,说明脉络宁复方多糖的MW多分布在1×104~3×105。
2.4 HPLC法检测多糖组分 2.4.1 色谱条件[15]色谱柱是Tsk-gel G4000 PWXL0(300 mm×7.8 mm)柱(Column No. A00026);柱温30 ℃;流动相为100%超纯水;等度洗脱;体积流量0.5 mL/min;进样量20 μL;漂移管温度60 ℃;载气为氮气;气体压力为275.80 kPa(40 psi);增益:10;色谱图见图 1。
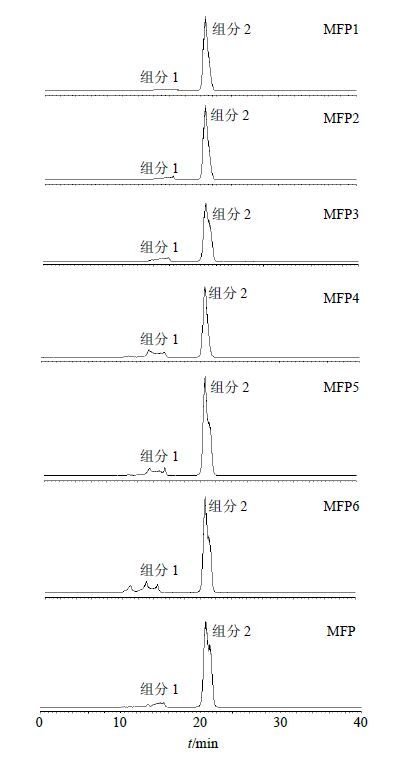
|
图 1 MFP及其各分离部位MFP1~MFP6多糖的HPLC-ELSD图 Fig.1 HPLC-ELSDchromatogram of MFP and MFP1— MFP6 |
2.4.2 供试品的制备
精密称定10 mg样品,溶于2mL纯水中,充分溶解,过0.45 μm滤膜,即得。
2.4.3 样品测定分别将MFP及其各分离部位MFP1~MFP6按“2.4.2”项下条件处理,按“2.4.1”项色谱条件进样分析,MFP及MFP1~MFP6的多糖HPLC图见图 1。由图 1的研究结果可知,MFP主要包括组分1、2,组分1 MW高于组分2。经超滤膜分离后,MFP1~MFP4组分2为对称峰,经PDA检测无紫外吸收,MFP、MFP6和MFP5的组分2为非对称单峰,经PDA检测发现有蛋白质存在。结果表明截留MW大于1×105的超滤膜基本能去除蛋白。MFP组分1包含多种高MW多糖,MFP1、MFP2、MFP3组分1基本无吸收,说明高MW多糖的量很低,MFP4、MFP5和MFP6组分1中多糖逐渐分开,MFP6组分1能明显看到有3种高MW多糖的分离,说明对小分子杂质去除率较好。可见超滤膜不仅能实现蛋白质等杂质的去除,也能实现高MW多糖的分离和富集。
2.5 各分离部位的体外免疫活性筛选 2.5.1 小鼠脾淋巴细胞的制备取6周龄左右小鼠脱臼处死,75%乙醇浸泡2~3 min,无菌条件下取脾脏,用PBS缓冲液冲洗1~2次,将脾脏研磨后过200目筛网,收集滤液,1 000 r/min离心5 min,弃上清,加入红细胞裂解液,静置15 min,1000 r/min离心5 min,弃上清,分别用PBS和RPMI 1640培养基各洗1次,弃上清,加入含10%胎牛血清的RPMI 1640完全培养液悬浮细胞,得到细胞悬液,培养4 h后收集非贴壁细胞[16-17]。取纯化后的细胞悬液,台盼蓝染色法检测细胞活力大于95%,并调整细胞浓度为1×106个/mL。
2.5.2 体外刺激小鼠脾淋巴细胞增殖实验将1×106个/mL淋巴细胞悬液加入96孔细胞培养板对照孔和样品孔中,每孔100 μL,置37 ℃、含5% CO2培养箱中连续培养24 h后,于空白对照孔、阳性对照孔和样品孔中分别加入RPMI 1640培养基、LPS(终质量浓度5 μg/mL)和设有不同质量浓度梯度的MFP、MFP1、MFP2、MFP3、MFP4、MFP5、MFP6(终质量浓度分别为62.5、125.0、250.0、500.0 μg/mL),每组设3个复孔。连续培养48 h后,加入CCK-8溶液,培养2 h后,酶联免疫检测仪于450 nm下测吸光度A450值,计算各组相对增殖率(SI)[18]。
| $SI={{A}_{样品}}/{{A}_{空白对照}}$ |
将1×106个/mL淋巴细胞悬液加入96孔细胞培养板对照孔和实验孔中,每孔100 μL,置37℃、含5% CO2培养箱中连续培养24 h后,于对照孔和实验孔均加入诱导剂ConA 10 μL(终质量浓度5 μg/mL)[19],并分别加入RPMI 1640培养基和设有不同质量浓度梯度的MFP、MFP1、MFP2、MFP3、MFP4、MFP5、MFP6(终质量浓度分别为62.5、125.0、250.0、500.0 μg/mL),每组设3个复孔。连续培养48 h后,按“2.5.2”项所述方法测定各细胞培养孔A450值,并计算各组的SI值。
2.5.4 统计学分析采用SPSS 16.0软件进行统计分析,结果以x±s表示,t检验采用SPSS 19统计软件完成。
2.5.5 不同多糖部位对小鼠脾淋巴细胞增殖、转化的影响为考察不同质量浓度的不同MWMFP免疫活性,以促进小鼠脾淋巴细胞的增殖作为考察分析的根据,考察其免疫促进功能,MFP1~MFP6对小鼠脾淋巴细胞增殖结果见图 2。ConA是小鼠脾淋巴T细胞分裂原,多糖与其协同作用能刺激小鼠脾淋巴细胞转化[20],MFP1~MFP6对ConA诱导的小鼠脾淋巴细胞转化结果见图 3。由图 2、3的研究结果可知,MFP、MFP4、MFP5和MFP6能显著促进小鼠脾淋巴细胞的增殖和转化(P<0.05、0.01),高质量浓度的MFP1和MFP2反而有抑制作用。表明促进小鼠脾淋巴细胞增殖部位主要分布在MW>3×104区段,其中,MW 3×104~1×105区段多糖促进作用最为显著,MW 1×105~3×105区段多糖次之。
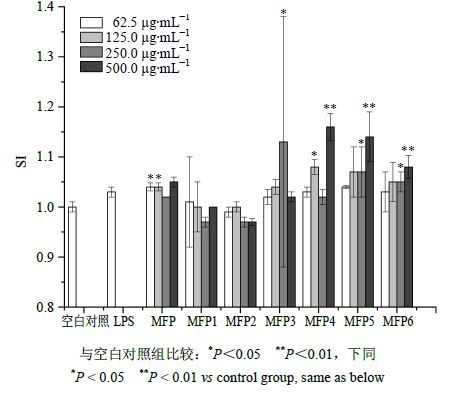
|
图 2 不同质量浓度MFP及MFP1~MFP6对小鼠脾淋巴细胞增殖的影响(x±s,n = 3) Fig.2 Effects of different centrations of MFP and MFP1— MFP6 on proliferation of mouse spleen lymphocytes (x±s,n = 3) |
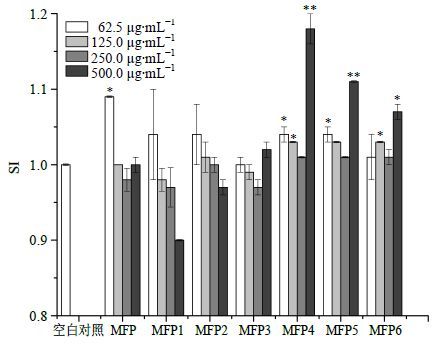
|
图 3 不同质量浓度MFP及MFP1~MFP6对ConA诱导的小鼠脾淋巴细胞转化的影响 (x±s,n = 3) Fig.3 Effects of different centrations of MFP and MFP1— MFP6 on transformation of mouse spleen lymphocytes (x±s,n = 3) |
2.5.6 不同多糖部位对小鼠单核巨噬细胞RAW 264.7释放NO能力的影响
将巨噬细胞RAW 264.7以5×105个/mL的浓度接种到96孔培养板中,每孔100 μL,置37℃、含5% CO2培养箱中连续培养24 h后更换细胞培养液。于空白对照孔、阳性对照孔和实验孔中分别加入DMEM完全培养基、LPS对照药(终质量浓度5 μg/mL)和设有不同质量浓度梯度的MFP、MFP1、MFP2、MFP3、MFP4、MFP5、MFP6(终质量浓度均分别为31.25、62.5、125.0、250.0、500.0 μg/mL),每组设3个复孔。作用巨噬细胞RAW 264.7 24 h后收集各孔中的细胞培养上清[21],按照NO测定试剂盒操作步骤测定NO的生成量。NO作为一种多功能的内源性生物信息分子,其在免疫系统的多种生理过程中均发挥着重要作用,是巨噬细胞发生免疫激活反应的重要因子[22]。不同MW区段MFP体外刺激巨噬细胞NO生成的实验结果见图 4。由图 4可知,与空白对照组相比,MFP和MFP4能显著促进巨噬细胞RAW 264.7释放NO(P<0.05、0.01),高质量浓度的MFP1对NO的释放具抑制作用,说明促进小鼠单核巨噬细胞RAW264.7释放NO部位主要分布在MW 3×104~1×105区段。
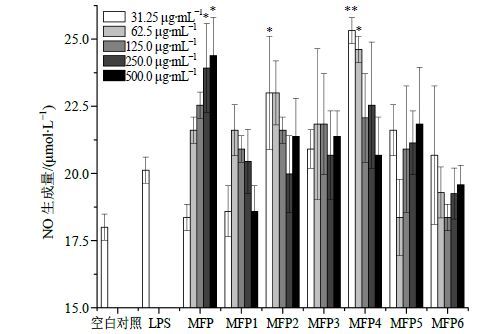
|
图 4 不同质量浓度MFP及MFP1~MFP6对小鼠单核巨噬细胞RAW264.7释放NO能力的影响 (x±s,n = 6) Fig.4 Production of nitric oxide after different centrations of MFP and MFP1—MFP6 acting on macrophage RAW264.7 (x±s,n = 6) |
综上所述,采用不同孔径超滤膜对醇沉废弃物中多糖进行分离,分离所得6个部位多糖的量和种类不同,采用3种典型的免疫活性评价指标对MFP1~MFP6的免疫活性进行初步评价[23-24]。其中,MFP1(MW<3×103)多糖的量较少,可能主要为单糖、低聚糖及色素富集的部位,未检测到免疫活性。MFP2(MW 3×103~1×104)和MFP3(MW 1×104~3×104)虽富含多糖,但免疫活性较弱,不作为后续多糖资源化的主要部位。MFP4(MW 3×104~1×105)和MFP5(MW 1×105~3×105)得率较高,与MFP相比免疫活性提高,故作为后续多糖资源化考察的主要部位。MFP6(MW>3×105)为大MW多糖和蛋白质富集的部位,也具免疫活性。
3 讨论推行清洁生产、实现减废减毒是废弃物资源化的必然选择。膜科学技术符合建设资源节约型和环境友好型社会,以及循环经济的发展思路。目前膜技术研究已逐渐深入,在工业上已成熟应用于废水处理、气体处理、化工产品生产、发酵工业等,基于筛分效应的超滤和微滤可在MW范围对物质进行切割,是国际公认的最有发展前途的,也是我国中药制药工业亟需推广的高新技术。
牛膝、玄参、石斛、金银花均为临床常用中药,根据中国药材市场网报道,4味中药的供应日趋紧张,价格逐年上扬。本实验研究对象MFP是4味药材经水提醇沉之后的混合多糖,本实验室前期研究发现MFP能提高雏鸡的免疫能力,但无显著性,超滤法分离MFP旨在找到活性最优部位,而MFP4和MFP5的体外免疫活性均优于MFP。本实验室后期会对MW 1×105~3×105区段多糖深入考察其免疫活性,并对其主要多糖成分进行分离与鉴定,欲将其开发为一种免疫调节剂,作为禽类动物的饲料添加剂,显著提高禽类动物的免疫能力。故本研究结果不仅为MFP的再利用找到途径,还可为中药资源产业化过程中醇沉物利用提供示范。
目前,中药废弃物的综合利用技术尚处于初级阶段,研究领域具有明显局限性,围绕农业种植业、养殖业方向的居多,其次是建筑业,在其他领域的利用研究较少,特别是中药资源深加工过程废弃物资源化在医学上的研究更是凤毛麟角。本研究及其后续研究将围绕国家中药保护品种——脉络宁注射液的废弃物资源化,以中医药学、民族医药学与资源学理论为指导,通过利用生物学价值发现技术如药效评价、保健功能评价、兽药活性评价、农药效应评价等,发现大生产过程产生的非药用部位、加工过程形成的废弃物,以及中药材深加工产业过程中形成的废弃部分可利用价值,基于现代分离技术,实现废弃物的多途径、多层次综合利用,探索成本可控的中药废弃物资源化循环利用经济模式,提升资源利用效率。促进中药资源产业化过程中由传统工艺向生态工艺转化,实现中药资源产业的可持续发展[25-26]。
| [1] | 沈飞, 宿树兰, 江曙, 等. 丹红注射液生产过程中丹参固体废弃物的资源性成分分析及其转化机制研究[J]. 中草药 , 2015, 46 (16) :2471–2476. |
| [2] | 段金廒, 吴启南, 宿树兰. 2012-2013年我国中药及天然药物资源研究进展与学科建设[J]. 中国现代中药 , 2014, 41 (9) :693–703. |
| [3] | 陶小芳, 沈飞, 宿树兰, 等. 生脉注射液生产过程五味子药渣中资源性物质的分析与循环利用途径探讨[J]. 中草药 , 2015, 46 (18) :2712–2719. |
| [4] | 段金廒, 严 辉, 钱大玮, 等. 一种具有抗菌活性的当归地上部分有效部位及其制备方法和其应用: 中国, 200910246420.7 [P]. 2011-05-18. |
| [5] | Xia L J, Liu X F, Guo H Y, et al. Partial characterization and immunomodulatory activity of polysaccharides from the stem of Dendrobium officinale (Tiepishihu) in vitro[J]. J Funct Foods , 2012, 4 (1) :294–301. |
| [6] | 殷洪梅, 吕新勇, 萧伟. 金银花多糖的制备工艺优化及免疫活性研究[J]. 中国中药杂志 , 2010, 4 (35) :453–455. |
| [7] | 王剑, 付田, 蒲蔷, 等. 川牛膝多糖的体内免疫活性研究[J]. 中药药理与临床 , 2008, 23 (6) :31–33. |
| [8] | 段金廒. 中药废弃物的资源化利用[M]. 北京: 中国中医药出版社, 2014 . |
| [9] | 朱华旭, 段金廒, 郭立玮, 等. 基于膜科学技术的中药废弃物资源化原理及其应用实践[J]. 中国中药杂志 , 2014, 39 (9) :34–38. |
| [10] | 伍利华, 黄英, 刘婷, 等. 陶瓷膜分离技术应用于中药口服液的研究进展[J]. 药物评价研究 , 2014, 37 (2) :184–187. |
| [11] | 焦光联, 杨艳, 何葆华. 超滤提取黄芪多糖的工艺研究[J]. 化学与生物工程 , 2010, 27 (8) :58–61. |
| [12] | Sun H J, Qi D, Xu J Y, et al. Fractionation of polysaccharides from rapeseed by ultrafiltration: Effect of molecular pore size and operation conditions on the membrane performance[J]. Sep Purif Technol , 2011, 80 (3) :670–676. |
| [13] | 殷红梅, 尚强, 萧伟. 金银花多糖脱蛋白质方法的研究[J]. 中草药 , 2010, 41 (1) :584–586. |
| [14] | 李艳辉, 鲁巍巍, 官艳丽, 等. 玉竹多糖脱蛋白方法的比较研究[J]. 时珍国医国药 , 2011, 22 (9) :2127–2128. |
| [15] | Xie J H, Shen M Y, Nie S P, et al. Separation of water-soluble polysaccharides from Cyclocarya paliurus by ultrafiltration process[J]. Carbohydr Polym , 2014, 101 (1) :479–483. |
| [16] | Ren Z, He C H, Fan Y H, et al. Immune-enhancing activity of polysaccharides from Cyrtomium macrophyllum[J]. Int J Biol Macromol , 2014, 70 :590–595. |
| [17] | 陈璋辉, 陈云龙, 吴涛, 等. 细茎石斛多糖DMP4a-1的结构特性及免疫活性研究[J]. 中国药学杂志 , 2005, 40 (23) :1781–1784. |
| [18] | Liu J, Chen X, Yue C J, et al. Effect of selenylation modification on immune-enhancing activity of Atractylodes macrocephala polysaccharide[J]. Int J Biol Macromol , 2015, 72 :1435–1440. |
| [19] | Zhang W X, Song D, Xu D, et al. Characterization of polysaccharides with antioxidant and immunological activities from Rhizoma Acori Tatarinowii[J]. Carbohydr Polym , 2015, 133 :154–162. |
| [20] | Cui H Y, Wang C L, Wang Y Y, et al. The polysaccharide isolated from Pleurotus nebrodensis (PN-S) shows immune-stimulating activity in RAW264.7 macrophages[J]. CJNM , 2015, 13 (5) :355–360. |
| [21] | Sun W J, Meng K, Qi C H, et al. Immune-enhancing activity of polysaccharides isolated from Atractylodis macrocephalae Koidz[J]. Carbohydr Polym , 2015, 126 :91–96. |
| [22] | Banskota A H, Stefanova R, Sperker S, et al. Five new galactolipids from the freshwater microalga Porphyridium aerugineum and their nitric oxide inhibitory activity[J]. J Appl Phycol , 2012, 25 (4) :951–960. |
| [23] | Li C, Huang Q, Fu X, et al. Characterization, antioxidant and immunomodulatory activities of polysaccharides from Prunella vulgaris Linn[J]. Int J Biol Macromol , 2015, 75 :298–305. |
| [24] | Chen Y G, Shen Z J, Chen X P. Evaluation of free radicals scavenging and immunity-modulatory activities of Purslane polysaccharides[J]. Int J Biol Macromol , 2009, 45 (5) :448–452. |
| [25] | Jian H X, Ming Y S, Shao P N, et al. Separation of water-soluble polysaccharides from Cyclocarya paliurus by ultrafiltration process[J]. Carbohydr Polym , 2014, 101 :479–483. |
| [26] | 赵振坤, 王淑玲, 丁刘涛, 等. 中药药渣再利用研究进展[J]. 杭州师范大学学报: 自然科学版 , 2012, 11 (1) :38–42. |
 2016, Vol. 47
2016, Vol. 47


