2. 福建出入境检验检疫局技术中心, 福建 福州 350003
2. Inspection and Quarantine Technique Centre of Fujian Entry-exit Inspection and Quarantine Bureau, Fuzhou 350003, China
雷公藤为卫矛科(Celastraceae)雷公藤属Tripterygium Hook. f. 植物雷公藤Tripterygium wilfordii Hook. f.、昆明山海棠T. hypoglaucum (Levi.) Hukeda(又名黑麦)、苍山雷公藤T. forretii Dials及东北雷公藤T. regelli Sprague et Taketa等植物干燥根或根的木质部。其味苦、辛,性寒,有大毒,归肝、肾经,有祛风湿、活血通络、消肿止痛、杀虫解毒的功效[1]。雷公藤内酯醇(TP)是从上述各雷公藤植物中分离得到的二萜内酯类化合物,是雷公藤的主要有效成分之一,具有显著的抗炎[2-4]、抗肿瘤[5-10]、抗生育、免疫抑制及肾保护作用[11],临床应用广泛。但因其口服、静脉注射毒性较大,临床使用受到了限制。本课题组曾对其外用剂型透皮贴剂的制备工艺进行了研究,所得的制剂初黏力、外观、持黏力及稳定性良好[12-14]。
自1964年,英国科学家Bangham等[15]首次报道应用负染法在电子显微镜下观察到磷脂及表面活化剂修饰的化合物结构以来,脂质体的研究得到了越来越多的关注。1971年,英国学者Ryman等[16]将脂质体作为新型载药系统应用于药学领域,脂质体开始在药物输送系统方面发挥其独特的优势。纳米脂质体(nano liposomes,NLS)是一种在常规脂质体的基础上结合纳米技术发展起来的新型载药系统,在稳定性、吸收和体内分布等方面具有纳米粒子的特殊效应,可以携载亲水性、疏水性及两亲性药物,直接输送至靶组织发挥药效作用。目前常用的制备方法有高压均质法[17]、乙醇注入法[18]和旋转蒸发超声法[19]等。
本研究将TP制备成NLS,使药物微粒易于透过皮肤,后续拟研发成外用涂膜、凝胶等剂型,药物通过体表皮肤渗透,绕过肝脏的首关效应直达病灶,TP从NLS中缓慢释放,避免剂量的峰谷现象,收获减毒增效的功效。根据预试验结果,选择磷脂类辅料和泊洛沙姆188(poloxamer 188,P188)等为基质,采用高压均质法制备雷公藤内酯醇纳米脂质体(TP-NLS)。
1 仪器和材料Bicfuge fresco型小型台式高速冷冻离心机,HERAEUS;20A型岛津制备高效液相色谱仪,岛津公司;H01-3型恒温磁力搅拌器,上海梅颍浦仪器仪表制造有限公司;DL-I-15台式封闭电炉,天津市泰斯特仪器有限公司;KQ2200E型超声波清洗器,昆山市超声仪器有限公司;SHZ-III型循环水真空泵、RE-2000B型旋转蒸发器,上海亚荣生化仪器厂;AL204型电子分析天平,梅特勒-托利多仪器(上海)有限公司;ABZ1-0501-P型艾科浦超纯水系统,颐洋企业发展有限公司;Zeta PALS型高分辨Zeta电位及粒度分析仪,美国布鲁克海文仪器公司;GJJ型超高压均质泵,上海诺尼轻工机械有限公司;Nanosep®10KDa离心超滤管,美国PALL公司;Centrifuge 5810 R高速冷冻离心机,德国Eppendorf公司。
TP对照品,批号111597-200502,购自中国食品药品检定研究院;TP,质量分数≥98%,由福建省医学科学研究院药物所提供;脂类基质a(大豆卵磷脂),批号3204080,上海雅心生物技术有限公司;脂类基质b,批号F20111207,国药集团化学试剂有限公司;甘油(丙三醇),分析纯,国药集团化学试剂有限公司;P188,批号9003-11-6,上海源叶生物科技有限公司;三氯甲烷,批号1330513,南京利盛化学试剂有限公司;乙腈(色谱纯)、甲醇(批号1309111),西陇化工股份有限公司;自制超纯水。
2 方法与结果 2.1 TP-NLS的制备 2.1.1 TP溶液的配制精密称取一定量TP,溶解在一定体积的甲醇中,制成TP质量浓度为1.00 mg/mL的溶液,备用。
2.1.2 甘油溶液的配制称取一定量的甘油,溶解于超纯水中,制备质量分数为1.25%的甘油溶液[20],备用。
2.1.3 TP-NLS的制备工艺根据实验条件及预试验结果,采用高压均质法制备TP-NLS,以制备TP-NLS的2种脂类基质a与b的配比(A)、P188的用量(B)及其均质压力(C)为3个考察因素,设计7个水平。采用3因素7水平,建立均匀实验设计表U7(73) 安排实验。
按均匀设计安排的基质的配比,分别精密称取脂类基质a 1.2 g,脂类基质b 0.2 g,置于同一烧杯中,用适量的三氯甲烷将其完全溶解,再加入1 mg/mL的TP甲醇溶液24 mL,混匀,旋转减压蒸发除尽有机溶剂,并在圆底烧瓶的内壁上形成一层均匀薄膜,备用。
将P188溶解在80 ℃、600 mL等温等渗的1.25%甘油溶液,待该溶液温度降至40 ℃左右时,倒入上述形成薄膜的圆底烧瓶,缓慢旋转烧瓶,使薄膜溶胀并脱落,所得溶液置于磁力搅拌器充分搅拌溶胀,即得乳白色不透明TP脂质体溶液,该溶液倾入高压均质机,按均匀实验设计表U7(73) 设计的均质压力,循环均乳,均质后溶液用0.45 μm微孔滤膜抽滤,即得TP-SLN溶液600 mL,密封,避光冷藏备用。
2.2 TP-NLS的HPLC测定 2.2.1 色谱条件Diamonsil C18分析柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水(30∶70);体积流量1.0 mL/min;测定波长220 nm;柱温20℃,进样量20 μL。
2.2.2 对照品溶液的制备精密称取TP对照品适量,用30%乙腈溶液配制成1 mg/mL的TP对照品溶液,备用。
2.2.3 供试品溶液的制备取均匀的TP-NLS溶液1 mL,经0.22 μm微孔滤膜滤过,即得TP-NLS总量测定溶液;另量取TP-NLS溶液0.5 mL,置于Nanosep®10KDa离心超滤管上端,高速冷冻离心机13 000 r/min离心20 min,所得滤液即为游离TP测定溶液。
2.2.4 线性关系考察精密吸取“2.2.2”项下TP对照品溶液适量,配制成系列质量浓度为10、20、30、50、80 μg/mL的对照品溶液,按“2.2.1”项色谱条件测定峰面积,计算得线性回归方程Y=41 922 X+11 801,r=0.999,表明TP在10~80 μg/mL线性关系良好。
2.2.5 精密度试验选取同一份TP对照品溶液(质量浓度30 μg/mL),精密吸取20 μL,按“2.2.1”项色谱条件连续进样5次,测定峰面积,计算RSD为1.3%,表明仪器精密度良好。
2.2.6 稳定性试验选取同一份供试品溶液(3号试验所得样品,质量浓度为38 μg/mL),在“2.2.1”项色谱条件下,分别于0、0.5、1、2、4、8 h进样20 μL,测定,计算峰面积的RSD为1.7%,表明供试品溶液在常温8 h内稳定性良好。
2.2.7 重复性试验按照“2.2.3”项方法平行制备6份供试品溶液(3号试验所得样品,质量浓度为38 μg/mL),精密吸取20 μL,按“2.2.1”项色谱条件进样分析,测定峰面积,计算TP质量浓度的RSD为1.9%,表明方法重复性高。
2.2.8 加样回收率试验选取已知质量浓度的供试品溶液6份(3号试验所得样品,质量浓度为38 μg/mL),分别加入0.03 mg/mL的TP对照品溶液适量,按照“2.2.3”项方法制备供试品溶液,进样测定,计算平均回收率为98.7%,RSD为1.3%。
2.3 包封率的测定采用离心超滤法测定TP-NLS的包封率[20]。取 适量TP对照品配制成质量浓度分别为20、40、80 μg/mL溶液,HPLC法测定其峰面积,另各取3种不同质量浓度的TP对照品溶液适量,分别置于离心超滤管上端,13 000 r/min离心20 min,HPLC测定滤液的峰面积为1 603 979,连续测定3次,取均值,结果平均回收率为99.2%,说明此超滤膜对游离药物TP几乎无吸附,可用于TP-NLS包封率的测定。
取1 mL TP-NLS,13 000 r/min离心20 min,取上清液进样,测定药物总量(W总),另取1 mL TP-NLS置于离心超滤管中,离心,测定滤液中药物质量浓度,计算游离药物量(W游)。按《中国药典》2015年版[21]脂质体包封率的计算公式计算包封率,即包封率=(W总-W游)/W总,W总为总药物量,W游为未包封的游离药物量,检测结果见图 1和表 1。
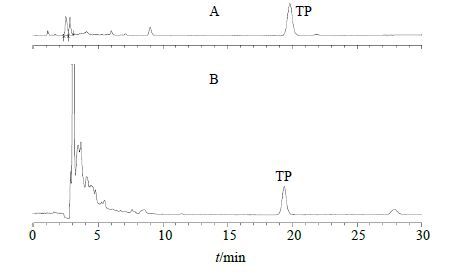
|
图 1 TP 对照品 (A) 和TP-NLS 超滤溶液 (B) 的HPLC图 Fig.1 HPLC of TP reference substance (A) and TP-NLS ultrafiltration solution |
2.4 平均粒径和Zeta电位的测定
取新制TP-NLS溶液1 mL,采用Zeta PALS型高分辨Zeta电位及粒度分析仪,测定TP-NLS的平均粒径,多分散系数(PDI)和Zeta电位,粒径检测结果见图 2,Zeta电位检测见图 3,数据见表 1。
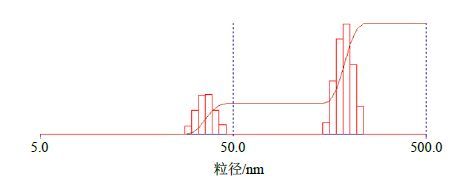
|
图 2 TP-NLS 的粒径及多通道分布图 Fig.2 Size and multi-channel distribution of TP-NLS |
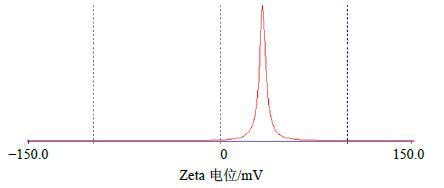
|
图 3 TP-NLS 的Zeta 电位图 Fig.3 Zeta potential of TP-NLS |
2.5 均匀设计法优选处方 2.5.1 实验设计及结果
以制备TP-NLS的磷脂类基质a与b的配比(A)、P188的用量(B)及其均质压力(C)为3个考察因素,设计7个水平。查阅均匀设计有关文献[22],选择U7(73) 配方均匀设计表进行试验,见表 1。
|
|
表 1 U7(73) 均匀设计与试验结果 Table 1 U7(73) uniform design and test results |
2.5.2 数据处理
根据实验需要制定包封率、粒径、电位的评分标准,具体如下。
包封率大于80%为100分,80%~61%为99~80分,60%~51%为79~60分,50%~41%为59~50分,40%~21%为49~30分,小于10%为30分以下。
粒径大于500 nm为0分,300~500 nm为0~50分,250~300 nm为50~60分,200~250 nm为60~70分,150~200 nm为70~80分,100~150 nm为80~90分,小于100 nm为90~100分。
Zata电位大于50 mV为90~100分,40~50 mV为80~90分,30~40 mV为70~80分,20~30 mV为60~70分,10~20 mV为40~60分,小于10 mV为40分以下。评分结果见表 1。
根据《试验设计与数据处理》[22],求得的3元线性回归方程为y=348.141-0.180 75 x1-53.610 5 x2-1.018 05 x3,y为因变量(综合评分),x1、x2、x3为自变量(即A、B、C 3个因素)。
2.5.3 方差分析及因素主次的确定总平方和SST=5 048.225,偏回归平方和SS1=34.485,SS2=3 628.037,SS3=1 113.899,回归平方和SSR=SS1+SS2+SS3=4 776.421,残差平方和SSe=SST-SSR=3 934.326,复相关系数R=(SSR/SST)0.5=0.973,方差分析见表 2。
|
|
表 2 方差分析 Table 2 Analysis of variance |
对于给定的显著水平α=0.05,自变量个数m=3,试验次数n=7时,查阅文献资料[23]得对应的临界值Rmin=0.950<0.973,所建立的线性回归方程与试验数据拟合得较好,试验设计的3个因素对TP-NLS均有不同程度的影响。其中第2个因素对试验结果的影响十分显著(P<0.01),第3个因素对试验结果影响也较大,第1个因素对实验结果影响最小,3个因素的影响大小顺序为B>C>A,即P188的用量>均质压力>磷脂类基质的配比。
2.5.4 最佳制备工艺的判定根据均匀设计的实验结果及其计算得出的回归方程,P188的用量对TP-NLS影响最大,P188的用量与实验结果呈现负向关系,用量越大综合得分越小,故用量不宜过多,但查阅文献资料[24]可知,P188是一种可静脉注射的聚氧乙烯聚氧丙烯醚嵌段共聚物非离子表面活性剂,作为一种膜表面修饰剂,其聚氧乙烯亲水长链镶嵌于磷脂双分子层中,降低了血浆蛋白的调理作用,减弱吞噬作用,延长药物在血中的滞留时间,达到减毒增效的目的,由此可见,P188在TP-NLS减毒中占有重要位置,综合考虑,制备600 mL TP-NLS溶液P188的用量为1.3 g。均质压力对于TP-NLS的影响也较大,且综合评分也随着均质压力的增大而减小,查阅相关文献得知,均质压力过高,会引起药物渗漏,包封率反而会降低[25],均质压力过小均质不均匀,NLS粒径达不到预期的效果,故均质压力选取70 MPa。脂类基质的配比影响最小,随着配比的增大综合得分减小,考虑材料节约问题,所以脂类基质a 1.2 g,脂类基质b 0.2 g。
另查阅文献资料[26]可知循环5次均质效果较好,通过预试验,计算600 mL溶液经实验所用高压均质机乳匀5次的时间为15 min。
2.6 优化处方的验证分别精密称取大豆卵磷脂(脂类基质a)1.2 g,脂类基质b 0.2 g,置于同一烧杯中,加入适量的三氯甲烷使之溶解,再加入48 mL的TP甲醇溶液(质量浓度1 mg/mL),混匀,于旋转蒸发仪中旋转减压蒸发除尽有机溶剂,并使在圆底烧瓶的内壁上形成均匀的薄膜,备用。
将P188溶解在80 ℃、600 mL等温等渗的1.25%甘油溶液中,待水溶液温度降至40 ℃左右时,倒入已形成薄膜的圆底烧瓶,置于旋转蒸发仪中缓慢旋转,使薄膜脱落,直至溶胀充分后,于磁力搅拌器上充分搅拌溶胀后(约20 min),倾入高压均质机中均质,设置均质压力为70 MPa,乳匀15 min,均质后经0.45 μm微孔滤膜抽滤,即得TP-NLS溶液。按上述方法,重复制备3份TP-NLS溶液,检测,数据见表 3。
|
|
表 3 3批样品测定数据 Table 3 Data of three batches of samples |
由表 3可以看出,处方验证制备的包封率平均83.52分、粒径平均87.87分、Zeta电位79.92分,平均综合评分251.31分,综合得分高于均匀设计实验所得的TP-NLS溶液,由此可见,确定上述处方为制备TP-NLS溶液的最佳处方。
2.7 TP-NLS溶液稳定性考察取5份“2.6”项制备的TP-NLS 25 mL于容量瓶中,在室温条件下(无遮光)放置30 d,同时另取5份放置于冰箱4 ℃,避光条件下保存30 d,观测30 d内不同保存环境下TP-NLS外观及粒径变化。结果在室温下放置15 d后脂质体粒径接近1 μm,40 ℃微热可恢复至透明状态,30 d后粒径大于1 μm,脂质体絮凝;在4 ℃条件下放置15 d溶液呈乳白色,轻摇微绢丝样,室温恢复透明,30 d后可见溶液微乳白色半透明状态,在40 ℃水浴条件下微热5 min可恢复透明状态,结果(表 4)表明TP-NLS在4 ℃避光环境下保存30 d稳定性良好。
|
|
表 4 TP-NLS稳定性考察 Table 4 Stability of TP-NLS |
3 讨论 3.1 2种磷脂类基质的配比
预试验曾采用其他试剂作为稳定剂,如卵磷脂、 油酸、胆固醇以及油酸与硬脂酸的混合物,最后发现,当应用2种磷脂类基质作为稳定剂时,NLS的稳定性相对于其他试剂时的效果好。前期预试验脂类基质a与b的配比从1∶1开始,直至5∶1,所得的脂质体薄膜成片粘附在圆底烧瓶上,加入P188甘油溶液溶胀不均匀。配比调为6∶1~12∶1获得的脂质体薄膜,加入P188甘油溶液,易溶胀成均匀的乳白色溶液。但增大至13∶1以上,薄膜又呈现不易溶胀现象,故实验设计脂类基质a与b配比范围为6∶1~12∶1,最终确定为6∶1。
3.2 P188的用量实验中P188的用量和其他2个因素比较,对实验结果影响最大,也是TP-NLS减毒的重要因素,因为P188无毒,所以更适合于制剂用辅料。预试验中P188用量1.2 g效果较好,于是在1.2 g左右调节7个水平进行均匀实验,最终确定P188的最佳用量为1.3 g。
3.3 均质压力均质压力对实验结果影响较大,均质压力太小均质程度不够,NLS粒径偏大,易于沉降,影响TP-SLN的稳定性,且过大的药物粒子不利于穿透肿瘤细胞,发挥药效;均质压力过大,TP-SLN易破裂,导致药物外漏,降低包封率,影响减毒作用。
3.4 包封率目前TP-NLS包封率仍不是十分理想,应继续考察包封率是否与P188的用量有关,非离子表面活性剂会促进TP在溶液中的溶解,导致被包封的药量减少;或是压力过大,致使NLS破裂药物渗漏;又或是均质时间过长,NLS破裂导致,还需进一步深入研究。
3.5 稳定性TP-NLS溶液具有潜在的不稳定性,放置时间、温度及光照均可影响其状态。因此,制备好的TP-NLS须置于冷藏室避光保存。
| [1] | 高学敏. 中药学 [M]. 北京: 中国中医药出版社, 2010 . |
| [2] | 李兴旺, 尚游, 张冰, 等. 雷公藤内酯醇对大鼠重症急性胰腺炎肺损伤的影响[J]. 中国中西医结合急救杂志 , 2009, 16 (5) :296–298. |
| [3] | 陈海生, 张海峰, 陈海琴, 等. 雷公藤内酯醇抑制CXCL11表达对大鼠重症急性胰腺炎急性肺损伤的影响[J]. 交通医学 , 2012, 26 (3) :209–212. |
| [4] | 王会玲, 周晓春, 龚理, 等. 雷公藤内酯醇对AD细胞模型核因子κB表达及炎性因子释放的影响[J]. 时珍国医国药 , 2013, 34 (5) :1100–1102. |
| [5] | 文璐, 陈燕, 曾令兰, 等. 雷公藤内酯醇对多发性骨髓瘤U266细胞组蛋白去甲基化酶的调节作用[J]. 中草药 , 2012, 43 (10) :1975–1980. |
| [6] | 王恒邦, 许建华, 温彩霞, 等. 雷公藤内酯醇体内外抗肿瘤作用[J]. 福建医科大学学报 , 2007, 41 (4) :304–307. |
| [7] | 邹党华, 谭布珍, 黄艳琴, 等. 小剂量雷公藤内酯醇对荷卵巢大鼠体内抑瘤作用的观察[J]. 江西医学院学报 , 2009, 49 (2) :110–111. |
| [8] | 俞萍丽, 陈元仲, 许建华. 雷公藤内酯醇对人结肠癌细胞株SW-480、HT-29体内外作用的研究[J]. 中国药学杂志 , 2010, 45 (1) :28–31. |
| [9] | 马薇, 魏柏, 熊枝繁. 雷公藤内酯醇联合热疗对MKN28细胞增殖抑制作用的研究[J]. 现代肿瘤医学 , 2014, 22 (1) :38–40. |
| [10] | 刘媛, 陈燕, 赵菲, 等. 雷公藤内酯醇对多发性骨髓瘤RPMI 8226细胞周期及P21wap1/cip1和P27kip1表达的影响[J]. 中草药 , 2010, 41 (11):1819-1823 . |
| [11] | 包自阳, 朱彩凤, 李苞芳, 等. 雷公藤内酯醇对肾缺血再灌注大鼠凋亡诱导因子及细胞间粘附分子-1表达的影响[J]. 中国中西医结合肾病杂志 , 2012, 13 (4) :306–309. |
| [12] | 钱丽萍, 阙慧卿, 林绥, 等. 正交试验优选雷公藤涂膜剂的基质组成[J]. 药物评价研究 , 2011, 34 (6) :442–444. |
| [13] | 阙慧卿, 钱丽萍, 林绥. 均匀设计优化雷公藤内酯醇透皮贴剂的处方研究[J]. 中草药 , 2011, 42 (12) :2468–2470. |
| [14] | 钱丽萍, 阙慧卿, 林绥, 等. 雷公藤内酯醇生物贴的稳定性研究[J]. 药物评价研究 , 2012, 35 (3) :182–184. |
| [15] | Bangham A D, Horne R W J. Negative staining of phospholipids and their structural modification by surface-active agents as observed in the electron microscope[J]. J Mol Biol , 1964, 8 (5) :660–668. |
| [16] | Gregoriadis G, Ryman B E. Liposomes as carriers of enzymes or drugs: A new approach to the treatment of storage diseases[J]. Biochem J , 1971, 124 (5) . DOI:10.1042/bj1240058P |
| [17] | 陈桐楷, 李园, 林华庆, 等. 高压乳匀制备氢溴酸高乌甲素固体直至纳米粒工艺研究[J]. 中国药学杂志 , 2010, 45 (6) :440–443. |
| [18] | 陈颖, 叶娟, 陈艳婷, 等. α-细辛脑脂质体的制备与体外释放药物的考察[J]. 今日药学 , 2013, 23 (1) :11–22. |
| [19] | 张峰, 张阳德, 赵劲风, 等. 苯磺酸氨氯地平柔性纳米脂质体的制备[J]. 中国现代医学杂志 , 2011, 21 (5) :541–548. |
| [20] | 张生杰, 焦文温, 张瑜, 等. 异穿心莲内酯固体脂质体纳米粒的制备及体外释放研究[J]. 中草药 , 2012, 43 (12) :2390–2395. |
| [21] | 中国药典 [S]. 一部. 2015. |
| [22] | 曾昭钧. 均匀设计及其应用[M]. 北京: 中国医药科技出版社, 2005 . |
| [23] | 李云雁, 胡传荣. 试验设计与数据处理[M]. 北京: 化学工业出版社, 2009 . |
| [24] | 陈琼玲, 刘红芝, 刘丽, 等. 白藜芦醇纳米脂质体研究进展[J]. 核农学报 , 2013, 27 (7) :962–967. |
| [25] | 柯学, 王长江, 胡一桥. 泊洛沙姆188修饰的蜂毒素脂质体在大鼠体内的药动学[J]. 中国医院药学杂志 , 2010, 30 (3) :198–201. |
| [26] | 龚连生, 曾雅娟, 张阳德, 等. 阿霉素纳米脂质体制备工艺研究[J]. 中国现代医学杂志 , 2009, 19 (24) :3756–3759. |
 2016, Vol. 47
2016, Vol. 47


