2. 湖南师范大学生命科学学院, 湖南 长沙 410081
2. College of Life Sciences, Hunan Normal University, Changsha 410081, China
茯苓Poria cocos (Schw.) Wolf是我国传统的中药材,其药用已有2 000多年的历史。《神农本草经》中把茯苓列为上品,有“久服安魂养神,不饥延年”的作用。另外,茯苓也是我国历史悠久的食品和保健品,如茯苓饼、茯苓酒、茯苓糕、茯苓包子和茯苓粥等。目前,茯苓的研究主要集中在次生代谢产物上,研究最多的是茯苓多糖,茯苓多糖及其衍生物羧甲基茯苓多糖具有免疫调节、抗肿瘤、降血糖、调血脂和保肝等作用[1-5];其次是茯苓三萜化合物,研究发现其具有抗炎、抗氧化及抑制肿瘤细胞生长等药理作用[6-10];而茯苓蛋白质的研究报道很少,仅有许辅等[11]对茯苓免疫调节蛋白PCP的纯化与生理活性进行了研究;另外,本研究室李洪波等[12]对茯苓免疫调节蛋白-I抗体制备进行了研究。
液体发酵培养具有生产周期短、成本低、能够大规模工业化生产等优势,广泛用于灵芝、茯苓、冬虫夏草和香菇等真菌培养[13-14]。茯苓发酵液能够产生蛋白质、多糖等大分子物质和氨基酸、维生素、抗生素、生物碱、甾醇类、黄酮类等小分子活性物质,是茯苓天然活性化合物的重要来源之一。此外,研究发现通过液体发酵获得的茯苓发酵液含有的活性成分与茯苓菌核所含活性成分有差别[15-16],因此开展茯苓发酵液的活性成分研究很有意义。迄今为止,未见有关茯苓发酵液蛋白质研究的报道,对于茯苓发酵液中含有哪些蛋白质也是未知。因此,本实验开展了茯苓发酵液蛋白质的分离与鉴定研究,对后续开展重要茯苓蛋白质的系统研究以及开发茯苓蛋白饮料和保健品具有指导意义。
1 仪器与材料Protean II垂直平板电泳槽和PowerpacTM通用电泳仪,美国伯乐公司;Micro TOFQ-II电喷雾-四极杆-飞行时间串联质谱仪,配备有纳流(nano)喷雾源,德国布鲁克公司;Ultimate 3000液相色谱仪,戴安公司,DU-800紫外可见分光光度仪,美国贝克曼公司。
茯苓菌种湘靖28购自于湖南怀化靖州湘桂黔药用菌研究所,胰蛋白酶(蛋白质组学级,CAS号9002-07-7)、碳酸氢铵(CAS号1066-33-7)、三氯乙酸(CAS号76-03-9)、三氟乙酸(CAS号76-05-1)、苯甲基磺酰氟(CAS号76-05-1)、二硫苏糖醇(CAS号3483-12-3)、碘乙酰胺(CAS号87-51-4)、Hepes(CAS号7365-45-9)和甲酸(CAS号64-18-6)购自于美国Sigma公司;丙烯酰胺(CAS号79-06-1)、甲叉-双丙烯酰胺(CAS号110-26-9)、甘氨酸(CAS号56-40-6)、三羟甲基氨基甲烷(CAS号77-86-1)和十二烷基硫酸钠(CAS号151-21-3)购自于美国Amresco公司;考马斯亮蓝G-250(CAS号6104-58-1)购自于美国Bio-Rad实验室;色谱纯乙腈(CAS号75-05-8)购自生工生物工程(上海)有限公司,其他试剂为国产分析纯试剂。
2 方法和结果 2.1 菌种的活化及发酵培养制备PDA斜面培养基5支,将菌种湘靖28接种到PDA培养基后放入26 ℃恒温培养箱中培养3 d左右,然后将固体培养菌种接种到液体培养基进行种子活化培养7 d,种子液体培养基配方为:葡萄糖20 g、酵母浸膏4 g、蛋白胨6 g、MgSO4•7H2O 1 g、KH2PO4 2 g、维生素B1(VB1)40 mg、蒸馏水1 000 mL、pH自然(4.9)。然后再配制液体深层发酵培养基,其配制方法为葡萄糖20 g、蛋白胨10 g、MgSO4•7H2O 1.5 g、KH2PO4 3 g、VB1 40 mg、蒸馏水1 000 mL、pH自然(4.9)。在250 mL三角瓶分别装入45 mL液体发酵培养基和5 mL种子液,以26 ℃和160 r/min转速摇瓶培养6 d。将培养好的发酵液,4 ℃、11 000 r/min离心20 min,上清液即为粗酶液。
菌种活化与发酵培养时每天进行鉴定,发现白色菌丝长势良好,生长迅速,没有出现杂菌的污染。菌种液体发酵培养时每天检测菌丝体的生长情况,发现有染菌的就将其剔除,保留发酵正常的,6 d发酵过程中发现3瓶染菌,剩下的25瓶发酵正常。收集发酵液离心得到粗酶液约1 200 mL,菌丝体湿质量17.12 g。
2.2 茯苓发酵液蛋白质质量浓度测定茯苓发酵液蛋白质质量浓度测定采用Bradford法。具体过程简述如下:取6支编号的干净试管分别加入0、0.2、0.4、0.6、0.8、1.0 mL 100 μg/mL牛血清白蛋白溶液,向前5支试管中加蒸馏水至溶液总体积为1.0 mL。再向6支试管中分别加入5 mL的考马斯亮蓝G-250染液,混匀后室温下静置5 min后在595 nm处比色,记录每个溶液的吸光度(A595)值并制作标准曲线,得到回归方程。另取3支干净试管,每支试管分别加入5 mL的考马斯亮蓝G-250染液和1.0 mL样品粗酶液,同样混匀后在595 nm处比色记录得到样品溶液A595值,取平均值代入回归方程计算得到粗酶液中蛋白质的质量浓度。
经测定得到6支试管溶液的A595值分别为0、0.075、0.147、0.225、0.292、0.378。通过标准曲线软件制作得到回归方程:Y=0.003 7 X-0.000 9,r为0.999 6。样品溶液的A595值分别为0.272、0.276、0.281,取平均值0.276代入回归方程得到样品溶液蛋白质质量浓度为74.01 μg/mL,茯苓发酵液中蛋白质的质量浓度较低。
2.3 茯苓发酵液蛋白质的提取与SDS-PAGE发酵液分离采用丙酮-三氯乙酸沉淀法提取茯苓发酵液蛋白质。将含有20 μmol/L 二硫苏糖醇的10%三氯乙酸溶液20 mL倒入50 mL粗酶液中混匀,在4 ℃下静置2 h;4 ℃,15 000×g离心30 min,保留沉淀;通过倒置的方法将离心管反扣于干净的滤纸上,使其干燥。待其干燥后,加入3 mL预冷丙酮于沉淀中,混匀并在冰上反应30 min。4 ℃,15 000×g离心20 min,取沉淀在空气中干燥。用含100 μmol/L 二硫苏糖醇的2% SDS溶液裂解蛋白,在沸水浴中煮沸5 min后点样进行电泳实验。电泳时参照Bio-Rad公司方法进行,采用Tris-甘氨酸不连续凝胶系统,凝胶体系为5%的浓缩胶及12%的分离胶。10 mA恒流电泳溴酚蓝线迁移移至分离胶与浓缩胶界面时,增大电流至20 mA。待溴酚蓝线距离胶下沿0.5 cm处时停止电泳。染色和脱色:将凝胶剥离,胶先用固定液(乙酸-甲醇-水1∶4∶5)固定1 h,水洗4次(15 min/次),然后加入G-250胶体考染液[100 mL双蒸水+100 mL 85% H3PO4→混匀后加100 g (NH4)2SO4→溶解后加500 mL双蒸水→加1.2 g考马斯亮蓝G-250(可过夜)→溶解后加入200 mL甲醇→混匀定容到1 000 mL,保存在棕色瓶中,室温下储存]中染色3 h,去掉染色液,水洗3~5次至背景清晰。
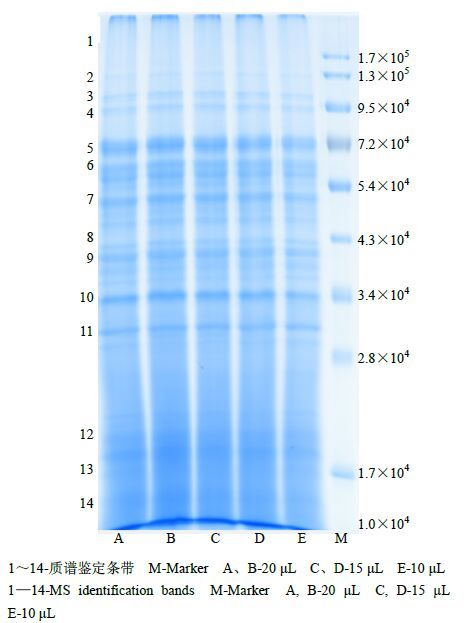
图 1为茯苓发酵液中蛋白质SDS-PAGE图谱。泳道A和B上样量为20 μL,泳道C和D上样量为15 μL,泳道E上样量为10 μL;M为Marker;1~14为酶切条带。从电泳图谱中可知茯苓发酵液蛋白质相对分子质量(M)主要分布在2.8×104~1.3×105区域,其中2.8×104~7.2×104区域最多,1.3×105以上区域分布很少。另外,从电泳图中可以发现不同上样量对电泳条带除了亮度有些细微差异外,条带数目差异不明显。
|
图 1 茯苓发酵液中蛋白质SDS-PAGE Fig.1 SDS-PAGE of proteins in P. cocos fermentation broth |
2.4 蛋白质条带的胶内酶解、质谱分析与搜寻鉴定
蛋白质原位酶解参照Hellmann等[17]的方法进行。主要步骤为(1)脱色:将胶带切割后,分别置于EP管中,加入100 μL脱色液(50%乙腈,25 mmol/L NH4HCO3)于37 ℃温水浴30 min,反复操作至胶块无色透明,最后加入100 μL乙腈至胶成白色胶块,冻干。(2)还原烷基化:向冻干后的胶块中加入50 μL含10 mmol/L 二硫苏糖醇的25 mmol/L NH4HCO3溶液,56 ℃水浴1 h后室温冷却,吸出多余的液体,加入同体积的含55 mmol/L碘乙酰胺的25 mmol/L NH4HCO3溶液,室温暗处放置45 min。反应完成后,依次用25 mmol/L NH4HCO3溶液、50%乙腈、100%乙腈冲洗。重复操作1次后冷冻干燥。(3)酶解:将胰蛋白酶(质谱纯)溶于1 mmol/L的盐酸中,终质量浓度为1 μg/μL,−20 ℃保存。溶液使用前,用25 mmol/L NH4HCO3溶液将胰蛋白酶的终质量浓度配制成0.02 μg/μL。向每个胶条加入约8 μL的酶液使其充分吸胀,然后去掉多余的酶液,加入50 μL 25 mmol/L NH4HCO3溶液覆盖。37 ℃水浴酶解过夜(16 h)。酶解后的肽片段依次用50 μL含0.1% TFA的30%乙腈溶液、50%乙腈和90%乙腈溶液梯度萃取,合并萃取液,冻干后置−20 ℃保存,备用。
胶内酶解后的样品用10 μL样品溶解液(5%乙腈的水溶液)重新溶解后转入进样瓶,准备nano LC-MS/MS分析。质谱仪为德国Bruker公司的电喷雾-四极杆-飞行时间串联质谱Micro TOFQ-II,配备戴安公司的Ultimate3000毛细管液相色谱仪(Nano LC)和纳升(Nano)喷雾源。采用正离子模式下,用Glu-fib的串联碎片进行校正,质量误差为±0.1。雾化气为氮气,碰撞气为氩气,离子源温度为150 ℃,锥孔电压为1 200 V。仪器的MS和MS/MS的转换通过micro TOF control 3.0控制软件自动切换,限制条件为MS信号强度大于1 000。自动进样系统连接1个C18预柱(5 mm×320 μm)和1个C18毛细管柱(15 cm×75 μm)。样品经预柱脱盐和浓缩后,梯度洗脱经C18毛细管柱进行肽段分离。洗脱梯度为0~4 min,5%乙腈;4~40 min,5%~50%乙腈;40~45 min,50%~90%乙腈;45~55 min,90%乙腈;55~65 min,90%~5%乙腈;体积流量为300 nL/min;分离后的肽片段直接进入离子源。1次选择3个最大强度的肽段进行MS/MS分析,同一质荷比的离子被排除采集。使用Mascot软件(Matrix Science Ltd.,UK)中的串级质谱数据搜索功能(MS/MS Ions Search)进行搜索(http://www. matrixscience.com)。数据库的搜索选择下列参数:固定修饰选择carbamoylmethylation(C),限制性切割酶选择Trypsin,允许最大漏切位点(missed cleavages)数为1,肽段的M容差(tolerance)为0.5,二级离子的M容差为0.5,结果报告数目选择auto。肽段的得分(mowse scores)超过域值(threshold)的视为可信的鉴定肽段[18]。
为了使这些分离了的蛋白质被有效地鉴定,SDS-PAGE胶带被取下,经脱色、还原烷基化后采用胰酶酶解。酶解结束后,用不同浓度的乙腈对胶带进行萃取,合并萃取液并冻干后保存于冰箱。质谱分析时,每一胶带酶解后的多肽混合物先通过Dionex的反相nano LC分离后在线进入Bruker公司的micro TOFQ II质谱分析系统进行质谱分析。获得的数据经Bruker公司的Data Analysis 4.0软件分析后输出mgf文件。将得到的mgf文件采用Mascot软件中的串级质谱数据搜索功能(MS/MS Ions Search),搜库时所选取的物种库为真菌库。
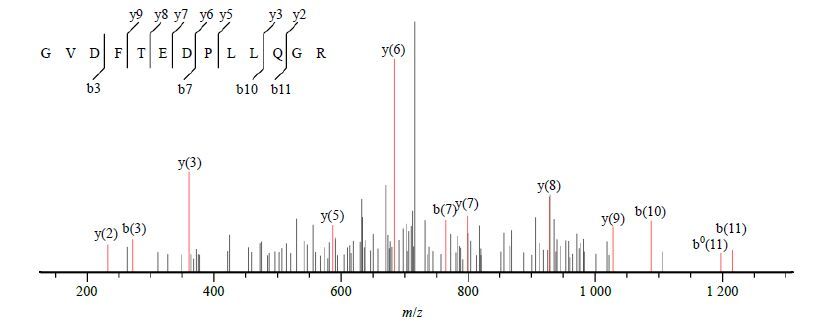
通过质谱分析和搜库鉴定,从茯苓发酵液中共鉴定了51种蛋白质(表 1),其中最多的是一些具有生物活性的酶类:过氧化氢酶、丝氨酸/苏氨酸蛋白激酶、碱性蛋白酶、糖化酶、溶菌酶、甘油醛-3-磷酸脱氢酶甘露醇脱氢酶、S-腺苷高半胱氨酸水解酶、丝氨酸羟甲基转移酶、天冬氨酸蛋白酶、透明质酸合成酶、解旋酶、ATP合成酶、DNA聚合酶、琥珀酰-CoA连接酶、转醛醇酶、吡咯啉-5-羧酸还原酶、N-末端乙酰转移酶、柠檬酸合成酶、胞嘧啶脱氨酶、线粒体金属肽链内断酶、内切核酸酶等。图 2为条带4的Mascot搜库结果,通过图谱可以知道条带4所鉴定的蛋白数量和种类。去冗余后共鉴定得到了10类蛋白质,主要有过氧化氢酶、丝氨酸羟甲基转移酶、ATP合成酶、DNA聚合酶和外膜脂蛋白等。图 3为过氧化氢酶B二级质谱图。除了上述酶类外,在茯苓发酵液中还鉴定到一些重要的蛋白质分子,如细胞壁蛋白、钙通道蛋白、外膜脂蛋白、微管蛋白折叠辅助因子和转录延伸因子等。
|
|
表 1 茯苓发酵液中蛋白质质谱鉴定结果 Table 1 MS identification of proteins from P. cocos fermentation broth |

|
图 2 条带4 Mascot 搜库结果 Fig.2 Mascot search library results of Strip 4 |
|
图 3 过氧化氢酶B 二级质谱图 Fig.3 MS/MS spectrum of catalase B |
蛋白质作为生命活动的体现者和物质基础,在生命活动过程中具有十分重要的作用。虽然茯苓使用历史悠久、研究较为广泛,但对茯苓蛋白质所知甚少。本研究首次对茯苓发酵液中蛋白质进行了初步研究,获知了茯苓发酵液中总蛋白质量浓度及组成发酵液的蛋白质种类。该研究具有重要的意义,为开展茯苓蛋白质相关研究打下了良好的基础。后续可以从已鉴定的蛋白质中筛选出一些质量浓度较高、活性较强的蛋白质分子开展结构与功能研究。另外,项目的实施有利于茯苓发酵液的成分的初步了解,对开展茯苓发酵液保健饮料的开发利用也具有良好的指导作用。
3 讨论鉴于茯苓悠久的历史及其功效,近年来对茯苓开展了广泛的研究。但茯苓研究主要集中在多糖和三萜类化合物等次生代谢产物的化学成分及其药理保健功效上,对茯苓蛋白质的研究很少。有些问题一直未弄清楚,如茯苓蛋白部分由哪些蛋白质组成、组成茯苓的各营养成分中蛋白质含量占多少、茯苓的药理保健功能是否与茯苓蛋白质有关?本课题以茯苓菌种湘靖28为实验材料,通过液体发酵培养,有机酸沉淀、考马斯亮蓝染色、SDS-PAGE分离、胶内酶解、质谱分析和搜库鉴定等方法首次对茯苓发酵液中的蛋白质进行了质谱分析与鉴定,对发酵液的总蛋白质质量浓度进行了测定。所鉴定的蛋白质大部分在蛋白库中得分较高,搜库鉴定时所选取的是茯苓所属的真菌库,因此这些鉴定结果可信度很高。
众所周知,微生物发酵液蛋白质主要是一些由菌丝体分泌的且具有生物活性的胞外酶和分泌蛋白质。这可以从实验鉴定结果得到佐证。课题组最后从茯苓发酵液中鉴定得到了51种蛋白质,大部分属于具有催化活性的酶类。其中以水解酶最多,主要有丝氨酸/苏氨酸蛋白激酶、碱性蛋白酶、糖化酶、溶菌酶、S-腺苷高半胱氨酸水解酶、天冬氨酸蛋白酶、核酸内切酶等;另外还包括甘油醛-3-磷酸脱氢酶、甘露醇脱氢酶、过氧化氢酶、吡咯啉-5-羧酸还原酶等氧化还原酶;透明质酸合成酶、ATP合成酶、琥珀酰-CoA连接酶、柠檬酸合成酶等合成酶及丝氨酸羟甲基转移酶、转醛醇酶、N-末端乙酰转移酶、胞嘧啶脱氨酶等转移酶。
现就鉴定的几种主要的酶归类并简介如下:第一类为具有保健功能的酶类,包括过氧化氢酶和溶菌酶。① 过氧化氢酶(catalase)是一类广泛存在于动植物及需氧微生物体内的末端氧化还原酶,主要功能是催化H2O2发生歧化反应生成水和氧气,清除体内的H2O2,从而使细胞免于遭受H2O2的毒害,是生物防御体系的关键酶之一[19]。它在农业、医药、食品加工、纺织、印染和环保等方面有十分重要的应用价值[19-21]。② 溶菌酶(lysozyme)是一种低相对分子质量的糖苷水解酶。这种酶可以分解微生物的细胞壁,使细菌失去细胞壁的保护并在胞内高渗透压的作用下破裂死亡,实现杀菌目的。溶菌酶作为高等有机体的组织及体液中最强大的抗菌剂之一,是生物机体对抗外源病原菌侵袭的重要防御因子。它不仅参与机体免疫,同时还有杀菌和维护机体健康的作用[22]。第二类是与代谢调控有关的酶类,包括甘油醛-3-磷酸脱氢酶、S-腺苷高半胱氨酸水解酶、丝氨酸羟甲基转移酶和甘露醇脱氢酶。① 甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)是糖酵解、糖异生和卡尔文循环途径中的关键酶,参与糖酵解过程中第1个ATP的形成,是维持生命活动能量形成的基本酶类之一[23-24]。② S-腺苷高半胱氨酸水解酶(S-adenosyl homocysteine hydrolase,AdoHcyase)是生物细胞中广泛存在的一种蛋白水解酶。其功能主要是催化细胞S-腺苷高半胱氨酸可逆水解生成腺苷和高半胱氨酸。由于该酶具有重要的细胞内甲基循环的代谢调节作用,在人类、哺乳动物、植物、真菌和原核生物中已被广泛研究[25-26]。③ 丝氨酸羟甲基转移酶(serine hydroxymethyltransferase,SHMT)是体外酶促法制备L-丝氨酸的关键酶[27]。L-丝氨酸是生糖氨基酸,由于其处于多条代谢途径,难以从生物体内直接大量分离,故具有许多重要的生理功能和作用,在化工、制药、食品、化妆品和生物农药等行业有着广泛的应用[28]。近年来,由于发现丝氨酸衍生物具有抗癌功效[29],使得其需求量日益增大,是市场上价格最昂贵的氨基酸之一。④ 甘露醇脱氢酶(mannitol dehydrogenase,MTD)是植物、细菌和动物体内合成甘露醇的关键酶。由于甘露醇具有特殊的物理和化学性质,因此在食品、医药和化工等行业有着广泛应用[30]。第三类为重要的工业用酶,主要有碱性蛋白酶和糖化酶。① 碱性蛋白酶(alkaline protease)是一类广泛存在于动植物及微生物中,在碱性条件下水解蛋白质肽键的酶类。它是一类非常重要的工业用酶,在食品、洗涤及制革等行业中有着广泛的用途[31-33]。② 糖化酶(glucoamylase)是由一系列微生物分泌的,具有外切酶活性的胞外酶。糖化酶作为生产燃料乙醇必须的生物催化剂,是世界上应用范围最广、最重要的工业酶制剂之一[34]。第四类为细胞信号分子,主要是丝氨酸/苏氨酸蛋白激酶。丝氨酸/苏氨酸蛋白激酶(serine/threonine protein kinase)是最重要的一类蛋白激酶,通过催化多种功能蛋白的磷酸化,从而调节细胞多种生命活动过程[35-37]。综上所述,茯苓发酵液中蛋白质种类丰富,所鉴定的很多酶在制药和食品等领域应用广泛,这有利于茯苓发酵液的药理研究和作为食品保健饮料的开发与利用。
后续可以开展以下工作:首先,可以对茯苓发酵液中的蛋白质进行分离纯化,选取一些含量较高、活性较强的成分进行深入系统的研究。其次,本课题对提取的茯苓蛋白质只进行了SDS-PAGE分离,后续可以在此基础上进行双向凝胶电泳实验,所鉴定的蛋白质种类可能会比现有鉴定的种类更多。最后,测定得到发酵液中蛋白质的质量浓度为74.01 μg/mL,其量较低,可以展开菌种育种的相关研究,采用一些相关的方法提高茯苓菌种产酶的能力从而提高发酵液中蛋白质的质量浓度。
| [1] | 张密霞, 李怡文, 张德生, 等. 茯苓多糖对Lewis肺癌小鼠自发肺转移的抑制作用及其机制研究[J]. 现代药物与临床 , 2013, 28 (6) :842–846. |
| [2] | 陈春霞. 羧甲基茯苓多糖的保肝与催眠作用[J]. 食用菌 , 2003 (增刊) :46–47. |
| [3] | 郑彩云. 茯苓多糖抗糖尿病作用的实验研究[J]. 中国医疗前沿 , 2010, 5 (14) :12–13. |
| [4] | 苗华, 张旭. 茯苓结合有氧运动对大鼠基于代谢组学表征的血脂紊乱相关指标的影响[J]. 中国运动医学杂志 , 2013, 32 (11) :1013–1017. |
| [5] | 李燕凌, 张志旭, 胡令. 茯苓多糖抗氧化性研究[J]. 天然产物研究与开发 , 2012, 24 (8) :1126–1128. |
| [6] | Chen X, Zhang L, Cheung P C. Immunopotentiation and anti-tumor activity of carboxymethylated-sulfated beta- (1→3)-D-glucan from Poria cocos[J]. Int Immunopharmacol , 2010, 10 (4) :398–405. |
| [7] | 程水明, 桂元, 沈思, 等. 茯苓皮三萜类物质抗氧化活性研究[J]. 食品科学 , 2011, 32 (9) :27–30. |
| [8] | 胡斌, 杨益平, 叶阳. 茯苓化学成分的研究[J]. 中草药 , 2006, 37 (5) :655–658. |
| [9] | Ríos J L. Chemical constituents and pharmacological properties of Poria cocos[J]. Planta Med , 2011, 77 (7) :681–691. |
| [10] | 闫雪生, 孙丹丹, 郭艳伟, 等. 茯苓皮总三萜液固压缩片的处方研究[J]. 中草药 , 2016, 47 (3) :407–413. |
| [11] | Chang H H, Yeh C H, Sheu F. A novel immunomodulatory protein from Poria cocos induces Toll-like receptor 4-dependent activation within mouse peritoneal macrophages[J]. J Agric Food Chem , 2009, 57 (14) :6129–6139. |
| [12] | 李洪波, 杨瑞雪, 陈静, 等. 茯苓免疫调节蛋白-I抗体的制备与分析[J]. 中草药 , 2014, 45 (20) :2912–2916. |
| [13] | 王谦, 冀宏, 丁万杰, 等. 茯苓的发酵研究及其动物免疫学观察[J]. 中国食用菌 , 2002, 21 (2) :41–42. |
| [14] | 李羿, 李晨, 杨万清, 等. 茯苓补料液体发酵工艺优化及不同来源茯苓所含成分量比较[J]. 中草药 , 2016, 47 (9) :1520–1524. |
| [15] | 庄毅. 中国药用真菌概况[J]. 中国食用菌 , 2001, 20 (2) :3–5. |
| [16] | 王兴红, 李祺德, 曹秋娥. 微生物发酵中药应成为中药研究的新内容[J]. 中草药 , 2001, 32 (3) :267–268. |
| [17] | Hellman U, Wernstedt C, Góñez J, et al. Improvement of an In-Gel digestion procedure for the micropreparation of internal protein fragments for amino acid sequencing[J]. Anal Biochem , 1995, 224 (1) :451–455. |
| [18] | Mawuenyega K G, Kaji H, Yamuchi Y, et al. Large-scale identification of Caenorhabditis elegans proteins by multidimensional liquid chromatography-tandem mass spectrometry[J]. J Proteome Res , 2003, 2 (1) :23–35. |
| [19] | 刘灵芝, 钟广蓉, 熊莲, 等. 过氧化氢酶的研究与应用新进展[J]. 化学与生物工程 , 2009, 26 (3) :15–18. |
| [20] | Schrader M, Fahimi H D. Peroxisomes and oxidative stress[J]. Biochim Biophys Acta , 2006, 1763 (12) :1755–1766. |
| [21] | Zamocky M, Furtmǜller P G, Obinger C. Evolution of catalases from bacteria to humans[J]. Antioxid Redox Signal , 2008, 10 (9) :1527–1548. |
| [22] | Rubio C A. The natural antimicrobial enzyme lysozyme is up-regulated in gastrointestinal inflammatory conditions[J]. Pathogens , 2014, 3 (1) :73–92. |
| [23] | Danshina P V, Schmalhausen E V, Avetisyan A V, et al. Mildly oxidized glyceraldehyde-3-phosphate dehydrogenase as a possible regulator of glycolysis[J]. IUBMB Life , 2001, 51 (5) :309–314. |
| [24] | 张旸, 郭海俊, 刘龙飚, 等. 星星草PtGAPDH基因的克隆与表达分析[J]. 草业学报 , 2014, 23 (2) :207–214. |
| [25] | Mull L, Ebbs M L, Bender J. A histone methylation-dependent DNA methylation pathway is uniquely impaired by deficiency in Arabidopsis S-adenosylhomocysteine hydrolase[J]. Genetics , 2006, 174 (3) :1161–1171. |
| [26] | Kawalleck P, Plesch G, Hahlbrock K, et al. Induction by fungal elicitor of S-adenosyl-L-methionine synthetase and S-adenosyl-L-homocysteine hydrolase mRNAs in cultured cells and leaves of Petroselinum crispum[J]. PNAS , 1992, 89 (10) :4713–4717. |
| [27] | Zuo Y Z, Zheng Z L, Liu Z G, et al. Cloning, DNA shuffling and expression of serine hydroxymethyl transferase gene from Escherichia coli strain AB90054[J]. Enzyme Microb Technol , 2007, 40 (4) :569–577. |
| [28] | 克丽凤, 张伟国, 钱和. L-丝氨酸的生产及其应用[J]. 江苏食品与发酵 , 2001, 105 (2) :19–22. |
| [29] | 王益民, 郭炜, 张秀凤, 等. 丝氨酸羟甲基转移酶基因C1420T多态性与食管鳞癌、贲门腺癌易感性的关系[J]. 癌症 , 2006, 25 (3) :281–286. |
| [30] | 魏倩倩. 甘露醇的生产与应用研究进展[J]. 食品工业科技 , 2010, 31 (12) :401–404. |
| [31] | 郑环宇, 邵弘, 刘燕, 等. 酶水解大豆分离蛋白制取大豆肽的应用研究[J]. 大豆通报 , 2003 (4) :25–26. |
| [32] | 夏良树. 复合酶在合成洗衣粉中的应用[J]. 中南工学院学报 , 1999, 13 (3) :33–38. |
| [33] | 刘彦, 杨志华, 张义正, 等. 碱性蛋白酶No. 8的脱毛条件研究[J]. 皮革科学与工程 , 2002, 12 (4) :15–20. |
| [34] | 王凤寰, 孟青青, 封棣, 等. 嗜热糖化酶基因在重组黑曲霉工程菌中的表达及酶学性质初步研究[J]. 生物技术通报 , 2012 (7) :119–125. |
| [35] | Alderwick L J, Molle V, Kremer L, et al. Molecular structure of EmbR, a response element of Ser/Thr kinase signaling in Mycobacterium tuberculosis[J]. PNAS , 2006, 103 (8) :2558–2563. |
| [36] | Faucher S P, Viau C, Gros P P, et al. The prpZ gene cluster encoding eukaryotic-type Ser/Thr protein kinases and phosphatases is repressed by oxidative stress and involved in Salmonella enterica serovar Typhi survival in human macrophages[J]. FEMS Microbiol Lett , 2008, 281 (2) :160–166. |
| [37] | Pereira S F, Goss L, Dworkin J. Eukaryote-like serine/threonine kinases and phosphatases in bacteria[J]. Microbiol Mol Biol Rev , 2011, 75 (1) :192–212. |
 2016, Vol. 47
2016, Vol. 47


