显脉香茶菜Isodon nervosus (Hemsl.) Kudô为唇形科香茶菜属多年生草本植物,广泛分布于河南、四川、江西及我国其他省份,民间常以茎、叶入药,用于治疗急性传染性肝炎、毒蛇咬伤、皮肤瘙痒等疾病[1]。对映贝壳杉烷二萜类成分为香茶菜属植物的主要代谢产物,具广泛的抗菌、抗炎及抗肿瘤活性[2]。许美娟等[3]、Yan等[4]及Li等[5]对不同产地的显脉香茶菜进行成分研究,结果表明由于生长环境不同,所得到的次生代谢产物有明显差异。本课题组对江西宜丰地区产显脉香茶菜进行了化学成分研究,前期从中分离得到多种二萜类成分[6-13],本实验从显脉香茶菜中分离得到的1个新的二萜类化合物,结构鉴定为15α,20β/α-二羟基-6β-甲氧基-6,7-断裂-6,20-环氧-1α,7-内酯-对映-贝壳杉-16-烯(15α,20β/α-dihydroxy-6β-methoxy-6,7-seco-6,20-epoxy-1α,7-olide-ent-kaur-16-ene,1),命名为显脉香茶菜素K。结构见图 1。
1 仪器与材料XT-4A显微熔点测定仪(北京泰克仪器有限公司),Perkin Eimer 341 polarimeter旋光仪[珀金埃尔默仪器(上海)有限公司],EQUINOXTM55-A590/ 3F型红外分光光度计(德国Bruker公司),Bruker AVANCE-400超导核磁共振仪(瑞士Bruker公司);柱色谱硅胶和薄层色谱用硅胶(青岛海浪化工厂);Pharmadex LH-20(安玛西亚生物技术上海有限公司);化学试剂均为分析纯。
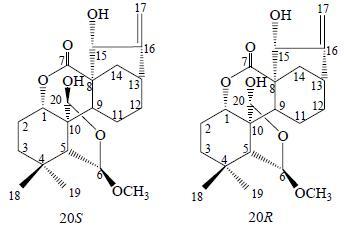
|
图 1 化合物1的结构 Fig.1 Structure of compound 1 |
显脉香茶菜药材于2007年7月采自江西宜丰地区,经江西中医药大学赖学文教授鉴定为显脉香茶菜Isodon nervosus (Hemsl.) Kudô。
2 提取与分离干燥的显脉香茶菜茎和叶10 kg,以95%乙醇回流提取3次,每次2 h,合并提取液,并减压浓缩至稠膏,用甲醇溶解,滤除不溶物,滤液加4%的活性炭加热煮沸脱色3次,抽滤,滤液浓缩为浸膏(800 g)。与硅藻土1∶1拌样,置改良索氏提取器分为石油醚(50 g)、醋酸乙酯(270 g)、丙酮(200 g)、甲醇(230 g)4个部位。醋酸乙酯部分(150 g)经硅胶柱色谱,以三氯甲烷-甲醇(50︰1→10︰1)梯度洗脱,分为6个流分。流分6(10︰1部分)以三氯甲烷-丙酮(20︰1→3︰1)梯度洗脱,12∶1部分经过Sephadex LH-20柱,以三氯甲烷-甲醇(1∶1)洗脱得到化合物1。
3 结构鉴定化合物1:无色针状结晶(丙酮-甲醇),mp 218~220 ℃,[α]20D−143.3°(c 0.13,CH3OH),易溶于醋酸乙酯、三氯甲烷、丙酮及甲醇。IR光谱中,3 373 cm−1吸收峰提示可能含-OH。薄层色谱及液相色谱(PDA检测器)均显示其为单一成分,但以氘代吡啶为溶剂测定一维核磁数据时,其1H-NMR和13C-NMR、DEPT均出现2套可清晰辨认的信号,一大一小,比例约为4∶1(通过1H-NMR基准氢的积分面积判断)。
对比例较大的成分数据进行分析,发现其13C-NMR (DEPT) 谱中出现21个碳信号,包括3个甲基(含1个甲氧基),6个亚甲基(含1个双键烯碳亚甲基),7个次甲基(含4个连氧取代次甲基)和5个季碳(含1个内酯羰基季碳,1个含烯键季碳),且根据香茶菜属中分离得到的二萜类成分可以判断其为对映-6,7-断裂-贝壳杉烷二萜中的延命素型骨架[13-14]。1H-NMR中δH3.30 (3H,s) 提示结构含有甲氧基取代,而δH5.43 (1H,m)、5.18 (1H,m) 为明显环外末端双键H2-17信号;结合紫外254、365 nm下无吸收,提示母核不含α-亚甲基环戊酮共轭结构,故C-15亦被含氧基团取代;该骨架中的H2-20信号一般出现在低场区 (δH 3.6~5.0,d,J ≈ 9.0 Hz),但该特征氢信号消失,表明其C-20被含氧基团取代。
对比例较小的成分数据进行分析,发现其13C-NMR (DEPT) 谱中同样出现21个碳信号,且类型与比例较大的成分完全一样,化学位移非常接近;1H-NMR同样出现甲氧基信号3.26 (3H,s),同样未出现特征的H2-20信号。
结合文献报道[15],推测当C-20被连氧基团取代后,C-20成为手性碳原子,此时可能出现构型异构现象,结构可以是C-20R或C-20S,故推测化合物为C-20差向异构体二萜,对其进行其他测试。
结合1H-NMR和13C-NMR、DEPT推断分子式为C21H30O6,并通过HR-ESI-MS验证([M+Na]+,C21H30O6Na+,实验值401.192 0,计算值401.194 0),不饱和度为7。结合延命素型基本骨架分析,结构中含有2个羟基及1个甲氧基取代,连接位置可能为C-6、C-15及C-20。通过1H-NMR及HSQC中较好辨认的H-6α (20S/20R,δH 4.77/5.26,s) 确定C-6 (20S/20R,δC 105.2/108.6)。而在HMBC(图 2)中,甲氧基信号 (20S/20R,δH 3.30/3.26) 分别与C-6 (20S/20R) 相关表明甲氧基连接在C-6;此外,H-15 (20S/20R,δH 5.64/5.54 brs) 与C-7 (20S/20R,δC 176.1/176.7),C-9 (20S/20R,δC 32.2/37.7),C-17 (20S/20R,δC 108.9/108.5) 相关;且H-20 (20S/20R,δH 6.06/6.42) 与C-6、C-9相关,表明C-15、20均为羟基取代。
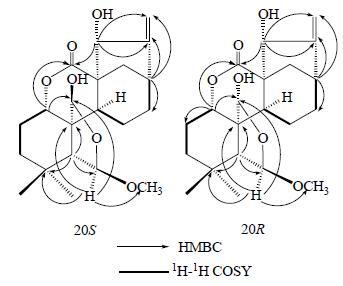
|
图 2 化合物1的重要1H-1H COSY和HMBC相关关系 Fig.2 Key 1H-1H COSY and HMBC correlation of compound 1 |
根据文献报道[15],C-20的构型可通过ROESY谱来阐明,即H-20与19-CH3有ROESY偶合,C-20为S型(即20β-OH);如果H-20与H-9α有ROESY偶合,C-20为R型(即20α-OH)。ROESY图谱(图 3)中,δH 6.06 (1H,d,J = 10.4 Hz,H-20) 与δH 0.98 (3H,s,19-CH3) 相关;同时另一个δH6.42 (1H,d,J = 4.5 Hz,H-20) 与δH3.01 (1H,dd,J = 5.5,13.1 Hz,H-9α) 相关,这证实了该化合物为一对C-20异构的对映体,且其中比例较大的为C-20S (20β-OH),较小的为C-20R (20α-OH)。
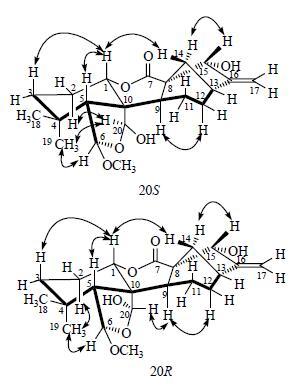
|
图 3 化合物1的主要ROESY相关图 Fig.3 Key ROESY correlation of compound 1 |
根据ROESY谱,H-15 (20S/20R,δH 5.64/5.54) 与H-14β (20S/20R,δH 2.02/2.09) 相关且与H-9α无相关,这表明C-15为α羟基取代;结合1D和2D图谱对该化合物的氢碳信号进行全归属(表 1)。
|
|
表 1 化合物1的氢谱及碳谱数据 (400/100 MHz,C5D5N) Table 1 1H-NMR and 13C-NMR data of compound 1 (400/100 MHz,C5D5N) |
为进一步了解在不同氘代试剂中的2个对映体的比例,将样品溶于CDCl3,测定1H-NMR,结果发现C-20S占绝对优势(约为95%),C-20R信号因几近消失而无法识别出;将样品回收后以氘代吡啶为溶剂,测定1H-NMR,结果发现C-20S/C-20R仍以4∶1比例存在,故认为在氘代吡啶中该化合物中一定量的C-20S转化为C-20R,并最终以稳定比例(约4∶1)存在于溶剂中。
因此该化合物鉴定为15α,20β/α-二羟基-6β-甲氧基-6,7-断裂-6,20-环氧-1α,7-内酯-对映-贝壳杉-16-烯,为1个新的差向异构体二萜,命名为显脉香茶菜素K。
| [1] | 江苏新医学院. 中药大辞典[M]. 上海: 上海科学技术出版社, 2004 . |
| [2] | Sun H D, Huang S X, Han Q B. Diterpenoids from Isodon species and their biological activities[J]. Nat Prod Rep , 2006, 23 (5) :673–698. |
| [3] | 许美娟, 程培元. 显脉香茶菜化学成分研究[J]. 植物学报 , 1993, 35 (2) :161–164. |
| [4] | Yan F L, Guo L Q, Zhang J X, et al. New ent-kaurane-type diterpenoids from Isodon nervosus[J]. Chin Chem Lett , 2008, 19 (4) :441–443. |
| [5] | Li L M, Li G Y, Ding L S, et al. ent-Kaurane diterpenoids from Isodon nervosus[J]. Nat Prod , 2008, 71 (4) :684–688. |
| [6] | 高幼衡, 吴顺华, 钟瑞健, 等. 显脉香茶菜化学成分的研究[J]. 中草药 , 1996, 27 (10) :579–580. |
| [7] | 高幼衡, 程怡, 吴顺华, 等. 显脉香茶菜化学成分的研究[J]. 中草药 , 1999, 30 (6) :407–409. |
| [8] | 高幼衡, 程怡, 叶会呈. 显脉香茶菜化学成分的研究[J]. 中草药 , 2000, 31 (9) :645–646. |
| [9] | 魏志雄, 高幼衡, 候媛芳, 等. 显脉香茶菜化学成分研究Ⅲ[J]. 中药新药与临床药理 , 2011, 22 (1) :76–78. |
| [10] | Wei Z X, Gao Y H, Yang F, et al. Three new diterpeniods from Isodon nervosus[J]. Helv Chim Acta , 2011, 94 (7) :1320–1325. |
| [11] | 魏志雄, 倪林, 候媛芳, 等. 显脉香茶菜化学成分的研究(V)[J]. 广州中医药大学学报 , 2011, 28 (5) :516–518. |
| [12] | 魏志雄, 高幼衡, 卢海啸, 等. 显脉香茶菜中二萜类成分研究[J]. 中草药 , 2012, 43 (2) :247–250. |
| [13] | Gao Y H, Wei Z X, Cheng Y, et al. Cytotoxic ent-Kaurane diterpenoids from Isodon nervosus[J]. Chem Biodiver , 2013, 10 (8) :1487–1493. |
| [14] | Yan F L, Guo L Q, Bai S P, et al. Two new diterpenoids and other constituents from Isodon nervosus[J]. Chin Chem Soc , 2008, 55 (4) :933–936. |
| [15] | Sun H D, Qiu S X, Lobkovsky E B, et al. Crystal and molecular structures of a natural equimolecular mixture of two epimeric diterpenes[J]. Tetrehedron , 2001, 57 (1) :65–70. |
 2016, Vol. 47
2016, Vol. 47


