乳香属Boswellia Roxb. ex Colebr.植物为橄榄科(Burseraceae)无刺的灌木或中小型乔木,外树皮纸片状,常卷起或剥落,多数可在树皮及树干切口中渗出坚硬的胶状树脂,广义上均可称药乳香。乳香原植物大多分布于印度和红海沿岸的索马里和埃塞俄比亚,包含了多个药用品种[1],其中以卡氏乳香树Boswellia carterii Birdw.和齿叶乳香树Boswellia serrata Roxb较为常见。乳香性温,味辛、苦,归心、肝、脾经,具有辛散温通、调气活血定痛、追毒、消肿生肌之功效,主治气血凝滞、心腹疼痛、痈疮、跌打损伤、痛经和产后瘀血等症,临床上广泛应用于治疗风湿、类风湿性关节炎和骨关节炎等疾病[2]。现代研究表明,乳香中主要效应成分为三萜类成分[3],其中具有五环三萜结构的乳香酸类成分研究较为深入,国内外专家学者多针对其抗炎、抗肿瘤活性及其分子机制进行研究[4]。本文在前期研究基础上[5-6],针对乳香属药用植物中乳香酸类资源性化学成分的化学结构、提取制备方法、生物活性及作用机制等方面进行归纳分析,为该类资源性化学成分的深入研究及产业化开发提供科学依据。
1 乳香酸类成分化学结构与资源分布 1.1 乳香酸类成分化学结构乳香中最具特征性、研究最为深入的成分为乳香酸类成分,属于五环三萜类化合物。迄今,从乳香中已分得的乳香酸类成分,按其母核结构将其分为熊果烷型、齐墩果烷型。其中熊果烷型主要有β-乳香酸(β-boswellic acid,1)[7]、乙酰基-β-乳香酸(acetyl-β-boswellic acid,2)[5]、3-乙酰基-11-羰基-β-乳香酸(3-acetyl-11-carbonyl-β-boswellic acid,3)[5]、11-羰基-β-乳香酸(11-carbonyl-β-boswellic acid,4)[6]、乙酰基-11-羟基-β-乳香酸(acetyl-11-hydroxy-β-boswellic acid,5)[8]、乙酰基-11α-甲氧基-β-乳香酸(acetyl-11-alpha-methoxy-β-boswellic acid,6)[9]、9, 11-去氢-β-乳香酸(9, 11-dehydrogenase-β-boswellic acid,7)[10]、3α-乙酰基-9, 11-去氢-β-乳香酸(3α-acetyl-9, 11-dehydrogenase-β-boswellic acid,8)[11];齐墩果烷型主要有α-乳香酸(α-boswellic acid,9)[5]、乙酰基-α-乳香酸(acetyl-α-boswellic acid,10)[8]、9, 11-脱氢-α-乳香酸(9, 11-dehydrogenase-α-boswellic acid,11)[12]、3-乙酰基-9, 11-去氢-α-乳香酸(3-acetyl-9, 11-dehydrogenase-α-boswellic acid,12)[12]。母核结构见图 1,取代基见表 1。
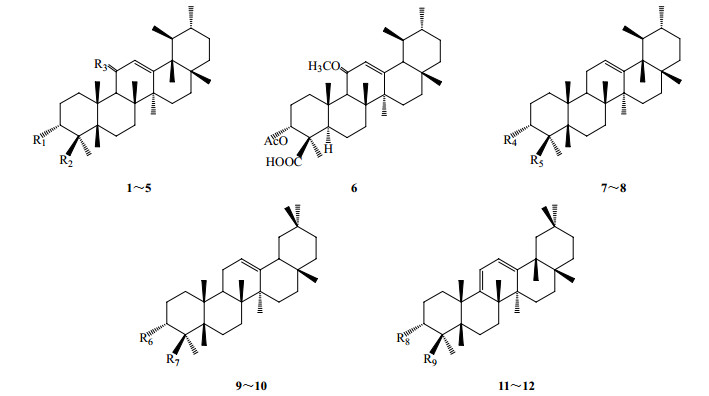
|
图 1 乳香中主要乳香酸类成分的母核结构 Fig.1 Main structures of parent nucleus of boswellic acids in frankincense |
|
|
表 1 乳香酸类成分在乳香属药用植物中的分布 Table 1 Distribution of boswellic acids in medicinal plants of Boswellia Roxb. ex Colebr. |
1.2 乳香酸类成分在乳香属药用植物中的分布
现药用乳香多取自于卡氏乳香树和齿叶乳香树所生产的树脂,而乳香酸类成分在不同品种的乳香树中的分布有所差异。见表 1。
2 乳香酸类成分的提取制备研究 2.1 溶剂浸渍法提取乳香酸类成分李洁等[13]以乳香中乳香酸类化合物的量>50%为指标,确定了乳香酸类化合物的制备工艺:乳香药材适量,依次用6倍量95%乙醇和4倍量95%乙醇,分别浸渍提取24 h,合并2次提取液,减压浓缩至相对密度为1.10左右(60℃)的浸膏,将浸膏加l%氢氧化钠溶液,调pH值至10~12,滤过,取滤液,加5%盐酸溶液,调pH值至2.0以下,析出沉淀,水洗至中性,60℃减压干燥,粉碎,即得。化学成分研究表明:此提取物中主要含有α-乳香酸、β-乳香酸、乙酰氧基-α-乳香酸、乙酰氧基-β-乳香酸、11-羰基-β-乙酰氧基乳香酸、11α-羟基-β-乙酰氧基乳香酸、11-羰基-β-乳香酸。
2.2 溶剂超声法提取乳香酸类成分常允平等[14]根据乳香酸类化合物的性质及常用的提取方法,考察了超声提取、回流提取、提取溶剂(甲醇、无水乙醇、丙酮及醋酸乙酯)及提取时间(20、30、40 min)等因素。结果表明,甲醇作为提取溶剂,超声提取30 min即可完全提取乳香中11-羰基-β-乙酰乳香酸和α-乙酰乳香酸、β-乙酰乳香酸3种代表性成分。
2.3 溶剂回流法提取乳香酸类成分郭辉等[15]取乳香药材2 kg,加乙醇回流1.5 h,滤过,滤液常压浓缩至无醇味,用氢氧化钠溶液调节pH值至9~10,滤过,取滤液用盐酸调节pH值至3~4;抽滤,将沉淀洗涤至中性,烘干,得到200 g浸膏。对浸膏的化学成分进行研究,发现其主要含有α-乳香酸、β-乳香酸、β-乙酰乳香酸、11-羰基-β-乙酰乳香酸。
2.4 乳香酸类成分的分离纯化方法王峰等[10]采用硅胶柱色谱对乳香树脂的三氯甲烷提取物进行分离,以石油醚-醋酸乙酯梯度洗脱,将各个梯度所得洗脱液合并浓缩,再经反复硅胶、Sephadex LH-20及反相ODS柱色谱分离,并重结晶得到9个乳香酸类化合物,分别为β-乳香酸、乙酰基-11α-甲氧基-β-乳香酸、11-羰基-β-乳香酸、乙酰基-11-羰基-β-乳香酸、9, 11-去氢-β-乳香酸、乙酰基-α-乳香酸、乙酰基-β-乳香酸、α-乳香酸、9, 11-去氢-α-乳香酸。周金云等[7]用硅胶柱色谱对乳香树脂的醋酸乙酯提取物进行分离,以三氯甲烷-甲醇梯度洗脱,再经反复硅胶及高效液相反相柱半制备分离,并重结晶得到5个乳香酸类化合物,分别为乙酰基-α-乳香酸、乙酰基-β-乳香酸、α-乳香酸、β-乳香酸、乙酰基-11-羰基-β-乳香酸。
3 生物活性及其作用机制研究 3.1 抗炎活性及其作用机制刘绍军等[16]报道乳香酸类化合物在降低水肿,治疗急慢性关节炎、风湿性关节炎、胶原性结肠炎、哮喘、克罗恩病以及抑制免疫系统方面均表现出显著的抗炎活性。研究表明,乳香酸的抗炎活性具有起效浓度低、毒副作用小、抗炎作用广泛等特点。研究发现,给小鼠耳缘iv 1μg的乳香酸类化合物,能有效抑制由12-O-十四烷酰佛波醇-13-乙酸酯(TPA)诱导的炎症,当给药剂量达到半数抑制剂量(IC50)时,表现出显著的抗炎活性[17]。郭辉等[15]采用正常豚鼠和过敏性豚鼠的哮喘模型,以豚鼠引喘潜伏期和抽搐跌倒潜伏期为指标,对主要含乳香酸类化合物的提取物进行抗哮喘药效学活性评价。结果表明,提取物对正常豚鼠模型和过敏性豚鼠哮喘模型均具有显著的平喘作用。
3.1.1 抑制5-脂氧合酶活性炎症的严重程度受炎性介质的影响,其中一种重要的炎性介质是白三烯B4,它是花生四烯酸在5-脂氧合酶作用下生成的,而白三烯对嗜中性粒细胞、单核细胞和嗜酸粒细胞具有很强的趋化作用,使白细胞聚集于炎症部位,从而加剧炎症。同时它也能增强血管通透性,加剧水肿。而乳香酸类化合物中的乙酰基-11-羰基-β-乳香酸选择性地在五环三萜烯的结合位点上,直接作用于人体血液白细胞的5-脂氧合酶,使5-脂氧合酶的活性受抑制,而该化合物的官能团对5-脂氧合酶的活性至关重要[18]。
3.1.2 抑制炎症相关的细胞信号传导通路细胞信号通路的异常和人类疾病密切相关,信号传导过程中的蛋白激酶对疾病的治疗则起到关键性的作用,真核细胞的丝裂原活化蛋白激酶(mitogen activated-protein kinase,MAPK)通过各自所介导的信号通路来传递信号以影响基因表达,产生一系列的细胞应答功能。p38-MAPK激酶是MAPK中的一种酶,与炎症缺血/再灌注损伤等生理病理过程密切相关。大量研究表明,p38-MAPK激酶及其介导的p38信号通路在诱导促炎因子产生的过程中起着关键作用,抑制p38-MAPK激酶活性不仅可以减少促炎因子的产生,还能促进抗炎因子的产生,使炎症反应减轻。研究发现,乳香酸对p38-MAPK激酶有显著抑制作用[19-20]。
3.2 抗肿瘤活性及其作用机制乳香树脂中乳香酸类化合物对肿瘤细胞有抗增殖、分化诱导和细胞凋亡等作用,在预防癌症发生的过程中,可能具有更加良好的临床价值。特别是其中的乙酰乳香酸毒性低,是一个有前景的抗肿瘤药物和肿瘤转移抑制剂。
3.2.1 抗增殖作用Wang等[21]观察乙酰基-11-羰基-β-乳香酸对小鼠肠道内息肉肠杆菌引起的肠道肿瘤产生的作用效果,结果显示乙酰基-11-羰基-β-乳香酸能够减少小鼠肠道内息肉肠杆菌的数量,降低肿瘤细胞异型生长的概率,具有潜在的预防肠道肿瘤的作用。研究表明,α-乳香酸具有体外抑制DNA、RNA和蛋白质的作用,并且呈剂量依赖性,说明α-乳香酸具有抗细胞增殖的作用。吴丽琼等[22]培养人口腔鳞癌细胞系Tca8113,用不同浓度的乳香酸对Tca8113细胞进行24、48、72 h处理。结果发现乳香酸能抑制Tca8113细胞增殖,呈现出一定的浓度和时间依赖关系,并能促使Tca8113细胞凋亡,呈现一定的浓度依赖性。
3.2.2 分化诱导作用赵万州[23]研究表明乙酰乳香酸可诱导人白血病细胞HL60、小鼠黑色素瘤细胞B16F10和人黑色素瘤细胞MV-3的分化,使细胞形态发生变化,运动能力减弱,细胞黑色素量增加。
3.2.3 诱导细胞凋亡作用孟艳秋等[24]以乳香提取物3-乙酰基-11-羰基-β-乳香酸(AKBA)为先导化合物,保留母体结构中的五环三萜骨架及11位羰基,将其合成3位羟基取代和3位烷基取代的化合物,采用吖啶橙(acridine orange,AO)和溴化乙啶(ethidium bromide,EB)双染色法,测定目标化合物对人急性早幼粒白血病细胞(NB4)的凋亡活性;采用MTT检测法测定目标化合物对NB4细胞的细胞毒性。实验结果显示,3位羟基取代的乳香酸化合物具有较强的诱导NB4细胞凋亡活性;而3位烷基取代的乳香酸化合物则具有较强的细胞毒活性。
3.2.4 抑制肿瘤相关的信号传导通路研究发现AKBA可以通过抑制雷帕霉素靶蛋白信号通路和血管内皮生长因子受体2,抑制血管内皮细胞的扩散、增殖以及毛细血管状结构的生成,从而防止生成新生血管,减少肿瘤细胞的营养供应,抑制前列腺癌细胞生长。并且发现AKBA能抑制人多发性骨髓瘤细胞中信号传导和转录活化因子(STAT)-3的信号通路,可逆性阻断白细胞介素-6(IL-6)诱导的STAT-3的活化,从而可导致与细胞增殖(cyclin D)、细胞存活(Bcl-xL、Mcl-1)以及血管生成[血管内皮生长因子(VEGF)]等有关的基因表达降低。谢纪珍等[25]研究表明,AKBA抑制Wnt/β-catenin信号通路后,与癌细胞浸润和转移相关的MMP-2和MMP-7表达都明显降低,从而抑制癌细胞的扩散。
3.2.5 诱导细胞凋亡作用赵万洲[23]采用RT-PCR法研究了乙酰乳香酸作用于T24细胞凋亡过程中Fas、TNF、TRAIL受体的mRNA表达情况。研究显示,此过程中,Fas mRNA的表达明显升高,说明Fas在乙酰乳香酸诱导的T24膀胱癌细胞凋亡中发挥重要的作用。同时还发现BC-4诱导膀胱癌细胞凋亡的过程中可能有P21/WF1的参与。BC-4作用于T24细胞6 h后,P21/WF1的表达显著升高,抗凋亡蛋白Bcl-2的表达随BC-4作用时间的延长明显降低。Takada等[26]发现AKBA能促进肿瘤坏死因子(TNF)诱导的细胞凋亡,使核因子-κB(NF-κB)活化和NF-κB调节基因的表达减弱,阻止破骨细胞的生成。有报道显示,AKBA通过连续抑制TNF诱导的IκBα激酶的活化、磷酸化、泛素化和降解以及p65的磷酸化和核易位,影响NF-κB与DNA的结合,从而影响基因表达,导致细胞凋亡。何蕊伶等[27]研究发现11-羰基-β-乳香酸能够阻断体外结肠癌HCT-116细胞周期,诱导细胞凋亡,起到较强的抗癌作用。抗肿瘤作用机制见图 2。
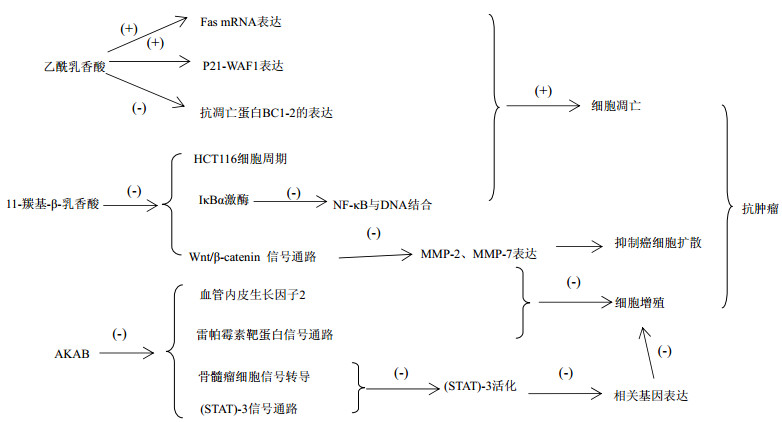
|
图 2 抗肿瘤作用机制 Fig.2 Mechanism of antitumor activity |
3.3 抗溃疡作用及其作用机制
柏景坪等[18]采用氢氧化钠晶体化学烧灼法以建立大鼠口腔溃疡的动物模型,将其分为乳香酸治疗组、溃疡散阳性对照组和空白阴性对照组,观察乳香酸对实验性口腔溃疡的治疗效果,并检测溃疡组织超氧化物歧化酶(SOD)、丙二醛(MDA)水平的变化,结果显示乳香酸组的溃疡平均愈合速度明显高于空白阴性对照组,且乳香酸在降低溃疡组织MDA水平和提高SOD活性方面优于溃疡散。结果说明乳香酸能减轻溃疡的充血和水肿,促进实验性口腔溃疡的愈合。
TNF-α和IL-6这2种炎症介质是导致口腔溃疡形成的主要炎症细胞因子,其量的高低与病情的轻重息息相关,即溃疡面积越大,TNF-α和IL-6量越高[28]。柏景坪等[16]研究结果显示乳香酸能减弱TNF-α和IL-6的表达能力,防止溃疡加剧。研究表明,AKBA能抑制明胶酶基质金属蛋白酶-1(MMP-1)、MMP-2和MMP-9的活性,从而抑制MMPs的分泌以治疗慢性溃疡[29]。
3.4 改善记忆作用乳香酸类化合物中的β-乳香酸能促使海马神经元突触生长并产生分枝,显著促进神经轴突的生长、分枝及微管蛋白聚合动力学,从而改善记忆力。Mahmoudi等[30]研究表明乳香酸类化合物能延长雄性大鼠的空间记忆能力。
4 乳香酸类成分的代谢转化研究 4.1 体内代谢转化研究夏媛媛[31]按照15 mg/kg的剂量给Wistar大鼠iv AKBA后,血浆中AKBA的浓度迅速下降,符合二房室模型,相同剂量下ig给药的AUC0-t与iv相比,生物利用度为21.4%,说明AKBA口服给药的吸收程度比较弱。由于AKBA脂溶性高水溶性差,因此可以考虑将其做成纳米脂质体来提高生物利用度。同时,研究发现在给大鼠ig AKBA后,肝、卵巢、肾、睾丸、脂肪、心、脾、脑、血浆、胃、子宫、肺、肌肉、肠等组织中均含有AKBA;ig 3 h后所有组织中AKBA浓度达到最高,随后分布量逐渐减少,12 h时除脑组织和睾丸组织外的分布量均为1 h峰值的1/10~1/40,说明给大鼠ig AKBA后,在组织中未见到明显的蓄积现象。
蔡悠悠等[32]给大鼠ig AKBA的混悬液2 h后,血浆、肝脏、尿液及脑组织中均未检测到代谢产物,在胆汁和粪便中检测到AKBA的15个代谢产物,其中I相代谢产物6个,主要为去乙酰化、羟基化及羟基氧化、酮基化产物,主要存在于粪便中;II相代谢产物9个,主要为葡萄糖醛酸结合物,主要存在于胆汁中。AKBA及其I相代谢产物在大鼠肝脏中与葡萄糖醛酸结合后,随胆汁排泄进入肠道,在肠道中又水解脱去葡萄糖醛酸,故在胆汁中检测到的主要为II相代谢产物,在粪便中检测到的代谢产物均为I相代谢产物。由于AKBA的跨膜吸收能力较弱[33],口服生物利用度低[34],在肠道原型药物及水解产生的I相代谢产物的重吸收比例均较低,并且吸收后又经历了肝肠循环,因此AKBA主要以I相代谢形式经粪便排泄。AKBA的体内代谢途径见图 3。
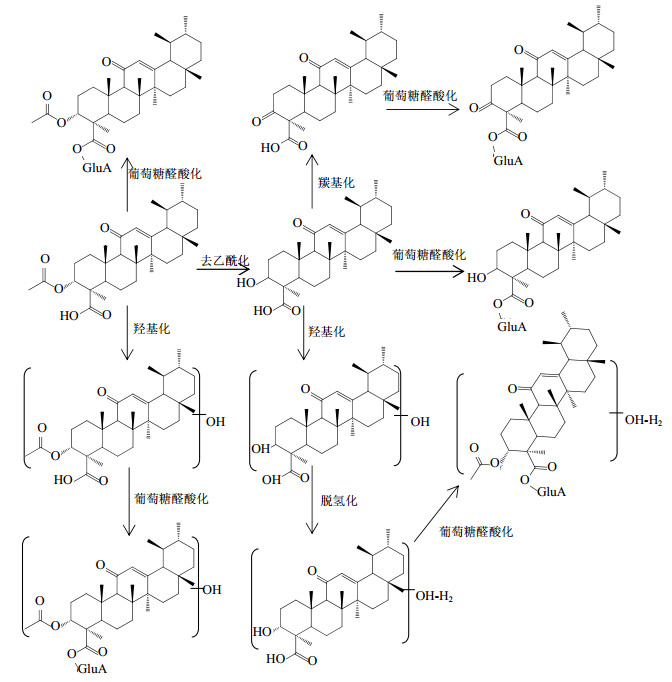
|
图 3 AKBA的体内代谢途径及代谢物 Fig.3 Metabolic pathways and metabolites of AKBA in vivo |
4.2 肝微粒体代谢转化研究
研究[35]显示,β-乳香酸在人肝微粒体(HLM)和大鼠肝微粒体(RLM)出现大量的I相代谢产物,α-乳香酸仅仅在HLM出现大量的I相代谢产物,α-乳香酸与β-乳香酸在HLM和RLM均未出现II相代谢产物。
5 结语乳香作为一种传统中药,含有丰富的乳香酸类化学成分,且具有显著的抗炎、抗菌、抗肿瘤等较为广泛的药理作用。目前,国内外对乳香属药用植物资源的生物活性研究已从有效部位研究阶段深入到单体化学成分研究,为阐明乳香生物活性物质基础及相关的作用机制奠定了基础。乳香酸类成分是其主要活性成分,也是目前研究的热点问题,其作用机制得到了一定的阐明。但基于乳香传统功效及功能主治的功效物质基础与作用机制的研究尚不够深入和细致,值得进一步研究和开发,其应用价值和开发前景较为广泛。同时,为其在临床的安全、有效用药提供科学支撑。
| [1] | 蒋永和, 覃文红. 乳香属植物化学成分的研究进展[J]. 医药前沿, 2012 (20) :324–327. |
| [2] | 常允平, 韩英梅, 张俊艳, 等. 乳香的化学成分和药理活性研究进展[J]. 现代药物与临床, 2012,27 (1) :52–58. |
| [3] | Norihiro B, Toshihiro A, Ken Y, et al. Anti-inflammatory activities of the triterpene acids from the resin of Boswellia carteri[J]. J Ethnopharmacol, 2006, 107 (2) :249–253 . |
| [4] | 张玉柱.中药乳香的化学成分及生物活性研究[D].上海:东华大学, 2014. |
| [5] | 蒋海峰, 欧阳臻, 宿树兰, 等. 基于主成分分析和相似度分析的乳香药材质量评价研究[J]. 中药材, 2011,34 (6) :904–911. |
| [6] | 宿树兰, 王团结, 段金廒. 常用树脂类药材资源分布、化学成分及药理活性研究进展[J]. 国际药学研究杂志, 2009 (2) :109–114. |
| [7] | 周金云, 崔锐. 乳香的化学成分[J]. 药学学报, 2002,37 (8) :633–635. |
| [8] | Schweizer S, Brocke A F W, Boden S E, et al. Workup-dependent formation of 5-lipoxygenase inhibitory boswellic acid analogues[J]. J Nat Prod, 2000, 63 (8) :1058–1061 . |
| [9] | Norihiro B, Toshihiro A, Ken K, et al. Anti-inflammatory activities of the triterpene acids from the resin of Boswelli carteri[J]. J Ethnopharmacol, 2006, 107 (2) :249–253 . |
| [10] | 王峰, 华会明, 王淑美. 乳香的化学成分[J]. 中草药, 2011,42 (7) :1293–1296. |
| [11] | Klaus B, Berthold B, Udo W, et al. Structural analysis of pentacyclic triterpenes from the gum resin of Boswellia serrata by NMR spectroscopy[J]. Magn Reson Chem, 2003, 41 (2) :115–122 . |
| [12] | Büchele B, Zugmaie W, Simmet T. Analysis of pentacyclic triterpenic acids from frankincense gum resins and related phytopharmaceuticals by high-performance liquid chromatography. Identification of lupeolic acid, a novel pentacyclic triterpene[J]. J Chromatogr B, 2003, 791 (1/2) :21–30 . |
| [13] | 李洁.乳香提取物制备工艺及质量控制研究[D].济南:山东大学, 2013. |
| [14] | 常允平, 夏广萍, 韩英梅, 等. HPLC法测定乳香中乙酰乳香酸类成分的含量[J]. 中医药学报, 2012,40 (5) :15–18. |
| [15] | 郭辉, 张玲, 尚立霞, 等. 乳香抗哮喘有效部位化学成分的研究[J]. 中草药, 2007,38 (7) :983–985. |
| [16] | 刘绍军, 刘丽娜. 3-乙酰基-11-羰基-乳香酸的抗炎作用及其衍生物的化学修饰[J]. 中国当代医药, 2011,18 (16) :16–17. |
| [17] | Norihiro B, Toshihiro A, Ken Y, et al. Anti-inflammatory activities of the triterpene acids from the resin of Boswellia carteri[J]. J Ethnopharmacol, 2006, 107 (2) :249–253 . |
| [18] | 柏景坪, 王红健, 蓝爱, 等. 乳香酸治疗口腔溃疡的动物实验研究[J]. 北京口腔医学, 2012,20 (6) :318–321. |
| [19] | Altmann A, Fischer L, Schubert-Zsilavecz M, et al. Boswellic acids activate p42 (MAPK) and p38 MAPK and stimulate Ca2+ mobilization[J]. Biochem Biophys Res Commun, 2002, 290 (1) :185–190 . |
| [20] | Poeckel D, Tausch L, George S, et al. 3-O-Acetyl-11-keto-boswellic acid decreases basal intracellular Ca2+ levels and inhibits agonist-induced Ca2+ mobilization and mitogen-activated protein kinase activation in human monocytic cells[J]. J Pharmacol Exp Ther, 2006, 316 (1) :224–232 . |
| [21] | Wang R, Wang Y, Gao Z, et al. The comparative study of acetyl-11-keto-beta-boswellic acid (AKBA) and aspirin in the prevention of intestinal adenomatous polyposis in APC (Min/+) mice[J]. Med Nat Institutes Health, 2014, 8 (1) :25–32 . |
| [22] | 吴丽琼, 张辛燕, 孙正, 等. 姜黄素和乳香酸对口腔鳞癌细胞系Tca8113抑制作用的研究[J]. 北京口腔医学, 2011,19 (4) :181–185. |
| [23] | 赵万洲.乙酰乳香酸抗肿瘤作用的分子机制及黑色素瘤细胞基本生物学特性的研究[D].北京:中国协和医科大学, 2001. |
| [24] | 孟艳秋, 赵临襄, 王趱, 等. 乳香酸类似物的合成及其抗肿瘤活性研究[J]. 中国药物化学杂志, 2005,15 (1) :16–21. |
| [25] | 谢纪珍.乙酰基-11-酮基-P-乳香酸通过对Wnt/β-catenin信号的调控机制抑制人胃癌细胞生长作用研究[D].济南:山东大学, 2012. |
| [26] | Takada Y, Ichikawa H, Badmaev V, et al. Acetyl-11-keto-beta-boswellic acid potentiates apoptosis, inhibits invasion, and abolishes osteoclastogenesis by suppressing NF-{kappa}B and NF-{kappa}B-regulated gene expression[J]. J Immunol, 2006, 176 (5) :3127–3140 . |
| [27] | 何蕊伶, 张娟娟, 缪世坤, 等. 11-羰基-β-乳香酸在体外对人结肠癌抑制作用的研究[J]. 中药药理与临床, 2010,26 (2) :19–21. |
| [28] | Pang X F, Yi Z F, Zhang X L, et al. Acetyl-11-keto-β-boswellic acid inhibits prostate tumor growth by suppressing vascular endothelial growth factor receptor 2-mediated angiogenesis[J]. Cancer Res, 2009, 69 (14) :5893–5900 . |
| [29] | Liang Y H, Li P, Huang Q F, et al. Acetyl-11-keto-beta-boswellic acid regulates the activities of matrix metalloproteinases-1, -2, -9[J]. Chin J Pathophysiol, 2009, 25 (10) :2004–2011 . |
| [30] | Mahmoudi A, Hosseini-Sharifabad A, Monsef-Esfahani H R, et al. Evaluation of systemic administration of Boswellia papyrifera extracts on spatial memory retention in male rats[J].J Nat Med, 2011, 65 (3/4) :519–525 . |
| [31] | 夏媛媛. AKBA的临床前药代动力学研究[D].天津:天津大学, 2012. |
| [32] | 蔡悠悠, 夏媛媛, 谷元, 等. 3-乙酰基-11-羰基-β-乳香酸在大鼠体内的代谢途径研究[J]. 中草药, 2013,44 (17) :2427–2432. |
| [33] | Yao M, Ma L, Humphreys W G, et al. Rapid screening and characterization of drug metabolites using a multiple ion monitoring-dependent MS/MS acquisition method on a hybrid triple quadrupole-linear ion trap mass spectrometer[J].J Mass Spectrom, 2008, 43 (10) :1364–1375 . |
| [34] | Kruger P, Kanzer J, Hummel J, et al. Permeation of Boswellia extract in the Caco-2 model and possible interactions of its constituents KBA and AKBA with OATP1B3 and MRP2[J].Eur J Pharm Sci, 2009, 36 (2/3) :275–284 . |
| [35] | Kruger P, Daneshfar R, Eckert G P, et al. Metabolism of boswellic acids in vitro and in vivo[J].Drug Metab Dispos, 2008, 36 (6) :1135–1142 . |
 2016, Vol. 47
2016, Vol. 47


