2. 天士力控股集团有限公司, 天津 300410
2. Tianjin Tasly Group Co., Ltd., Tianjin 300410, China
远志Polygalae Radix.为远志科远志属植物远志Polygala tenuifolia Willd.或卵叶远志Polygala sibirica L.的干燥根,其味苦、辛、温,归心、肾、脾经,具有安神益智、祛痰、消肿之功效,用于心肾不交引起的失眠多梦、健忘惊悸、神志恍惚等[1]。本课题组已有研究表明市售远志品质参差不齐,polygalaxanthone量难以控制。近年来,针对远志质量评价等方面的研究也多为个别成分为指标的测定分析[2]。姜勇等[3]开展了远志指纹图谱的研究,但所建立的HPLC指纹图谱检测时间为80 min,耗时长,损耗试剂多,不利于高通量分析;同时存在共有峰数目较少、缺乏共有峰定性等问题。综上所述,建立一种全面、快速的远志药材质量评价方法很有必要。本研究选取了有神经保护、抗抑郁等活性报道的6种成分(sibiricose A5、sibiricose A6、sibiricaxanthone B、glomeratose A、polygalaxanthoneⅢ、3, 6′-disinapoyl sucrose)进行同时测定,建立远志药材指纹图谱,采用UPLC-Q-TOF-MSE指认共有峰。利用本研究“指纹图谱+多成分定量”方法对药材主产地山西、陕西等地的远志进行较全面的快速质量分析,为临床使用提供更多科学依据。
1 仪器与试药 1.1 仪器超高效液相色谱系统(Waters公司ACQUITY UPLC,包括真空脱气机、二元梯度泵、自动进样器、柱温箱、TUV检测器),ACQUITY UPLC-Synapt G2 MS色谱-质谱联用仪(Waters公司),电子天平(XS205,瑞士METTLER TOLEDO公司),高速冷冻离心机(ST16R,美国Thermo公司),Milli-Q超纯水系统(美国Millipore公司),超声波清洗器(KQ-500DV,昆山市超声仪器有限公司)。
1.2 药品与试剂对照品sibiricose A5(批号AP0590,质量分数98%)、sibiricose A6(批号AP148S,质量分数98%)、sibiricaxanthone B(批号AP046S,质量分数98%)、glomeratose A(批号20150701,质量分数98%)均购自天津一方科技有限公司,polygalaxanthoneⅢ(批号111850-201203,质量分数95.7%)、3, 6′-disinapoyl sucrose(批号111848-201303,质量分数96.0%)均购自中国食品药品检定研究院。乙腈(色谱纯,德国Merck公司),甲酸(色谱纯,上海润捷公司),超纯水(Milli-Q制备)。
1.3 药材样本采集24批远志药材分别来自药材各主产区,经山西医科大学高建平教授鉴定为远志Polygala tenuifolia Willd.的根,且均通过DNA条形码技术(基于psbA-trnH序列)验证。药材来源见表 1。
|
|
表 1 24批远志药材样品来源 Table 1 Sources of 24 batches of Polygalae Radix |
2 方法 2.1 色谱条件和质谱条件 2.1.1 色谱条件
Waters ACQUITY UPLC T3(100 mm×2.1 mm,1.8μm)色谱柱。流动相0.1%甲酸水溶液(A)-乙腈(B):梯度洗脱条件为0~1 min,10% B;1~2.5 min,10%~14% B;2.5~4 min,14%~16% B;4~9 min,16%~25% B;9~12 min,25% B;12~14 min,25%~27% B;14~16 min,27%~30% B;16~18 min,30%~39.8% B;18~21 min,39.8%~40% B;21~23 min,40%~60% B;23~24 min,60%~100% B;24~26 min,100%~10% B。体积流量0.4 mL/min;检测波长320 nm;柱温30℃;进样量1μL。6种成分的理论塔板数均不低于6 000,此色谱条件检测时间短,信息量丰富,亦用于指纹图谱的分析,对照品及样品图谱见图 1。
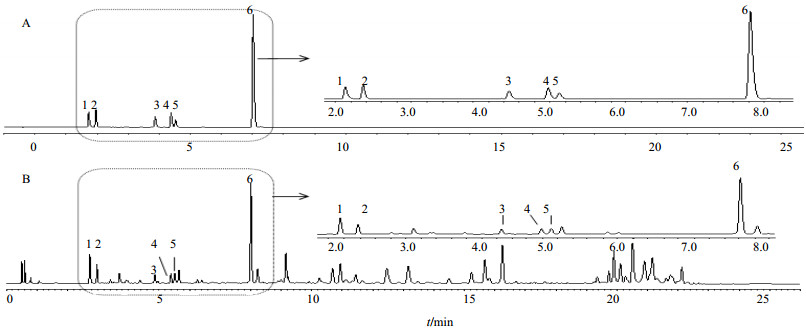
|
图 1 对照品(A)和远志样品(B)的UPLC色谱图 Fig.1 UPLC of reference substance (A) and Polygalae Radix (B) |
2.1.2 质谱条件
采用电喷雾离子源(ESI),负离子MSE模式,雾化气体为高纯度氮气(N2),碰撞气体为高纯度氩气(Ar)。质量扫描范围m/z 100~2 000;毛细管电压为3 kV;锥孔电压为40 V;离子源温度为120℃;雾化温度为300℃;载气体积流量为800 L/h,碰撞能量(CE)60~80 V;采用亮氨酸-脑啡肽进行精确质量校正([M-H]−为554.261 5)。
2.2 溶液的制备 2.2.1 对照品溶液的制备分别取sibiricose A5、sibiricose A6、sibiricaxanthone B、glomeratose A、polygalaxanthoneⅢ、3, 6′-disinapoyl sucrose对照品适量,精密称定,甲醇定容,制成质量浓度分别为39.8、47.7、23.9、28.2、27.4、263.0 mg/L的混合对照品贮备液,存贮于4℃冰箱中备用。
2.2.2 供试品溶液的制备样品干燥后粉碎,精密称定粉末(过三号筛)0.5 g,置于25 mL量瓶中,加入70%甲醇溶液20 mL,超声处理30 min(功率500 W,频率40 kHz),放至室温,70%甲醇溶液稀释至刻度,摇匀,转移至离心管,4 900 r/min下高速离心10 min,吸取上清液,0.22μm微孔滤膜滤过即得。
3 结果与分析 3.1 远志6种成分测定 3.1.1 线性关系考察精密吸取混合对照品贮备液适量,以甲醇逐级稀释,稀释倍数分别为1、2、4、8、16和32倍,摇匀。分别按“2.1.1”项下色谱条件进样分析,进样量均为1μL,测定峰面积。以峰面积为纵坐标(Y),质量浓度为横坐标(X),绘制各标准曲线,得到线性回归方程和线性范围,结果见表 2,6种化合物在各浓度范围内的线性关系良好。
|
|
表 2 6种成分的标准曲线、定量限、检测限 Table 2 Calibration curves, LOQ, and LOD for six constituents |
3.1.2 定量限与检测限
将对照品溶液逐级稀释后,按“2.1.1”项下色谱条件进样分析,信噪比(S/N)为3时的质量浓度(mg/L)为检测限(LOD),信噪比(S/N)为10时的质量浓度(mg/L)为定量限(LOQ),结果见表 2。
3.1.3 精密度试验分别精密吸取混合对照品溶液1μL,在“2.1.1”项色谱条件下重复进样6次,计算化合物sibiricose A5、sibiricose A6、sibiricaxanthone B、glomeratose A、polygalaxanthoneⅢ、3, 6′-disinapoyl sucrose峰面积RSD值,分别为0.3%、0.2%、0.3%、0.3%、0.1%、0.2%,表明仪器精密度良好。
3.1.4 重复性试验按“2.2.2”项下方法平行制备6份19号样品的供试品溶液,“2.1.1”项下色谱条件进样分析,计算sibiricose A5、sibiricose A6、sibiricaxanthone B、glomeratose A、polygalaxanthoneⅢ、3, 6′-disinapoyl sucrose质量分数RSD值,分别为0.9%、2.2%、0.7%、0.9%、1.9%、0.5%,实验重复性良好。
3.1.5 稳定性试验按“2.2.2”项下方法制备8号样品的供试品溶液,室温下放置,按“2.1.1”项下色谱条件分别在0、2、4、8、12、18、24 h时进样分析,计算6个化合物峰面积的RSD值,分别为1.0%、0.6%、0.7%、0.7%、1.5%、0.6%,样品在24 h内稳定性良好。
3.1.6 加样回收率试验取已测定的S19号样品6份,每份为0.25 g,精密称定,置于25 mL量瓶中,分别精密加入相当于样品成分量100%的各对照品溶液,按“2.2.2”项下方法制备供试品溶液,“2.1.1”项下色谱条件进样分析,计算6种成分的加样回收率。平均回收率分别为97.74%、99.31%、97.20%、99.53%、96.97%、100.57%;RSD分别为1.57%、0.60%、0.88%、0.73%、0.97%、0.19%。
3.1.7 样品测定按“2.2.2”项下方法制备24批供试品溶液,按“2.1.1”项下色谱条件分别测定24批远志样品的6种成分量,并计算每批样品6种成分总量,结果见表 3。不同产地的远志样品中6个成分均有不同程度的差异,其中3, 6′-disinapoyl sucrose与sibiricose A6的差异较明显。
|
|
表 3 24批远志中6种成分的量及指纹图谱相似度 Table 3 Contents of six constituents and similarity of UPLC fingerprint for 24 batches of Polygalae Radix |
3.2 远志的指纹图谱研究 3.2.1 共有峰的确定及方法学验证
采用“中药色谱指纹图谱相似度评价系统2004A版”软件对24批远志药材UPLC指纹图谱进行数据处理,确定共有峰37个,由于3, 6′-disinapoyl sucrose在各批次远志中均有出现,分离度良好且峰面积较大,故选择3, 6′-disinapoyl sucrose(10号峰)作为参照峰(S),以该参照峰计算各共有峰相对保留时间和相对峰面积,进行指纹图谱方法学考察,测定方法与“3.1”项相同。结果显示,同一样品溶液连续进样6次,各共有峰相对保留时间RSD<0.1%,相对峰面积RSD<2.2%,精密度良好。重复性考察各共有峰相对保留时间RSD<0.1%,相对峰面积RSD<3.6%;稳定性考察各共有峰相对保留时间RSD<0.3%,相对峰面积RSD<3.8%。
3.2.2 相似度计算及对照指纹图谱的生成24批远志样品的UPLC指纹图谱见图 2,生成对照指纹图谱见图 3。各产地远志药材指纹图谱与对照指纹图谱比对,24批样品相似度在0.756~0.997,结果见表 3。
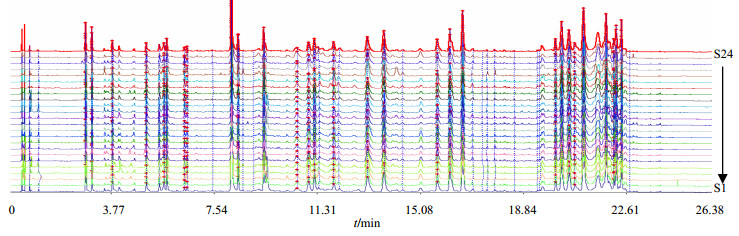
|
图 2 24批远志的UPLC指纹图谱 Fig.2 UPLCfingerprints of 24 batches of Polygalae Radix |
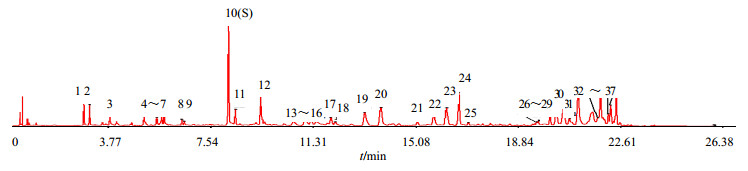
|
图 3 远志的对照指纹图谱 Fig.3 Reference fingerprint of Polygalae Radix |
3.2.3 共有峰的归属
依据对照品、文献质谱数据[4-16]和色谱保留行为,对37个共有峰中的33个进行了鉴定,其中1、2、4、5、6、10、15、32号峰采用对照品对照确定为sibiricose A5、sibiricose A6、sibiricaxanthone B、glomeratose A、polygalaxanthoneⅢ、3, 6′-disinapoyl sucrose、tenuifoliside C、onjisaponin B。归属的33个共有峰包括18个糖酯类成分,12个皂苷类成分,以及3个双苯吡酮类成分,结果见表 4。
|
|
表 4 基于UPLC-Q-TOF-MSE的远志指纹图谱共有峰的归属 Table 4 Common peaks inferred in Polygalae Radix by UPLC-Q-TOF-MSE |
4 讨论
本研究建立了综合评价远志药材质量方法,在同一色谱条件下,完成了运用一张UPLC色谱图同时对远志药材的6种成分测定和指纹图谱分析。在26 min内即可完成分离和测定,极大地缩短了分析时间,对于样品的高通量分析具有显著优势。
本研究在分析条件筛选研究中对提取条件(提取方式、溶剂及比例、时间等)及色谱条件(色谱柱、流动相、梯度洗脱程序等)均进行了优化,利用质谱信息验证了各峰纯度,最终建立的分析方法可见峰数量明显增加,改善峰形和拖尾,分离度好,信息丰富且简单易行。本研究采用UPLC-Q-TOF-MSE对指纹图谱共有峰进行归属,通过对离子模式、脱溶剂气温度、离子源温度及毛细管电压等质谱条件进行筛选,确定了准分子离子峰及碎片离子峰响应值均较高的条件,在该条件下,研究8个对照品及样品多级质谱信息,鉴定了37个共有峰中的33个峰,包括18个糖酯类成分,12个皂苷类成分以及3个双苯吡酮类成分,表明该分析条件从整体上可以涵盖远志具有活性的3大类成分,具有代表性。
远志产地较多,但目前市场上流通的远志大货多产于山西陕西一带,故本研究收集了产量较高的山西、陕西、河北、内蒙等地产远志药材,本实验所用24批药材均扩增其psbA-trnH序列,鉴定为远志Polygala tenuifolia Willd.[17-18],样品种属来源可靠,保证了本实验建立的分析模式的准确性及样本测定结果的可靠性。在多样本量的基础上,远志药材的6种成分量通过SPSS主成分分析,结果发现在不同产地的药材中有差异,其中3, 6′-disinapoyl sucrose与sibiricose A6较为明显。24批样品的UPLC指纹图谱,除7、12、17、20号以外,相似度均在0.9以上,说明从指纹图谱角度看,不同产地的远志药材质量有差异也有共性。综合定量与指纹图谱相似度数据,利用SPSS对不同产地样品进行聚类分析,结果显示有差异也有重叠现象,说明产地在远志药材质量方面有影响但可能不是主因素,可能与药材生长年限,采收季节等相关性较大,今后可以在本研究建立的分析条件下对远志药材质量影响因素进行进一步探讨。
远志药材的化学成分复杂,因对照品等因素限制,对6种成分进行了测定。但是仅以几种成分来控制药材质量较为片面,远志药材中其他成分同样有可能对药材质量产生不同程度的影响。因此本实验采用指纹图谱进一步对远志质量进行表征和研究。
UPLC“指纹图谱+多成分定量”评价方法综合多方面信息,系统探讨远志药材质量的差异,可在一定程度上表征药材在化学成分方面的差别,综合二者的信息,可以为远志的产地选择、质量快速评价及临床应用提供参考。在此基础上,如果将药效、毒性与物质基础等结合起来,深入开展谱效学研究,则更有利于阐明中药作用机制,完善远志的质量评价体系,为用药提供科学的依据。
| [1] | 中国药典[S].一部. 2015. |
| [2] | 姜秋, 李慧芬, 梁晓, 等. HPLC同时测定不同产地远志饮片中6种寡糖酯类成分[J]. 中成药, 2015,37 (2) :360–364. |
| [3] | 姜勇, 张娜, 崔振, 等. 远志药材的HPLC指纹图谱[J]. 药学学报, 2006,45 (2) :179–183. |
| [4] | Miyase T, Noguchi H, Chen X M. Sucrose esters and xanthone C-glycosides from the roots of Polygala sibirica[J]. J Nat Prod, 1999, 62 (7) :993–996 . |
| [5] | Kobayashi W, Miyase T, Suzuki S, et al. Oligosaccharide esters from the roots of Polygala arillata[J]. J Nat Prod, 2000, 63 (8) :1066–1069 . |
| [6] | Jiang Y, Zhang W, Tu P, et al. Xanthone glycosides from Polygala tenuifolia and their conformational analyses[J]. J Nat Prod, 2005, 68 (6) :875–879 . |
| [7] | Lkeya Y, Sugama K, Okada M, et al. Four new phenolicglycosides from Polygala tenuifolia[J]. Chem Pharm Bull, 1991, 39 (10) :2600–2605 . |
| [8] | Miyase T, Ueno A. Surose derivative from Polygala tenuifolia[J]. Jpn J Pharm, 1993, 47 (3) :267–278 . |
| [9] | Ling Y, Li Z, Chen M, et al. Analysis and detection of the chemical constituents of Radix Polygalae and their metabolites in rats after oral administration by ultra high-performance liquid chromatography coupled with electrospray ionization quadrupole time-of-flight tandem mass spectrometry[J]. J Pharm Biomed Anal, 2013, 85 :1–13 . |
| [10] | Iwata Y, Ueno A. Tenuifolioses G-P, oligosaccharide multi-esters from the roots of Polygala tenuifolia[J]. Chem Pham Bull, 1992, 40 (10) :2741–2748 . |
| [11] | Miyase T, Iwata Y, Ueno A. Tenuifolioses A-F, oligosaccharide multi-esters from the roots of Polygala tenuifoia[J]. Chem Pham Bull, 1991, 39 (11) :3082–3084 . |
| [12] | Liu J, Yang X, He J, et al. Structure analysis of triterpene saponins in Polygala tenuifolia by electrospray ionizationIon trap multiple-stage mass spectrometry[J]. J Mass Spectrom, 2007, 42 (7) :861–873 . |
| [13] | Sakuma S, Shoji J. Studies on the constituents of the root of Polygala tenuifolia Willdenow. I. Isolation of saponins and the structures of onjisaponins G and F[J]. Chem Pham Bull, 1981, 29 (9) :2431–2441 . |
| [14] | Zhang D, Miyase T, Kuroyanagi M, et al. Five new triterpene saponins, polygalasaponins XXVⅢ-XXXII from the root of Polygala japonica Houtt[J]. Chem Pham Bull, 1996, 44 (4) :810–815 . |
| [15] | Li C, Yang J, Yu S, et al. Triterpenoid saponins with neuroprotective effects from the roots of Polygala tenuifolia [J]. Planta Med, 2008, 74 (2) :133–141 . |
| [16] | Sakuma S, Shoji J. Studies on the constituents of the root of Polygala tenuifolia Willdenow. II. On the structures of onjisaponins A, B and E[J]. Chem Pham Bull, 1982, 30 (3) :810–821 . |
| [17] | 樊杰, 白妍, 束明月. 远志属7种药用植物ITS1和ITS2序列分析[J]. 中草药, 2015,46 (4) :562–565. |
| [18] | 马孝熙, 任伟超, 孙伟, 等. 远志药材及其混伪品的DNA条形码鉴定[J]. 世界科学技术—中医药现代化, 2014,16 (8) :1719–1724. |
 2016, Vol. 47
2016, Vol. 47


