2. 山西大学 中医药现代研究中心, 山西 太原 030006 ;
3. 中国中医科学院中药资源中心, 道地药材国家重点实验室培育基地, 北京 100700
2. Modern Research Center for Traditional Chinese Medicine, Shanxi University, Taiyuan 030006, China ;
3. State Key Laboratory Breeding Base of Dao-di Herbs, National Resource Center of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
道地药材是人们传统公认的、生长在特定生境下的优质中药材的总称,在来源上具有强烈的地域性,往往分布在狭小的区域,或虽分布较广,但只有某些狭小生境区域内所产的药材质量最好,疗效最佳。换言之,特定的生态环境是构成道地药材最重要的外在因素[1]。作为根表面土壤微域的重要成员,道地药材根际微生物菌群受产地气候、土壤特性等环境因素影响,通过与宿主相互作用,影响着
道地药材品质的形成[2]。江曙等[3]发现岷当归根际微生态种群结构较云南和四川等产区稳定,多样性指数和丰富度指数最高;潘惠霞等[4]发现道地药材人工种植伊犁贝母根际真菌数量与西贝素量极显著正相关。因此,研究道地药材根际微生物对于其品质形成研究具有重要意义。
黄芪原名黄耆,始载于《神农本草经》,列为上品。针对黄芪产地的考证发现,在唐、宋、元、明等朝代,黄芪的产地有甘肃、四川、陕西和山西,其中以山西绵上所产者为道地[5]。民国名医曹炳章《增订伪药条辨》进一步明确“山西太原府里陵地方出者,名上芪……最为道地”。现代化学研究亦表明,山西浑源、应县境内恒山山脉所产黄芪即浑源黄芪(Hunyuan Astragali Mongolici Radix,HAMR)品质最佳[6]。目前,研究者已从种植方式、产地海拔和经纬度、气候、土壤营养和微量元素等角度对浑源黄芪品质形成进行了研究[7-10]。但是,浑源黄芪产地微生物菌群特征目前并不清楚。
核糖体内转录间隔序列法(automated ribosomal intergenic spacer analysis,ARISA),由美国学者Fisher和Triplett于1999年提出[11]。该方法以荧光标记引物扩增微生物群体基因组DNA中的16 S~23 S rRNA间隔区,再通过毛细管电泳法分析ARISA-PCR产物大小和对应的荧光强度,并假设每一片段大小对应于一群体分类操作单元(operational taxonomic unit,OTU),获得菌群组成和相对丰富度信息,用于菌群结构分析。目前,该方法已成功地应用于淡水、鳃、瘤胃、土壤等环境微生物菌群结构分析,是多数研究者认可的一种快速、高效、可以衔接宏基因组测序等技术的环境微生物分析方法[12-14]。孙海峰等[15]亦采用该方法成功地分析了丁桂儿脐贴辅助治疗儿童腹泻对肠道菌群的影响。本实验即采用该方法,以黄芪根围5 cm处和根表面土为实验材料,以非根际土和其他产地黄芪根围土为对照,对浑源黄芪根际微生物的菌群特征进行剖析。以期阐述浑源黄芪根际菌群组成特征,并找出代表性样本,为下一步采用宏基因组技术研究黄芪根际微生物组成及其功能基因表达奠定基础。
1 材料和方法 1.1 样本收集采样点位于山西浑源县千佛岭乡泽青岭黄芪种植基地,分别于2012、2013年10月上旬采集。其中非根际土取自距黄芪50 cm远、10~20 cm深处土壤,根围土取自距黄芪根5 cm远、10~20 cm深处,涉及的种植年限有2、3和5年。根表土采自2、3、5年生黄芪,抖落法收集。
甘肃陇西和黑龙江加格达奇塔河样本分别采自2013年10月,前者采自种植2年的黄芪根围,后者采自野生膜荚黄芪根围。取样方法同上。采集后,所有样本于室温条件下送回实验室,液氮冷冻后置于−80℃保存。
1.2 ARISA指纹图谱构建与数据分析 1.2.1 基因组DNA的提取与纯化参照文献报道[16],球磨法提取土壤微生物基因组DNA。参照文献报道[17],用Sephadex G-200(GE,美国)小柱去除基因组DNA中的腐殖酸。0.8%琼脂糖凝胶电泳检测DNA完整性,Nanodrop 2000分光光度计(Thermo,美国)测定含量,无菌水稀释至20 ng/μL,−20℃保存,作为PCR反应用模板。
1.2.2 ARISA指纹图谱构建、原始数据加工与分析除模板DNA用量为20 ng外,ARISA指纹图谱构建用引物序列、荧光素标记及PCR反应体系和反应条件,ARISA图谱数据加工及后续数据分析方法同文献[15]。简言之,用GeneMarker2.2.0(Soft Genetics,美国)进行ARISA指纹图谱加工,将图谱信息转换成OTUs组成(由不同大小的DNA片段表示)和相对丰富度数据,并导入Excel中。用软件包Paleontological statistics(PAST)对Excel表中的数据进行分析,获得菌群结构信息。
2 结果与分析 2.1 浑源黄芪根围土微生物菌群结构分析根际范围的划分,在学术界颇受争议,一般指植物根与土界面不足1 mm到几毫米范围的微区土壤,但林木研究是在根际附近较大区域展开的[18]。此外,植物根释放出的挥发性有机化合物(volatile organic compounds,VOCs)易于扩散至更大的土壤微域,进而影响更大范围内的土壤栖息者[19]。由于黄芪根中含有多种抑制微生物生长的VOCs[20-21],所以本研究除采集根表土外,还采集了距离根5 cm处的根围土,以较为全面地考察浑源黄芪根际微生物菌群特征。以非根际菌群为对照,根围菌群布雷柯蒂斯相似性数据(Bray-Curtis index)聚类结果见图 1。从图 1可以看出,浑源黄芪根围菌群与非根际土明显分开,提示浑源黄芪生长导致其根围5 cm处土壤微生物菌群迁移,菌群结构发生了改变。相比较而言,根围菌群样本较分散,提示黄芪生长可能导致根围微生物菌群相似度减少。Bray-Curtis相似度分析结果表明,非根际菌群相似度为0.514 6±0.113 1,根围菌群相似度为0.492 3±0.126 9,二者差异显著(P<0.000 1),即浑源黄芪生长的确导致根围菌群相似度下降。
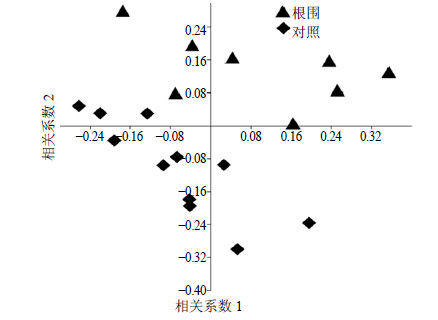
|
图 1 浑源黄芪近根际土样本聚类分析图 Fig.1 Non-metric multidimensional scaling plot of bulk and surrounding soils of HAMR |
除菌群相似性外,黄芪生长是否还影响着根围菌群的多样性,针对此问题,采用样本稀释曲线法(sample rarefraction)分析了黄芪根围菌群的多样性,结果见图 2。就个体而言,根围菌群多样性均高于非根际菌群(对照),提示黄芪生长导致根围菌群多样性增加。就多样性曲线总体趋势而言,随着样本数的增加,根围菌群多样性曲线趋向于与非根际样本曲线重合,提示两类型菌群组成相近,浑源黄芪生长对根围菌群组成影响较小。换言之,黄芪生长对根围菌群的影响主要体现在菌群的相似度上。
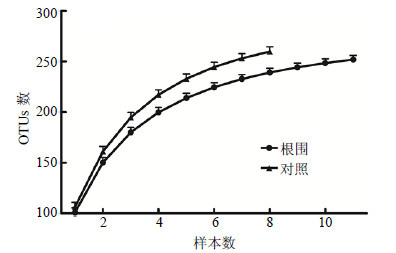
|
图 2 黄芪根围土OTUs数量分析 Fig.2 Analysis on OTUs numbers in surrounding soils of HAMR |
2.2 浑源黄芪根表土微生物菌群结构分析
采用根围菌群相同类型的数据,以非根际菌群为对照,不同种植年限的浑源黄芪根表菌群聚类分析结果见图 3。相对于非根际样本而言,2~3年生根表土样本较为分散,菌群发生了明显迁移;而种植5年的根表土样本较为集中,与非根际样本距离较近,即种植5年的浑源黄芪根表土微生物菌群相似度与非根际菌群更为接近。由此可见,浑源黄芪根表微生物菌群结构与药材的种植年限有关,随种植年限的延长,浑源黄芪生长对根表菌群迁移的影响逐渐减弱,根表菌群有逐渐恢复至非根际菌群结构的趋势。

|
图 3 不同种植年限浑源黄芪根表土聚类分析 Fig.3 Non-metric multidimensional scaling plot of surface soil specimens of different ages of HAMR |
为了定量描述不同种植年限浑源黄芪根表土微生物菌群结构的迁移特征,采用One-way ANOSIM对上述种植年限根表菌群与非根际菌群相似性差异显著性进行了分析。结果表明,除种植5年的浑源黄芪根表菌群外,种植2、3年的根表微生物菌群明显不同于非根际菌群,具有显著性差异,P值分别为0.011 6、0.010 2。上述种植年限的浑源黄芪根表土与非根际土微生物菌群的相似度分别为0.450 5±0.104 4、0.480 5±0.083 3、0.545 7±0.097 5,即2年生相似度最小、5年生相似度最高。因此,就菌群相似度而言,多年生浑源黄芪根表土微生物菌群的确具有逐渐恢复至非根际菌群结构的特性。
不同种植年限浑源黄芪根表土微生物菌群样本稀释曲线见图 4。从图 4可以看出,种植3年的菌群多样性最高,种植2年的菌群多样性较非根际低,但随着样本数的增加,其稀释曲线有高于非根际稀释曲线的趋势。从稀释曲线图趋势来看,2年生和3年生菌群随样本数增加的变化趋势较为一致,较非根际稀释曲线高。相比较而言,种植5年的浑源黄芪根表土稀释曲线低于非根际曲线,但随着样本数的增加,该曲线趋向于与非根际曲线重合,即种植5年的浑源黄芪根表土微生物多样性趋向于种植前的土壤微生物菌群状态。综上所述,浑源黄芪种植2~3年内对其根表土微生物菌群结构的影响较大,随种植年限的延长,影响变小,并趋向于与非根际土壤微生物菌群结构一致。
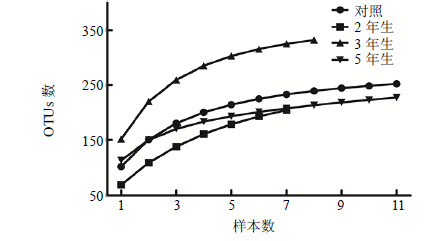
|
图 4 不同种植年限黄芪根表土OTUs数量分析 Fig.4 Analysis on OTUs numbers in surface soils of HAMR with different ages |
2.3 浑源黄芪与其他产地黄芪根围土微生物菌群特征分析
针对浑源黄芪根围菌群多样性分析结果表明,只要样本数量足够多,同一产地根围菌群组成与非根际菌群趋于一致。因此,本课题组比较了实验室现有山西浑源、甘肃陇西和黑龙江塔河黄芪根围土样本微生物菌群多样性,以进一步了解浑源黄芪根际微生物的菌群特征,有关结果见图 5。从图 5可以看出,浑源黄芪根围土菌群多样性较甘肃陇西和黑龙江塔河的低,但变化趋势与黑龙江塔河基本一致。此外,就样本个体而言,虽然甘肃黄芪根围微生物多样性较山西黄芪的高,但整体增加趋势较缓,随着样本数的增加,山西浑源黄芪总体多样性将高于甘肃陇西黄芪。
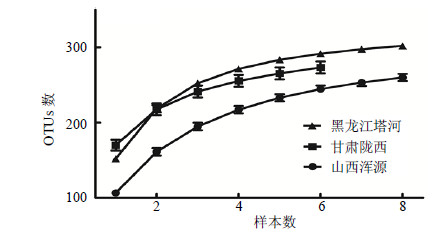
|
图 5 不同产地黄芪根围土OTUs数量分析 Fig.5 Analysis on OTUs numbers of surrounding soils of Astragali Mongolici Radix from different production areas |
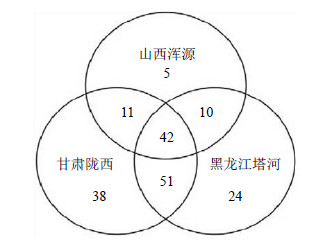
在适应产地生态环境的过程中,宿主植物根际微域逐渐形成其特有的核心微生物组(Core microbiota),并通过与宿主植物的相互作用,影响着宿主的营养、健康和防御应答。ARISA指纹图谱中,假定每个片段长度对应于1个独立的OTU,因此,同一样本群共有OTUs即可以认为是该样本群的核心OTUs。以同一产地样本中检出概率大于60%作为标准,对3个产地黄芪根围共享及独有的核心OTUs数量进行了统计,结果见图 6。从图 6可以看出,无论是与其他产地共享OTUs数,还是产地独有OTUs数,山西浑源的数值均最低,甘肃陇西最高。
|
图 6 不同产地样本共享及独有的核心OTUs数量分析 Fig.6 Analysis on shared and unique core OTUs of soil specimens from different regions |
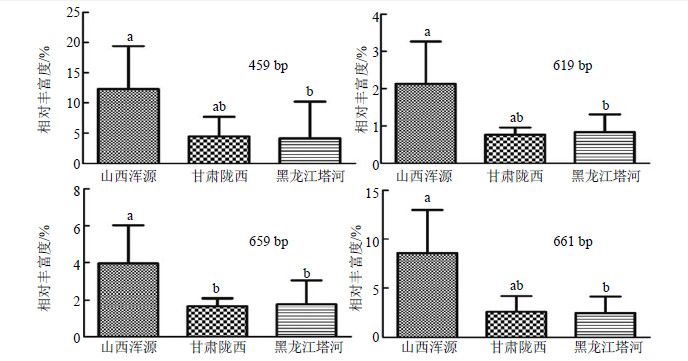
在3产地共享的42个核心OTUs中,片段长度为459、597、617、619、659、661 bp的OTUs在各产地样本中的检出概率为100%,属上述产地黄芪根围的优势菌。为了进一步考察产地的影响,对上述6个共享OTUs在各个产地样本中的相对丰富度进行了分析。除片段长度为597和517 bp的OTUs相对丰富度在3产地样本间无显著差异外,其余核心OTUs结果见图 7。从图 7可以看出,上述OTUs在山西浑源样本中的相对丰富度明显高于黑龙江塔河样本。此外,甘肃陇西样本中片段长度为659 bp的OTU相对丰富度亦明显低于山西浑源样本。
|
图 7 不同产地黄芪根围核心OTUs相对丰富度分析 Fig.7 Relative abundance of core OTUs in surrounding soils collected from different areas |
3 讨论
在黄芩中,随着种植年限的延长,根表土微生物总数趋于增加,而多样性和均匀度趋于减少[22]。在大蒜中,种植15年的近根区土壤细菌数量最少,2年最多,且随着种植年限的延长,菌群相似性和均匀性持续下降[23]。连作2年的地黄根际土壤细菌种群多样性降低,并显著低于1年土壤;设施栽培芦笋根际土壤细菌多样性和丰富度指数均随种植年限的延长而减小[24-25]。本研究中,种植2~3年的浑源黄芪根表土菌群多样性增加、相似度减小,而种植5年的根表土多样性减少、相似度增加,且趋向于与非根际土一致。提示随种植年限延长,浑源黄芪根表土菌群具有恢复至非根际菌群的趋势。产地实地调研亦发现,多年生浑源黄芪不存在连作障碍的问题。概言之,浑源黄芪根际微生物既有与其他药用植物相同之处,也有不同的地方。具体而言,种植年限较短时,根际菌群结构均发生变化;但随着种植年限的延长,浑源黄芪根际菌群具有逐渐恢复至非根际菌群状态的特性,而上述研究涉及的其他药用植物无此特性。
岷当归属当归道地药材,其根际微生态种群结构较云南和四川等产区稳定,多样性指数和丰富度指数最高[3]。与其他产地黄芪相比,浑源黄芪根围土多样性和核心OTUs数均较低,但核心OTUs相对丰富度明显高于其他产地。一方面说明,浑源黄芪根围土微生物菌群特征不同于其他产地黄芪,同时亦说明道地药材根际微生物菌群特征与道地药材品种有关,根际微生物很可能参与了道地药材的品质形成。为了探究不同的道地药材品质形成,很有必要研究其根际微生物。
目前在生产中,黄芪采收年限一般为种植2~3年。本研究发现,2~3年生浑源黄芪根际微生物菌群结构迁移明显,根际菌群微生态系统未恢复至种植前即非根际菌群状态,而种植5年的浑源黄芪根际菌群与非根际菌群相似度接近,二者无显著差异。基于此,建议在黄芪人工种植中,应该尽量延长其种植年限,至少达到4年以后再采挖,以保证根际微生物菌群结构的稳定,有利于采挖后土壤微生态系统的恢复。
| [1] | 谢宗万. 论道地药材[J]. 中医杂志, 1990 (10) :43–46. |
| [2] | 江曙, 段金廒, 钱大玮, 等. 根际微生物对药材道地性的影响[J]. 土壤, 2009,41 (3) :344–349. |
| [3] | 江曙, 段金廒, 严辉, 等. 当归根际微生物种群结构与生态分布的研究[J]. 中国中药杂志, 2009,34 (12) :1483–1488. |
| [4] | 潘惠霞, 程争鸣, 牟书勇, 等. 伊贝根际微生物分布与西贝素的相关性[J]. 微生物学通报, 2010,37 (8) :1253–1257. |
| [5] | 冯毓秀, 李鸣. 黄芪的本草考证[J]. 基层中药杂志, 1993,7 (2) :4–9. |
| [6] | 杨庆珍, 刘德旺, 王冬梅, 等. 黄芪生态型与品质的相关性研究[J]. 中草药, 2014,45 (16) :2395–2399. |
| [7] | 陈虎彪, 白焱晶, 蔡少青, 等. 不同种植方式下恒山黄芪的质量比较研究[J]. 中国中药杂志, 2008,33 (5) :570–573. |
| [8] | 陈安家, 郭宝林, 黄文华, 等. 影响山西恒山野生蒙古黄芪质量的环境因素研究[J]. 中草药, 2012,43 (5) :984–989. |
| [9] | 杜少佳, 岳鹏宇. 浅谈恒山黄茂生长的气象条件[J]. 山西气象, 2007,79 (2) :20–21. |
| [10] | 张强, 程滨, 董云中, 等. 北岳恒山地道黄芪营养特征及产地土壤理化性状研究[J]. 水土保持学报, 2005,19 (6) :26–30. |
| [11] | Fisher M M, Triplett E W. Automated approach for ribosomal intergenic spacer analysis of microbial diversity and its application to freshwater bacterial communities[J]. Appl Environ Microb, 1999, 65 (10) :4630–4636 . |
| [12] | Zural D, Benayahu Y, Or A, et al. Composition and dynamics of the gill microbiota of an invasive Indo-Pacific oyster in the eastern Mediterranean Sea[J]. Environ Microb, 2011, 13 (6) :1467–1476 . |
| [13] | Randard L, Poly F, Lata J C, et al. Characterization of bacterial and fungal soil communities by automated ribosomal intergenic spacer analysis fingerprints: biological and methodological variability[J]. Appl Environ Microb, 2001, 67 (10) :4479–4487 . |
| [14] | 程艳芬, 朱伟云. ARISA方法研究产甲烷菌共存及去除条件下瘤胃真菌多样性变化[J]. 微生物学报, 2009,49 (4) :0504–0511. |
| [15] | 孙海峰, 高彦云, 安翠红, 等. 丁桂儿脐贴辅助治疗对泄泻小儿肠道菌群的影响及其作用特征[J]. 中国中药杂志, 2014,39 (14) :2756–2761. |
| [16] | Angel A, Claus P, Conrad R. Methanogenic archaea are globally ubiquitous in aerated soils and become active under wet anoxic conditions[J]. ISME J, 2012, 6 :847–862 . |
| [17] | Tsai Y L, Olson B H. Rapid method for separation of bacterial DNA from humic substances in sediments for polymerase chain reaction[J]. Appl Environ Microb, 1992, 58 (7) :2292–2295 . |
| [18] | 方昉, 吴承祯, 洪伟, 等. 植物根际、非根际土壤酶与微生物相关性研究进展[J]. 亚热带农业研究, 2007,3 (3) :209–215. |
| [19] | Ali J G, Campos-Herrera R, Alborn H T, et al. Sending mixed messages: a trophic cascade produced by a belowground herbivore-induced cue[J]. J Chem Ecol, 2013, 39 :1140–1147 . |
| [20] | 徐怀德, 周瑶, 雷霆. 鲜黄芪和干黄芪挥发性化学成分比较分析[J]. 食品科学, 2011,32 (10) :171–174. |
| [21] | Nakamura S, Hatanaka A. Green-leaf-derived C6-aroma compounds with potent antibacterial action that act on both Gram-negative and Gram-positive bacteria[J]. J Agric Food Chem, 2002, 50 :7639–7644 . |
| [22] | 张向东, 何伟. 不同种植年限黄芩田土壤微生物数量特征研究[J]. 陕西农业科学, 2011 (4) :3–5. |
| [23] | 李妮.不同种植年限大蒜近根区土壤微生物学特性研究[D].济南:山东农业大学, 2013. |
| [24] | 陈慧.地黄连作对土壤微生物的影响[D].福州:福建农林大学, 2008. |
| [25] | 周德平, 褚长彬, 范洁群, 等. 不同种植年限设施芦笋土壤微生物群落结构与功能研究[J]. 土壤, 2014,46 (6) :1076–1082. |
 2016, Vol. 47
2016, Vol. 47


