2. 广东省生物制品与药物研究所, 广东 广州 510440 ;
3. 中山大学光华口腔医学院附属口腔医院 口腔颌面外科 广东省口腔医学重点实验室, 广东 广州 510055
2. Guangdong Institute of Biological Products and Drug, Guangzhou 510440, China ;
3. Guangdong Provincial Key Laboratory of Stomatology, Guanghua School of Stomatology, Hospital of Stomatology, Sun Yat-sen University, Guangzhou 510055, China
恶性肿瘤是目前中国面临的严重公共卫生问题之一。第3次全国死因抽样调查显示:恶性肿瘤已跃居我国城乡居民的第二大死因、城市居民的第一大死因,而且恶性肿瘤的死亡率呈持续攀升趋势,比20世纪70年代中期增加了83.1%,比20世纪90年代初期增加了22.5%。鼻咽癌是区域性高发的恶性肿瘤,尤以广东、广西、福建等地区多发。鼻咽癌的治疗以放疗为主,但对化疗的敏感性也很高,化疗在鼻咽癌治疗过程中以诱导化疗、同步放化疗、辅助化疗和姑息化疗等多种形式与放疗联合应用,对于局部晚期鼻咽癌已形成了放疗联合化疗的标准治疗模式[1]。喜树碱类抗肿瘤药物也逐渐进入鼻咽癌化疗方案中[1-3]。喜树碱(camptothecin)是一种植物来源的化疗药物,通过抑制拓朴异构酶I(Topo I)干扰DNA复制,影响细胞周期,进而促进肿瘤细胞凋亡[4-5]。然而喜树碱固有和/或获得性耐药性经常导致临床治疗失败,应用时出现的严重毒副作用也妨碍了喜树碱疗效的发挥。如何降低毒副作用、逆转耐药性是进一步提高喜树碱对鼻咽癌疗效的关键问题。
白杨素(chrysin)是黄芩、南酸枣等中药以及蜂蜜、蜂胶中量丰富的一种黄酮类物质,化学名5, 7-二羟黄酮(5, 7-dihydroxyflavone)。近年在动物实验和体外研究中均观察到白杨素及其衍生物具有一定的肿瘤预防和抑制肿瘤细胞生长、诱导肿瘤细胞凋亡的作用[6-9]。本课题组前期研究发现,白杨素具有通过多种途径提高抗肿瘤药物诱导肿瘤细胞凋亡作用的能力[10-13]。如果将白杨素以小剂量甚至食物用量与喜树碱联合应用,发挥白杨素协同抗肿瘤作用,提高喜树碱促进凋亡作用,则既能保持白杨素天然优势,又可有效增强喜树碱抗肿瘤活性,为中西医结合防治肿瘤开拓新的思路。
本研究选择鼻咽癌细胞CNE2,从细胞水平入手,探讨白杨素联合喜树碱对CNE2细胞凋亡的促进作用,观察白杨素是否有辅助提高喜树碱抗肿瘤作用的能力,并在分子水平初步分析其作用机制,为鼻咽癌的联合化疗提供新理论依据。
1 材料 1.1 药品与试剂白杨素(批号STBB9943V,质量分数97%)、喜树碱(批号1242620 23308086,质量分数>90%)、二甲基亚砜(DMSO)购于Sigma公司;全半胱氨酸蛋白酶(caspase)抑制剂z-VAD-fmk购于Bio Mol公司;Hochest 33342购于GENMED Scientifics公司,抗caspase-3、Bcl-xL、tubulin、GAPDH抗体购于Cell Signaling Technology公司;抗poly(ADP-ribose)polymerase(PARP)抗体购于BD公司(San Diego,CA);SDS-PAGE、PVDF膜、化学显色试剂均购于Bio-Rad公司。
1.2 细胞人鼻咽癌CNE2细胞来源于中山大学肿瘤医院,细胞培养基DMEM购自Gibco公司,10%新生小牛血清(FBS,Gibco),青霉素、链霉素各100 U/mL(Gibco),37℃、5% CO2饱和湿度条件下进行单层培养、传代,取指数生长期细胞进行实验。
1.3 主要仪器奥林巴斯荧光倒置相差显微镜;法国VILBER-LOURMAT CHEMI-SMART 3000成像系统、Thermo高内涵筛选系统(Cellomics Toxinsight Reader);Thermo酶标仪。
2 方法 2.1 样品制备及细胞处理白杨素以DMSO配制为20 mmol/L储存液,使用时再以DMEM培养基稀释为应用液,使DMSO的终体积分数<0.5%。各实验均按白杨素单独或提前2 h预处理后联合喜树碱(1μg/mL)程序处理CNE2细胞,根据检测需要收获细胞。
2.2 细胞形态学观察设白杨素(10、20、40μmol/L)3个剂量组,喜树碱(1μg/mL)组,白杨素(10、20、40μmol/L)分别联合喜树碱(1μg/mL)组及未处理对照组,共8组,在24孔培养板上接种CNE2细胞,每孔500μL,接种密度约1×105/mL,培养24 h后,白杨素单独或提前2 h预处理后联合喜树碱处理细胞24 h,于普通倒置显微镜下进行观察,椐形态改变筛选:白杨素和喜树碱单独作用不出现明显的细胞死亡,而联合使用后细胞数量明显减少、死亡细胞明显增加的联合剂量组。
2.3 MTT法检测细胞活性分组同“2.2”项,在96孔培养板上接种CNE2细胞,每孔100μL,接种密度约1×105/mL,培养24 h后按设计剂量处理细胞,每个剂量组设定4个平行孔。白杨素单独或提前2 h预处理后联合喜树碱处理细胞24 h后以D-Hanks液冲洗3次,加入含10% MTT(5 mg/mL)的无血清培养液,继续培养4 h后,弃去MTT溶液,每孔加DMSO 100μL,震荡10 min充分混合以溶解结晶物后,用酶标仪测定各孔在570、630 nm波长处的吸光度(A)值,则样品A值=A630-A570,并计算细胞存活率。
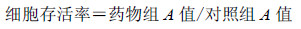
|
设白杨素(40μmol/L)组、喜树碱(1μg/mL)组、白杨素(40μmol/L)联合喜树碱(1μg/mL)组及未处理对照组共4组,在24孔培养板上接种CNE2细胞,每孔500μL,接种密度约1×105/mL,培养24 h后根据设计剂量白杨素单独或提前2 h预处理后联合喜树碱处理细胞24 h后以Hochest 33342荧光染料(50μg/mL)对细胞染色,Thermo高内涵筛选系统分析,扫描记录49个视野后,计数凋亡细胞数,计算凋亡细胞比例。
2.5 Western blotting蛋白表达分析细胞分组及处理同“2.2”项,在6孔培养板上接种CNE2细胞,每孔2 mL,接种密度约1×105/mL,收集经不同处理的药物组和未做任何处理对照组CNE2细胞,以蛋白裂解液[50 mmol/L Tris-HCl,pH 7.4,1% NP-40,0.25% sodium deoxycholate,150 mmol/L NaCl,1 mmol/L EGTA,1 mmol/L PMSF,1 mmol/L Na3VO4,1 mmol/L NaF和protease inhibitor cocktail(Roche)]提取蛋白质,定量后SDS-PAGE分离。转膜后先后与5%脱脂奶粉封闭,PARP、caspase-3、Bcl-xL、tubulin、GAPDH一抗、过氧化物酶偶联的二抗孵育,化学发光试剂曝光,用VILBER-LOURMAT CHEMI-SMART 3000图像分析系统对目的蛋白进行比较分析,每个实验重复3次。
2.6 caspase抑制剂z-VAD-fmk对白杨素联合喜树碱诱导CNE2细胞凋亡的影响z-VAD-fmk能阻止所有caspase酶家族的活化裂解,从而阻断凋亡信号途径,抑制凋亡。设z-VAD-fmk(20μmol/L)预处理30 min后白杨素(40μmol/L)联合喜树碱(1μg/mL)组、白杨素(40μmol/L)联合喜树碱(1μg/mL)组、z-VAD-fmk组(20μmol/L)及未处理对照组,共4组,在24孔培养板上接种CNE2细胞,每孔500μL,接种密度约1×105/mL,培养24 h后根据设计剂量处理细胞24 h后进行Hochest 33342染色,Thermo高内涵筛选系统分析,扫描记录49个视野后,计数凋亡细胞数,计算凋亡细胞比例。另设z-VAD-fmk(20μmol/L)预处理30 min后白杨素(40μmol/L)联合喜树碱(1μg/mL)组、白杨素(40μmol/L)联合喜树碱(1μg/mL)组、白杨素(40μmol/L)组、喜树碱(1μg/mL)组、z-VAD-fmk(20μmol/L)组及未处理对照组,共6组,在6孔培养板上接种CNE2细胞,每孔2 mL,接种密度约1×105/mL,培养24 h,根据设计剂量处理细胞24 h后收集蛋白Western blotting检测细胞中PARP和caspase 3蛋白变化情况,每个实验重复3次。
2.7 统计学处理数据采用SPSS 13.0统计软件分析处理,实验数据用x±s表示。两组之间样本均数比较以t检验进行统计学分析,包括两独立样本t检验和单样本t检验。多组间均数比较满足方差齐性以单因素方差分析(One-Way ANOVA)进行比较,方差组间两两比较采用LSD’s法。
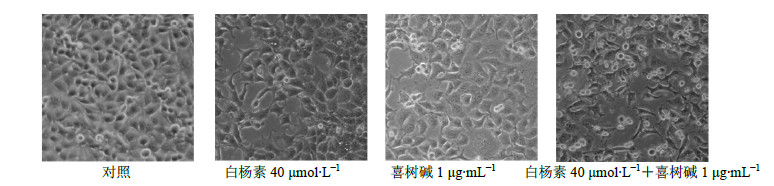
3 结果 3.1 白杨素对喜树碱诱导CNE2细胞死亡的影响 3.1.1 形态学观察结果以白杨素单独/联合喜树碱及喜树碱单独处理CNE2细胞,在普通倒置显微镜下观察细胞形状、大小、数量和死亡情况,初步筛选得到单独喜树碱作用后不出现明显细胞死亡的剂量作为以下各实验中喜树碱的使用剂量,即为1μg/mL。白杨素预处理2 h后联合喜树碱共同处理24 h后,倒置显微镜(×100)下观察到白杨素40μmol/L联合1μg/mL喜树碱组CNE2细胞与对照组、单独白杨素和单独喜树碱组细胞对比,细胞死亡数量明显增加。见图 1。
|
图 1 形态学观察白杨素预处理对喜树碱诱导的CNE2细胞死亡的影响 Fig.1 Morphological observation on effect of pretreatment with chrysin on apoptosis of CNE2 cells induced by camptothecin |
3.1.2 MTT法检测CNE2细胞存活率
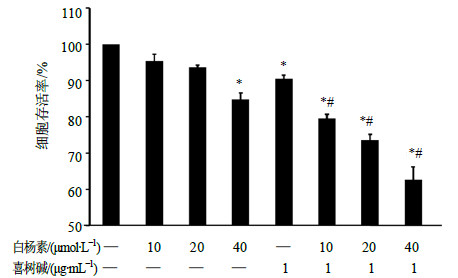
以不同浓度白杨素(10、20、40μmol/L)单独/联合喜树碱(1μg/mL)及单独喜树碱(1μg/mL)处理CNE2细胞,于24 h收获细胞,以MTT法检测分析肿瘤细胞存活率的变化情况。白杨素(10、20、40μmol/L)联合喜树碱(1μg/mL)处理组,随着白杨素浓度增加,对细胞活性的抑制作用明显增强;不仅与未处理对照组比较差异显著(P<0.05),而且与单独白杨素组和单独喜树碱组比较差异均显著(P<0.05)。单独白杨素40μmol/L、单独喜树碱1μg/mL组与未处理对照组比较,细胞存活率也显著降低(P<0.05)。见图 2。
|
图 2 MTT法检测各组CNE2细胞存活率结果(x±s, n=3) Fig.2 Cell viability rates of CNE2 cells detected by MTT in each group (x±s, n=3) |
3.2 白杨素联合喜树碱对CNE2细胞凋亡的影响
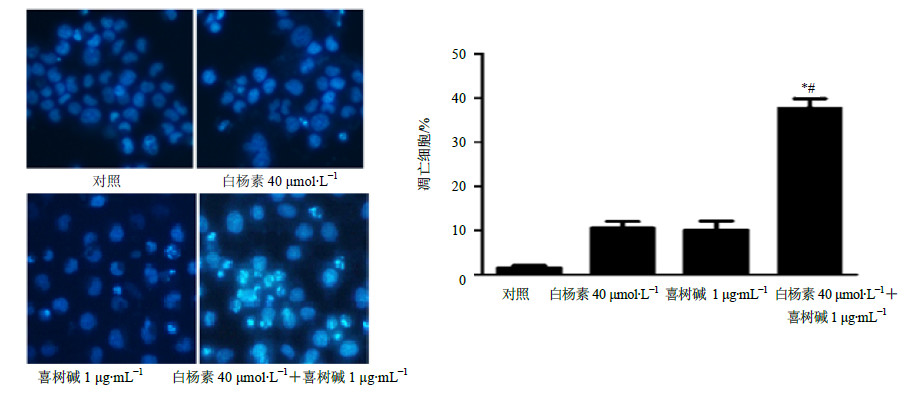
凋亡中晚期细胞中染色质在局部区域凝集,固缩,继而核碎裂出现凋亡小体。在Hoechst染色下,细胞核或者凋亡小体内的DNA会呈现蓝色的致密浓染或者碎块状致密浓染,白杨素(40μmol/L)预处理2 h后联合喜树碱(1μg/mL)共同处理24 h后,细胞以Hochest 33342(50μg/mL)染色30 min后于荧光倒置显微镜下观察,可见联合处理组浓染的凋亡细胞明显增加,而未处理对照组、单独的白杨素组和单独喜树碱组未见浓染的凋亡细胞改变,见图 3。Thermo高内涵筛选系统分析,联合处理组的凋亡细胞率达(37.82±2.05)%,对照组为(1.51±0.57)%,差异显著(P<0.05),见图 3。
|
图 3 白杨素单独/联合喜树碱对CNE2细胞凋亡的影响(x±s, n=3) Fig.3 Effect of chrysin or/and camptothecin on aoptosis of CNE2 cells (x±s, n=3) |
3.3 白杨素联合喜树碱对CNE2细胞凋亡相关蛋白表达的影响 3.3.1 白杨素联合喜树碱处理CNE2细胞对凋亡标志蛋白的影响
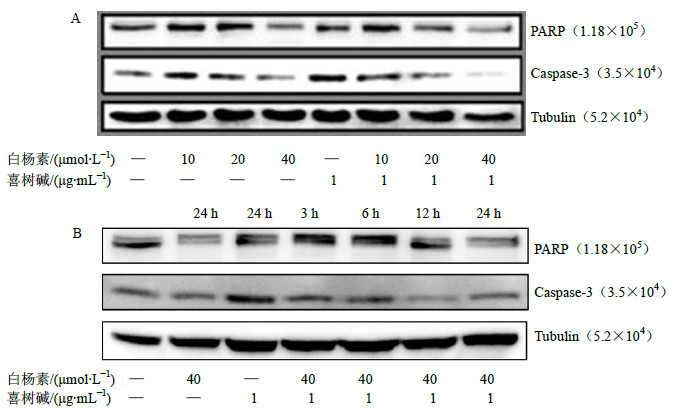
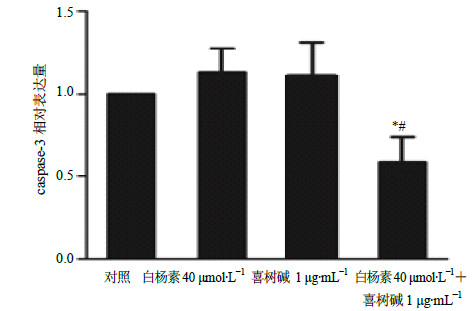
药物作用24 h后对各组CNE2细胞caspase-3和PARP蛋白进行Western blotting检测分析,可观察到随着预处理白杨素(10、20、40μmol/L)浓度的增加,PARP(1.18×105)和caspase-3(3.5×105)原蛋白逐渐减少,见图 4-A;未处理对照组、白杨素(40μmol/L)组、喜树碱(1μg/mL)组、白杨素(40μmol/L)联合喜树碱(1μg/mL)组处理CNE2细胞3、6、12、24 h共7组,随着处理时间的延长(3、6、12、24 h),联合组细胞中PARP和caspase-3原蛋白逐渐减少,单独的白杨素组也可见PARP和caspase-3原蛋白减少,见图 4-B;Tubulin作为内参,结果重复3次,白杨素(40μmol/L)、喜树碱(1μg/mL)、白杨素(40μmol/L)联合喜树碱(1μg/mL)处理CNE2细胞24 h,caspase-3蛋白灰度分析结果见图 5。
|
图 4 白杨素联合喜树碱对CNE2细胞凋亡标志蛋白的影响 Fig.4 Effect of combination of chrysin and camptothecin on protein marks of apoptosis in CNE2 cells |
|
图 5 白杨素联合喜树碱对CNE2细胞Caspase-3蛋白表达的影响(灰度分析, x±s, n=3) Fig.5 Effect of combination of chrysin and camptothecin on protein expression of caspase-3 in CNE2 cells (gray intensity, x±s, n=3) |
3.3.2 白杨素联合喜树碱处理CNE2细胞对凋亡抑制蛋白表达的影响
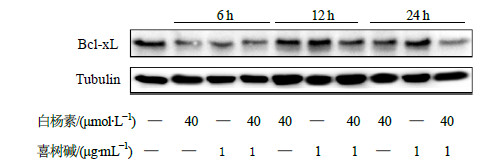
以白杨素(40μmol/L)预处理2 h后,白杨素(40μmol/L)组、喜树碱(1μg/mL)组、白杨素(40μmol/L)联合喜树碱(1μg/mL)组再处理CNE2细胞6、12、24 h及未处理对照组共10组细胞,分别收集细胞,提取蛋白,以Western blotting检测核转录因子-κB(NF-κB)调节的系列凋亡抑制蛋白Bcl-xL的表达变化情况,Tubulin作为内参。在喜树碱单独处理组,凋亡抑制蛋白Bcl-xL表达量在各个时间点均增加;而白杨素预处理后,喜树碱引起的凋亡抑制蛋白Bcl-xL的高表达明显受到抑制,联合处理时间越长下调作用越明显,并有可重复性,见图 6。
|
图 6 白杨素联合喜树碱对Bcl-xL蛋白表达的影响 Fig.6 Effect of chrysin combined with camptothecin on expression of Bcl-xL protein |
3.4 caspase抑制剂z-VAD-fmk对白杨素联合喜树碱诱导的CNE2细胞凋亡的影响
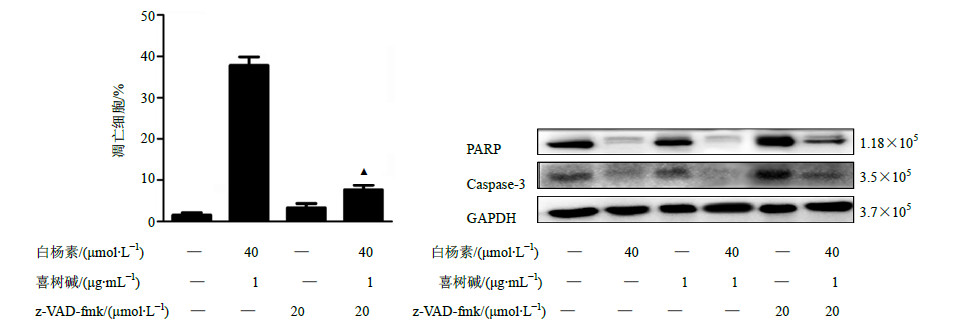
z-VAD-fmk(20μmol/L)预处理30 min,白杨素(40μmol/L)联合喜树碱(1μg/mL)处理CNE2细胞24 h,Hochest 33342染色后,Thermo高内涵筛选系统分析结果显示:使用z-VAD-fmk(20μmol/L)前后联合处理组的凋亡细胞率有显著性差异(P<0.05),见图 7;z-VAD-fmk(20μmol/L)、白杨素(40μmol/L)联合喜树碱(1μg/mL)处理CNE2细胞24 h,Western blotting检测凋亡标志蛋白PARP和caspase-3的变化。GAPDH作为内参,结果重复3次。结果表明PARP和caspase-3原蛋白不再活化降解,见图 7。
|
图 7 z-VAD-fmk对白杨素联合喜树碱诱导CNE2细胞凋亡的影响 Fig.7 Effect of z-VAD-fmk on apoptosis induced by cotreatment of chrysin and camptothecin in CNE2 cells |
4 讨论
黄酮是一种天然多酚类物质,广泛分布于水果、蔬菜及中药中。近年研究已发现槲皮素、茶多酚、木犀草素[14-15]等多种黄酮类物质具有化疗增敏作用。黄酮类物质白杨素是中药中的一种重要活性成分,具有促进多种抗肿瘤物质诱导肿瘤细胞死亡的能力[10-12]。本研究中观察到白杨素联合喜树碱能够有效促进鼻咽癌CNE2细胞死亡,并随着白杨素剂量增加联合处理引起的细胞死亡量明显增加;白杨素联合喜树碱引起的细胞死亡增加,不仅与未处理对照组有统计学差异(P<0.05),与单独的白杨素和单独的喜树碱引起的CNE2细胞死亡量间差异均有统计学意义(P<0.05)。在进一步的机制研究中发现,白杨素联合喜树碱对鼻咽癌细胞死亡促进作用是caspase依赖的细胞凋亡,首先以荧光染色识别凋亡细胞标志性的核固缩浓染;随后Western blotting检测到随白杨素剂量增加和联合处理时间延长,凋亡标志蛋白PARP和caspase-3原蛋白逐渐活化降解增多;caspase酶抑制剂能有效逆转白杨素联合喜树碱引起的CNE2细胞凋亡和凋亡标志蛋白PARP、caspase-3的活化降解。本研究在细胞和分子水平证明白杨素具有提高喜树碱诱导鼻咽癌细胞凋亡的能力,证实白杨素与喜树碱联合的增效价值。研究中观察到单独的白杨素也有一定的诱导肿瘤细胞凋亡作用,但其引起的凋亡要远远少于白杨素联合喜树碱引起的细胞凋亡量,差异有统计学意义(P<0.05)。
研究发现,白杨素可降低NF-κB活性而发挥抗炎作用[16]和促进肿瘤细胞凋亡作用[11],笔者还观察到白杨素活化p53促进肿瘤细胞凋亡[12]。NF-κB和p53均可作为转录因子调节凋亡相关基因的表达,影响肿瘤细胞凋亡。NF-κB可以调节系列凋亡抑制基因,如Bcl-2、Bcl-xL、cIAPs、xIAP、FLIP[17]的表达。体内研究和体外研究也观察到白杨素具有下调凋亡抑制蛋白Bcl-xL、FLIP表达的能力[18-19]。NF-κB活性与喜树碱的化疗耐药性同样有密切关系,喜树碱可以活化NF-κB,而抑制NF-κB活性可明显促进喜树碱对肿瘤细胞活性的抑制[20-21]。白杨素是否可以通过抑制喜树碱活化的NF-κB活性而下调其下游的凋亡抑制蛋白的表达,从而达到白杨素与喜树碱的联合促凋亡作用尚不明确。凋亡抑制蛋白Bcl-xL主要通过改变线粒体膜的通透性而影响内源凋亡途径[22],本研究观察到白杨素联合喜树碱可抑制由单独喜树碱上调的凋亡抑制蛋白Bcl-xL的表达,内源凋亡更为活跃。但白杨素联合喜树碱具体以什么方式影响Bcl-xL表达还需要深入的探讨。
通过本研究证实白杨素联合喜树碱可以有效促进鼻咽癌CNE2细胞凋亡,抑制NF-κB活性、下调凋亡抑制蛋白Bcl-xL的表达是其重要的分子机制。通过本研究希望能为开发传统中药活性成分、传承中医食疗理念、解决鼻咽癌对喜树碱耐药性的问题做出有意义的探索,为白杨素的进一步开发利用提供理论基础。
| [1] | 冼献清, 谢民强, 江刚.鼻咽癌化疗现状及进展[J]. 临床耳鼻咽喉头颈外科杂志, 2013, 27(3): 164-168. |
| [2] | 韦军葆. 放疗联合羟基喜树碱治疗早期鼻咽癌的疗效分析[J]. 重庆医学, 2015,44 (1) :94–96. |
| [3] | 何丽佳, 吴敬波, 文庆莲. 拓扑替康不同时间给药对人鼻咽癌细胞放射增敏作用的实验研究[J]. 临床肿瘤学杂志, 2010,15 (6) :511–513. |
| [4] | Grivicich I, Mans D R, Peters G J, et al. Irinotecan and oxaliplatin: an overview of the novel chemotherapeutic options for the treatment of advanced colorectal cancer[J]. Braz J Med Biol Res, 2001, 34 (9) :1087–1103 . |
| [5] | Pommier Y. Drugging topoisomerases: lessons and challenges[J]. ACS Chem Biol, 2013, 8 (1) :82–95 . |
| [6] | Zeng W, Yan Y, Zhang F, et al. Chrysin promotes osteogenic differentiation via ERK/MAPK activation[J]. Protein Cell, 2013, 4 (7) :539–547 . |
| [7] | Yang F, Jin H, Pi J, et al. Anti-tumor activity evaluation of novel chrysin-organogermanium (IV) complex in MCF-7 cells[J]. Bioorg Med Chem Lett, 2013, 23 (20) :5544–5551 . |
| [8] | Pichichero E, Cicconi R, Mattei M, et al. Chrysin-induced apoptosis is mediated through p38 and Bax activation in B16-F1 and A375 melanoma cells[J]. Int J Oncol, 2011, 38 (2) :473–483 . |
| [9] | Ren J, Cheng H, Xin W Q, et al. Induction of apoptosis by 7-piperazinethylchrysin in HCT-116 human colon cancer cells[J]. Oncol Rep, 2012, 28 (5) :1719–1726 . |
| [10] | Li X, Wang J N, Huang J M, et al. Chrysin promotes tumor necrosis factor (TNF)-related apoptosis-inducing ligand (TRAIL) induced apoptosis in human cancer cell lines[J]. Toxicol In Vitro, 2011, 25 (3) :630–635 . |
| [11] | Li X, Huang Q, Ong C N, et al. Chrysin sensitizes tumor necrosis factor-alpha-induced apoptosis in human tumor cells via suppression of nuclear factor-kappa B[J]. Cancer Lett, 2010, 293 (1) :109–116 . |
| [12] | Li X, Huang J M, Wang J N, et al. Combination of chrysin and cisplatin promotes the apoptosis of Hep G2 cells by up-regulating p53[J]. Chem Biol Interact, 2015, 232 :12–20 . |
| [13] | Gao A M, Ke Z P, Shi F, et al. Chrysin enhances sensitivity of BEL-7402/ADM cells to doxorubicin by suppressing PI3K/Akt/Nrf2 and ERK/Nrf2 pathway[J]. Chem Biol Interact, 2013, 206 (1) :100–108 . |
| [14] | Jung Y H, Heo J, Lee Y J, et al. Quercetin enhances TRAIL-induced apoptosis in prostate cancer cells via increased protein stability of death receptor 5[J]. Life Sci, 2010, 86 (9/10) :351–357 . |
| [15] | 李小林, 徐玉英, 孙向珏, 等. 木犀草素增强顺铂诱导的人肺癌细胞A549凋亡作用[J]. 中草药, 2009,40 (3) :431–433. |
| [16] | Ali N, Rashid S, Nafees S, et al. Beneficial effects of Chrysin against Methotrexate-induced hepatotoxicity via attenuation of oxidative stress and apoptosis[J]. Mol Cell Biochem, 2014, 385 (1/2) :215–223 . |
| [17] | Lee C H, Jeon Y T, Kim S H, et al. NF-κB as a potential molecular target for cancer therapy[J]. Biofactors, 2007, 29 (1) :19–35 . |
| [18] | Pal-Bhadra M, Ramaiah M J, Reddy T L, et al. Plant HDAC inhibitor chrysin arrest cell growth and induce p21WAF1 by altering chromatin of STAT response element in A375 cells[J]. BMC Cancer, 2012, 12 :180. |
| [19] | Khan M S, Devaraj H, Devaraj N. Chrysin abrogates early hepatocarcinogenesis and induces apoptosis in N-nitrosodiethylamine-induced preneoplastic nodules in rats[J]. Toxicol Appl Pharmacol, 2011, 251 (1) :85–94 . |
| [20] | Chen M C, Lee N H, Ho T J, et al. Resistance to irinotecan (CPT-11) activates epidermal growth factor receptor/nuclear factor kappa B and increases cellular metastasis and autophagy in LoVo colon cancer cells[J]. Cancer Lett, 2014, 349 (1) :51–60 . |
| [21] | Jayasooriya R G, Park S R, Choi Y H, et al. Camptothecin suppresses expression of matrix metalloproteinase-9 and vascular endothelial growth factor in DU145 cells through PI3K/Akt-mediated inhibition of NF-kappaB activity and Nrf2-dependent induction of HO-1 expression[J]. Environ Toxicol Pharmacol, 2015, 39 (3) :1189–1198 . |
| [22] | Ashkenazi A. Directing cancer cells to self-destruct with pro-apoptotic receptor agonists[J]. Nat Rev Drug Discov, 2008, 7 (12) :1001–1012 . |
 2016, Vol. 47
2016, Vol. 47



