白血病是一类造血干细胞恶性克隆性疾病,是血液科常见恶性肿瘤之一。目前,化疗是治疗白血病的主要手段,但由于白血病治疗中原发性耐药及继发性耐药的产生,极大地影响了患者的化疗效果。多药耐药性(multidrug resistance,MDR)是指肿瘤细胞对一种药物具有耐药性的同时,对其他结构不同、作用靶点不同的抗肿瘤药物也具有耐药性[1-2]。目前,如何克服MDR已成为白血病治疗中最大的技术难题。
吴茱萸碱(evodiamine,EVO)是从吴茱萸Euodiae Fructus中提取的吲哚类生物碱。国外学者Ogasawara等[3-5]研究发现,EVO有明显抗肿瘤侵袭及抗肿瘤转移作用。农丽等[6]发现EVO能逆转肺癌耐药细胞株A549/DDP的耐药性,增加耐药细胞对顺铂(DDP)的敏感性。本研究以白血病K562细胞及其耐药株K562/Adr细胞为实验对象,初步探讨EVO对肿瘤细胞MDR的影响及可能机制,为其临床应用提供实验依据。
1 材料 1.1 药品与试剂EVO购自南京泽朗医药科技有限公司(批号ZL20131015,HPLC检测质量分数大于98%),取二甲基亚砜(DMSO)将EVO充分溶解,配制成100 μmol/L的储存液,−20 ℃保存。实验前用RPMI 1640完全培养液(含10%胎牛血清)稀释成所需浓度(DMSO终体积分数<0.1%)。RPMI 1640培养基、胎牛血清(美国Gibco公司);Cell Counting Kit-8(重庆鼎国生物技术有限公司);柔红霉素(DNR,南京泽朗医药科技有限公司,质量分数≥98%);DMSO(重庆鼎国生物技术有限公司)。
1.2 细胞株人白血病K562细胞为重庆医科大学干细胞与组织工程研究室冻存;K562/Adr细胞购自上海博谷生物科技有限公司。
2 方法 2.1 CCK-8法检测细胞增殖取处于对数生长期的K562及K562/Adr细胞,调整细胞密度为l×105个/mL,接种于96孔板,接种量为每孔100 μL。将细胞分为空白组、对照组和药物组。空白组只加入RPMI 1640完全培养基(DMSO终体积分数<0.1%),对照组加入含等量细胞的RPMI 1640完全培养基,药物组分别加入不同浓度的EVO或DNR,药物量为每孔100 μL,每一浓度设6个平行复孔。在CO2恒温细胞培养箱中培养24、48、72 h。作用结束后,加入CCK-8试剂10 μL,培养2.5 h后,用酶标仪检测吸光度(A)值,计算药物对K562及K562/Adr细胞的增殖抑制率,实验重复3次,从而筛选出EVO和DNR最适作用时间和浓度。采用直线回归方法计算药物的半数抑制浓度(IC50),通过公式计算出各药物的耐药指数(RI)。

|
采用直线回归法计算出细胞存活率>90%时,EVO的药物浓度。将非细胞毒剂量的EVO和不同浓度的DNR联合作用于K562和K562/Adr细胞,CCK-8检测细胞增殖活性,计算EVO+DNR对K562和K562/Adr细胞的IC50值。通过公式计算出逆转倍数(RF)。
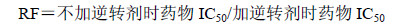
|
取处于对数生长期的K562及K562/Adr细胞,接种于细胞培养瓶中。将细胞分为对照组和加药(EVO、DNR、EVO+DNR)组。K562细胞加药浓度为DNR 0.1 μmol/L、EVO 3.7 μmol/L、EVO 0.125 μmol/L+DNR 0.142 μmol/L,K562/Adr细胞加药浓度为DNR 3.1 μmol/L、EVO 70.6 μmol/L、EVO 0.125 μmol/L+DNR 0.258 μmol/L。根据上述药物浓度,向加药组细胞加入各药物,对照组加入等量完全培养基,将细胞培养瓶放入CO2恒温细胞培养箱中培养48 h。作用结束后,取出细胞,在倒置显微镜(200×)下观察各组细胞状态,随机选取3个视野观察并进行拍照。
2.3 细胞周期实验取处于对数生长期的K562及K562/Adr细胞,接种于细胞培养瓶中。细胞分组及用药情况同“2.2”项。根据上述药物浓度,向加药组细胞加入各药物,对照组加入等量完全培养基,将细胞培养瓶放入CO2恒温细胞培养箱中培养48 h。收集各组细胞,用PBS溶液洗涤3次,以2 000 r/min离心5 min,收集5×105个细胞,用流式细胞仪测定各组细胞周期分布比例。
2.4 荧光实验取处于对数生长期的K562及K562/Adr细胞,接种于细胞培养瓶中。将细胞分为对照组、DNR组和DNR+EVO组。K562细胞加药浓度为DNR 0.1 μmol/L、EVO 0.125 μmol/L+DNR 0.142 μmol/L。K562/Adr细胞加药浓度为DNR 3.1 μmol/L、EVO 0.125 μmol/L+DNR 0.258 μmol/L。根据上述药物浓度,向各组细胞分别加入各药物,对照组加入等量完全培养基,将细胞培养瓶放入CO2恒温细胞培养箱中培养48 h。收集细胞,PBS洗涤细胞3次,以2 000 r/min离心5 min,收集5×105个细胞,用流式细胞仪测定各组细胞内DNR荧光强度。
2.5 RT-PCR实验取处于对数生长期的K562及K562/Adr细胞,接种于细胞培养瓶中,分为对照组、EVO组、DNR组、EVO+DNR组。K562细胞加药浓度为DNR 0.1 μmol/L、EVO 3.7 μmol/L、EVO 0.125 μmol/L+DNR 0.142 μmol/L,K562/Adr细胞加药浓度为DNR 3.1 μmol/L、EVO 70.6 μmol/L、EVO 0.125 μmol/L+DNR 0.258 μmol/L。各组加入相应浓度药物后,将细胞培养瓶放入CO2恒温细胞培养箱中培养48 h后收集细胞,用Trizol法提RNA,并测定浓度。用Takara试剂盒进行逆转录,用Quant one step QRT-PCR试剂盒进行实验,并且统计数据,进行表达差异分析。
2.6 Western blotting实验取处于对数生长期的K562及K562/Adr细胞,接种于细胞培养瓶中,细胞分组及用药情况同“2.5”项。各组加入相应浓度药物后,将细胞培养瓶放入CO2恒温细胞培养箱中培养48 h,收集细胞,提取总蛋白。用蛋白浓度测定试剂盒检测蛋白浓度,用BCA方法定量蛋白。各取50 μg蛋白,进行SDS-PAGE电泳,电转到PDVF膜,5%脱脂奶粉封闭2 h,一抗4 ℃过夜,TBST缓冲液漂洗,二抗室温孵育1.5 h,TBST缓冲液漂洗后用ECL系统显影,运用Quantity One图像分析软件测得条带的吸光度值,以各组的目的条带和内参条带吸光度比值为相对表达量,比较各组间差异。
2.7 统计学方法采用SPSS 18.0软件对所得数据进行统计处理,数据以x±s表示,多组间采用两因素方差分析和单因素方差分析,两两比较采用LSD检验。
3 结果 3.1 EVO对细胞增殖及耐药逆转情况的影响 3.1.1 EVO和DNR对细胞增殖的影响及RI采用CCK-8法,经酶标仪490 nm波长分别检测EVO、DNR对K562和K562/Adr细胞增殖的影响,发现对照组细胞体外生长活跃,加药组细胞增殖受到抑制,且呈剂量依赖性,见图 1。根据CCK-8结果,计算各组药物作用48 h的IC50,EVO对K562和K562/Adr细胞的IC50分别为3.702 5、70.687 5 μmol/L,DNR对K562和K562/Adr细胞的IC50分别为0.102、3.116 μmol/L。DNR的RI为30.54;EVO的RI为19.09。
|
图 1 EVO和DNR对K562和K562/Adr细胞增殖的抑制作用 (x± s, n = 6) Fig.1 Inhibition of EVO and DNR on proliferation of K562 and K562/Adr cells (x± s, n = 6) |
3.1.2 EVO对DNR的RF
CCK-8检测发现,当EVO浓度<0.125 μmol/L时K562和K562/Adr细胞的存活率均>90%,因此0.125 μmol/L为EVO非细胞毒剂量。将0.125 μmol/L的EVO与不同浓度DNR联用后,能使DNR对K562/Adr细胞的IC50明显下降(0.258 μmol/L),但对K562细胞的IC50却没有明显变化(0.142 μmol/L)。在K562/Adr细胞中,EVO对DNR的RF为12.07。
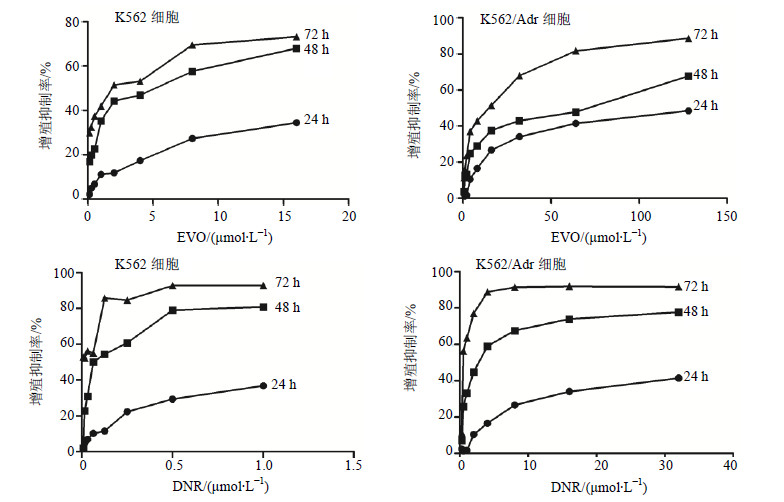
3.2 EVO对细胞形态的影响倒置显微镜观察结果显示,将对照组与药物组(EVO、DNR、EVO+DNR)细胞培养48 h后,分别拍照。K562细胞:对照组细胞生长状况良好,而药物组(EVO、DNR、EVO+DNR)细胞数目明显减少,且EVO+DNR组减少数量明显多于EVO、DNR组。K562/Adr细胞:对照组细胞生长良好,而药物组(EVO、DNR、EVO+DNR)细胞数目明显减少,EVO+DNR组细胞减少的数量明显多于EVO、DNR组。但EVO+DNR使K562/Adr细胞减少数量少于其使K562细胞减少的数量。见图 2。
|
图 2 EVO和DNR对K562和K562/Adr细胞形态的影响 Fig.2 Effects of EVO and DNR on morphology of K562 and K562/Adr cells |
3.3 EVO对K562及K562/Adr细胞细胞周期的影响
EVO、DNR单用及联合应用作用于K562细胞48 h后,流式细胞仪检测结果显示,EVO和DNR组细胞周期没有明显变化,与对照组相比无统计学意义;EVO+DNR组G2/M期、S期细胞比例增加,G0/G1期细胞比例减少,与对照组相比差异显著(P<0.01)。EVO、DNR单用及联合应用作用于K562/Adr细胞48 h后,流式细胞仪检测结果显示,EVO和DNR组细胞周期也没有明显变化,与对照组相比无统计学意义;EVO+DNR组G2/M期、S期细胞比例增加,G0/G1期细胞比例减少,与对照组相比差异显著(P<0.01)。见表 1。
|
|
表 1 EVO和DNR对K562和K562/Adr细胞细胞周期的影响 Table 1 Effects of EVO and DNR on cell cycle of K562 and K562/Adr cells |
3.4 EVO对细胞摄取DNR的影响
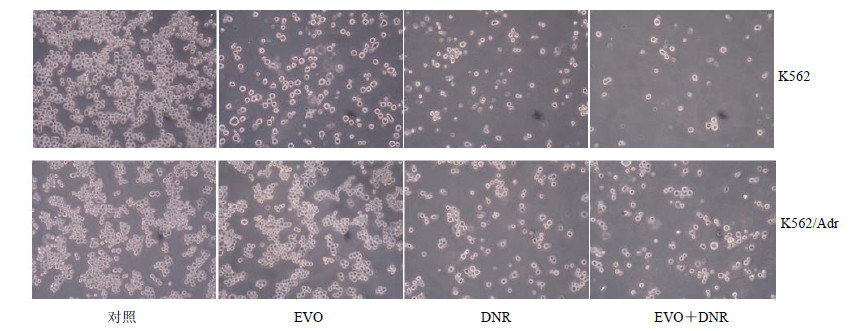
流式细胞仪检测结果显示,对K562细胞,EVO+DNR组细胞内荧光阳性率增高,与对照组相比差异非常显著(P<0.01);对K562/Adr细胞,EVO+DNR组细胞内荧光阳性率明显增高,与对照组相比差异非常显著(P<0.01);经EVO+DNR联合作用后的K562/Adr细胞内DNR荧光阳性率增强较K562细胞更为明显。见图 3。
|
图 3 EVO对K562和K562/Adr细胞摄取DNR的影响 Fig.3 Effect of EVO on DNR uptake of K562 and K562/Adr cells |
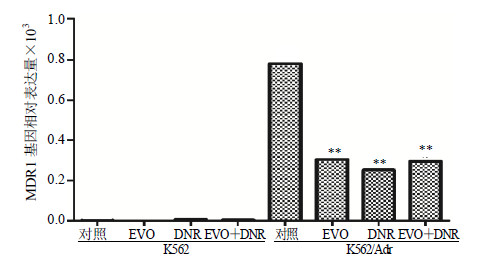
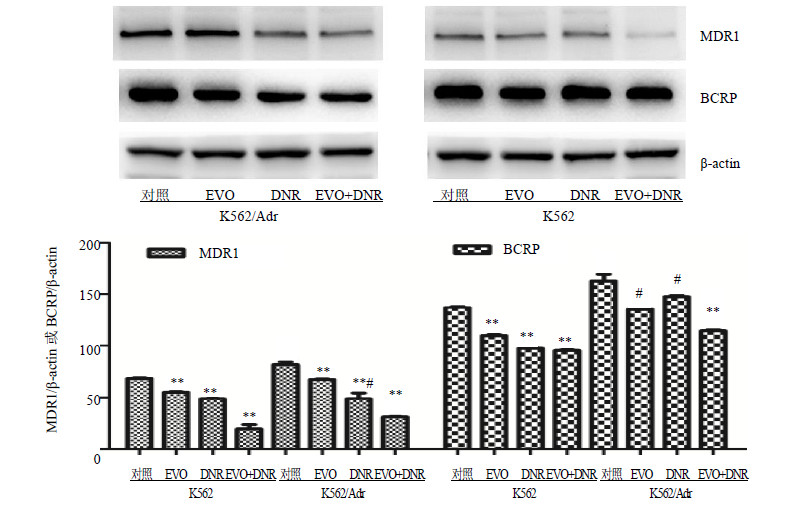
3.5 EVO对K562及K562/Adr细胞MDR1基因和MDR1、BCRP蛋白表达的影响
RT-PCR检测结果显示,EVO、DNR单独及联合应用作用于K562、K562/Adr细胞48 h后,与对照组相比较,EVO组、DNR组及EVO+DNR组K562/Adr细胞内MDR1基因的表达均逐渐降低(P<0.01),但给药组间相比差异无统计学意义;各组K562细胞中MDR1基因几乎不表达。见图 4。Western blotting检测结果显示,K562/Adr细胞中,各组BCRP、MDR1蛋白表达水平均有所下降,其中EVO+DNR组的MDR1、BCRP蛋白表达水平的下降较EVO、DNR组更为明显(P<0.01);K562细胞中,各组MDR1蛋白表达水平明显下降(P<0.01),BCRP蛋白表达水平略微下降(P<0.05),见图 5。
|
图 4 EVO和DNR对K562和K562/Adr细胞MDR1基因表达的影响 Fig.4 Effects of EVO and DNR on MDR1 gene expression of K562 and K562/Adr cells |
|
图 5 EVO和DNR对K562和K562/Adr细胞MDR1和BCRP蛋白表达的影响 Fig.5 Effects of EVO and DNR on MDR1 and BCRP protein expression of K562 and K562/Adr cells |
4 讨论
白血病作为我国10种高发恶性肿瘤之一,由于其分型和预后分层复杂,因此治疗方法并非千篇一律,需要结合每个病人细致的分型和预后分层制定治疗方案。目前白血病治疗的主要手段之一就是化疗,而白血病对化疗的先天耐药及获得性耐药,是化疗失败的主要原因。
本实验中,选择K562和K562/Adr细胞作为研究对象,加入不同浓度的DNR作用不同时间,并用CCK-8法检测DNR对K562和K562/Adr细胞增殖的影响。实验结果表明,DNR能有效抑制K562和K562/Adr细胞的增殖,并呈剂量和时间依赖性。值得注意的是DNR对K562细胞的IC50为0.102 μmol/L,而DNR对K562/Adr细胞的IC50为3.116 μmol/L。上述结果表明,K562/Adr细胞对DNR有耐药作用,通过计算得出K562/Adr细胞对DNR的RI为30.54。
肿瘤MDR逆转剂是世界各国学者研究的热点,目前正尝试从天然药物中探索天然的肿瘤MDR逆转剂[7-8],众多学者将视线转向了中药吴茱萸。EVO是从吴茱萸中提取的吲哚类生物碱。外国学者研究发现,EVO作用于多种离体肿瘤细胞株,发现有明显抗侵袭以及抗转移作用,包括对黑色素瘤细胞、宫颈癌细胞、A549/DDP肺癌细胞均有抑制作用。Wang等[9]发现EVO在乳腺癌细胞中能逆转耐药。本实验采用了CCK-8法检测EVO对K562和K562/Adr细胞增殖的影响。实验结果表明,EVO能有效抑制K562和K562/Adr细胞的增殖,并呈剂量和时间依赖性,EVO对K562细胞的IC50为3.702 5 μmol/L,而对K562/Adr细胞的IC50为70.687 5 μmol/L。通过计算得出K562/Adr细胞对EVO的RI为19.09。同时发现用非细胞毒性剂量的EVO(0.125 μmol/L)与不同浓度的DNR联合作用于K562/Adr细胞后,DNR对K562/Adr细胞的IC50值明显降低,RF为12.07。结果提示,EVO在体外具有增强DNR的增殖抑制效应的作用。进一步应用倒置显微镜来观察药物(DNR、EVO、EVO+DNR)作用于K562和K562/Adr细胞后的细胞形态变化,发现对照组细胞生长良好,而药物组细胞数目明显减少。与单独使用EVO或DNR比,EVO+DNR组细胞减少更明显。同时,因为DNR是一种荧光物质[10],可通过荧光显微镜观察K562和K562/Adr细胞对DNR的摄取情况。DNR作用于K562和K562/Adr细胞2、6、12 h后,随着时间推移,细胞内荧光强度不断增强。但在同一作用时间下,联合用药组比单独DNR组荧光强度增强更为明显。流式细胞仪检测荧光阳性率的结果与荧光显微镜下观察结果一致,结果表明EVO可促进DNR进入细胞内,而进入细胞内的DNR增多,可增强DNR对细胞的增殖抑制作用。经流式细胞仪检测细胞周期也发现,联合用药后可将细胞周期阻滞在G2/M期和S期,从而进一步抑制了细胞增殖。
耐药的产生涉及机制较为复杂,是一个多基因参与的过程[11]。近年来对化疗药物耐药性机制的研究发现,耐药的原因主要是肿瘤细胞膜上存在大量的多药耐药基因蛋白[12]。目前的研究公认的白血病化疗药物引发的多药耐药性最常见和最主要的机制是ABC转运体超表达[13-15]。ABC转运蛋白超家族是一种膜结合蛋白,有8个亚家族,其中ABCB、ABCC、ABCG 3个亚家族与肿瘤细胞的MDR密切相关,研究较为清楚的有ABCB1(MDR1)、BCRP、MRP等。MDR1与BCRP是一种由多药耐药基因表达的多药耐药蛋白,它们属于ATP能量依赖性跨膜蛋白,可通过其膜泵功能将其作用底物如各种化疗药物“泵出”细胞外,使药物不能有效地到达其作用靶点而引起组织对药物的耐药现象。本实验经RT-PCR检测发现,EVO+DNR处理的K562/Adr细胞内MDRl基因的表达明显下调。同时用Western blotting检测经过各组药物处理的K562及K562/Adr细胞中BCRP、MDR1蛋白的表达,发现在单独使用EVO或者DNR的时候BCRP、MDR1蛋白的表达较对照组有微弱降低,而联合用药的时候二者降低非常明显。因此推测,EVO可能通过降低K562/Adr细胞MDR1 mRNA的表达,使细胞膜上MDR1蛋白的表达量减少,继而降低MDR1介导的细胞内化疗药物的外排能力,使细胞内药物的浓度升高而发挥逆转作用。
综上所述,EVO能有效逆转白血病K562/Adr细胞对DNR的耐药作用,而这种作用可能与EVO通过减少细胞膜上多药耐药蛋白MDR1的表达有关。更加深入的机制有待进一步的研究探明。
| [1] | 刘海晔. 中药逆转肿瘤多药耐药性的研究进展[J]. 中草药, 2015,46 (7) :1096–1102. |
| [2] | Takara K, Sakaeda T, Okumura K. An update on overcoming MDR1 mediated multidrug resistance in cancer chemotherapy[J]. Curr Pharm Des, 2006, 12 (3) :273–286 . |
| [3] | Ogasawara M, Matsubara T, Suzuki H. Inhibitory effects of evodiamine on in vitro invasion and experimental lung metastasis of murine colon cancer cells[J]. Biol Pharm Bull, 2001, 24 (8) :917–920 . |
| [4] | Ogasawara M, Matsubara T, Suzuki H. Screening of natural compounds for inhibitory activity on colon cancer cell migration[J]. Biol Pharm Bull, 2001, 24 (6) :720–723 . |
| [5] | Ogasawara M, Suzuki H. Inhibition by evodiamine of hepatocyte growth factor-induced invasion and migration of tumor cells[J]. Biol Pharm Bull, 2004, 27 (4) :578–582 . |
| [6] | 农丽, 伍钢, 戴晓芳, 等. 吴茱萸碱逆转人肺癌细胞株A549/DDP耐药机理的实验研究[J]. 临床肿瘤学杂志, 2010,15 (6) :487–492. |
| [7] | 施叶叶, 马程遥, 苗筠杰, 等. 中药多靶点逆转白血病多药耐药机制研究[J]. 中草药, 2016,47 (7) :1230–1235. |
| [8] | 张莹, 王蕾. 中药逆转肺癌多药耐药的研究新进展[J]. 药物评价研究, 2015,38 (6) :686–689. |
| [9] | Wang S P, Wang L, Shi Z, et al. Evodiamine synergizes with Doxorubicin in the treatment of chemoresistant human breast cancer without inhibiting P-glycoprotein[J]. PLoS One, 2014, 5 (9) :e97512. |
| [10] | 龚玉萍, 王燕婷, 陈芳源, 等. 柔红霉素在耐药细胞株K562/ADR内的异常分布[J]. 中华肿瘤, 2015,23 (8) :184–186. |
| [11] | Juliana E L, Kyle-Cezar F, Leite D F P, et al. Expression and activity of multidrug resistance protein 1 in a murine thymoma cell line[J]. Immunology, 2005, 114 (4) :468–475 . |
| [12] | Eckford P D, Sharom F J. P-glycoProtein (ABCB1) interacts directly with lipid-based anti-cancer drugs and Platelet-activating factors[J]. Biochem Cell Biol, 2006, 84 (6) :1022–1033 . |
| [13] | Gottesman M M, Fojo T, Bates S E. Multidrug resistance in cancer: role of ATP-dependent transporters[J]. Nat Rev Cancer, 2002, 2 (1) :48–58 . |
| [14] | Deeley R G, Cole S P. Substrate recognition and transport by multidrug resistance protein 1 (ABCC1)[J]. FEBS Lett, 2006, 580 (4) :1103–1111 . |
| [15] | Robey R W, Polgar O, Deeken J, et al. ABCG2: determining its relevance in clinical drug resistance[J]. Cancer Metastasis Rev, 2007, 26 (1) :39–57 . |
 2016, Vol. 47
2016, Vol. 47


