高脂血症引发心脑血管疾病已成为危害人类健康的首要因素[1]。研究证实,调血脂药物的应用可减少24%的心脏病死亡率和19%的非致死性心脏病发作率[2],目前临床上最为广泛使用的调血脂药物是他汀类(statin)药物,即3-羟基-3-甲基戊二酰辅酶A还原酶(HMG-CoA)抑制剂,该类药物能有效抑制胞内胆固醇合成早期限速酶还原酶,从而减少胞内游离胆固醇,加速血液中低密度脂蛋白的清除[3]。近年来,随着调血脂中药研究的不断深入,中药具有多途径、多靶点的调血脂作用,能有效防止动脉粥样硬化,且药效温和、不良反应少等优势,受到越来越多研究和使用者的青睐[4]。已有的研究证实,山楂中有效调血脂成分金丝桃苷和熊果酸,可通过可逆的磷酸化和脱磷酸化过程,抑制HMG- CoA活性,起到调节体内脂代谢作用,同时,山楂提取物能有效减轻动物肝脏内各类脂质沉积,显著保护肝脏组织的生理生化功能,对高血脂和脂肪肝具有明显的防治作用[5-8]。泽泻所含的三萜类化合物可减少胆固醇合成原料乙酰辅酶A的生成而抑制胆固醇合成[9],程志红等[10]用2种高脂血症模型大鼠观察泽泻提取物调血脂作用,结果表明泽泻提取物可抑制胆固醇在肠道的吸收而发挥作用。决明子所含蒽醌类化合物能够加快肠蠕动,促进胆固醇的排泄,减少脂类在肠道停留时间,从而减少外源性胆固醇的吸收[11];决明子提取物可使高脂血症模型大鼠的血脂明显降低,显著升高高密度脂蛋白(HDL)水平[12]。以产洛伐他汀的红曲霉为菌种发酵制备的调血脂红曲米,除富含他汀类化合物洛伐他汀,还含有红曲色素、麦角固醇和γ-氨基丁酸(GABA)等有效成分,具有调血脂、降血压、预防佝偻病等功能[13]。本实验以药食两用调血脂中药山楂、泽泻、决明子以及大米等为培养基组分,以实验室筛选的产洛伐他汀的红曲霉为菌种,将传统调血脂中药与现代发酵技术有机结合,筛选既含有传统中药调血脂成分,又含有他汀类调血脂药物的天然调血脂中药的固态发酵工艺。
1 仪器与材料1260 Infinity高效液相色谱仪,美国安捷伦科技有限公司;AR124CN电子天平,上海奥豪斯仪器有限公司;DHP-9162恒温培养箱,上海齐欣科学仪器有限公司;DHP-9030A鼓风干燥箱,上海精宏实验设备有限公司;D3024R高速离心机,美国赛洛捷克有限公司;REPROSTAR 3型薄层色谱扫描仪,瑞士卡玛公司;V-1100D可见分光光度计,上海美谱达仪器有限公司。
产洛伐他汀的红曲科红曲属紫色红曲霉Monascus purpureus Went. M2,本实验室分离保存。实验所用山楂(品种为山里红,产地河北)、泽泻(品种为川泽泻,产地四川)和决明子(品种为小决明,产地四川)均购买于成都市荷花池药材市场,经西南交通大学生命科学与工程学院宋良科副教授鉴定分别为蔷薇科山楂属植物山里红Crataegus pinnatifida Bge. var. major N. E. Br. 的干燥成熟果实、泽泻科泽泻属植物泽泻Alisma orientale (Sam.) Juzep. 的干燥块茎和豆科决明属植物小决明Cassia tora L. 的干燥成熟种子;大米为市售广汉粳米,广汉市绿丰大米加工厂。
对照品洛伐他汀(批号100600-201003,质量分数99.4%)、大黄酚(批号110796-201520,质量分数99.2%)、大黄素甲醚(批号110758-201415,质量分数99.1%)和2,3-乙酰泽泻醇-B(批号111846-201504,质量分数99.0%)均由中国食品药品检定研究院提供;对照品熊果酸(批号77-52-1,质量分数98.0%)由四川先欣生化技术研究所提供;对照品GABA(批号041023,质量分数99.0%)由上海源聚生物科技有限公司提供。甲醇和乙腈(色谱纯)购自Sigma公司。无水乙醇、硝酸钠、磷酸二氢钾、硫酸镁、磷酸、甲醇、石油醚、醋酸乙酯、甲酸、四硼酸钠、次氯酸钠溶液、苯酚,分析纯,成都科龙化工试剂厂;甘油、蛋白胨、酵母膏,北京奥博星生物技术有限责任公司。
2 方法与结果 2.1 培养基制备 2.1.1 麦芽汁斜面培养基10°Bx麦芽汁、2%琼脂粉,pH值自然。
2.1.2 液体种子培养基[14]3%大米粉、3%葡萄糖、1.5%蛋白胨、0.2% NaNO3、0.15% KH2PO4、0.1% MgSO4·7H2O,pH值自然。
2.1.3 大米固态发酵培养基[14]大米50 g、0.4% NaNO3、0.3% KH2PO4、0.3% MgSO4·7H2O、3%酵母膏、4%蛋白胨、3%甘油,pH值自然。
2.1.4 中药大米固态发酵培养基在大米固态发酵培养基中,根据实验要求按一定比例加入中药粉末(60 ℃烘干后粉碎,过50目筛)。
2.2 菌种和发酵培养方法 2.2.1 斜面种子培养红曲菌M2接种斜面后,30 ℃培养至菌丝长满斜面且转变为红色。
2.2.2 液态种子培养液体种子培养基经0.1 MPa 121 ℃灭菌20 min,接种斜面种子,30 ℃ 200 r/min摇瓶培养48 h作为中药红曲固态发酵种子液。
2.2.3 中药红曲固态发酵根据实验设计要求,将大米、山楂、泽泻和决明子等培养基组分,按不同比例配制成固态发酵培养基,经0.1 MPa 121 ℃灭菌30 min,冷却至室温,接种液态种子,然后根据实验要求进行恒温培养。
2.3 中药红曲固态发酵产物中有效成分测定 2.3.1 洛伐他汀测定方法[15](1)色谱条件:色谱柱为Welchrom TM C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-水(75:25),体积流量为1 mL/min,柱温为22 ℃,检测波长为246 nm,进样量为10.0 μL。
(2)线性关系及方法学考察:精密称取洛伐他汀对照品,用75%乙醇配制成质量浓度为484.0 μg/mL的对照品溶液。按上述色谱条件分别以2.0、4.0、6.0、8.0、10.0 μL的进样量进样分析,以对照品的进样量为横坐标(X),峰面积值为纵坐标(Y)作图,得到洛伐他汀的标准曲线,线性回归方程为Y=2 269 X+15.15,R2=0.999 9,表明洛伐他汀在5.01~42.38 μg/mL时质量浓度与峰面积线性关系良好。方法学考察表明,在本色谱条件下精密度RSD为0.29%(n=6),重复性RSD为0.05%(n=6),36 h内稳定性RSD为0.78%(n=6),平均回收率为98.4%,RSD为1.88%(n=6)。
(3)发酵产物中洛伐他汀定量测定:取65 ℃烘干的样品适量,研磨,过200目筛,精确称取0.5 g,75%乙醇溶液定容至25 mL,超声30 min,8 000 r/min离心3 min,上清即为样品溶液,然后按上述方法测定洛伐他汀的量。
2.3.2 GABA的测定(1)GABA标准曲线制作:精密称取GABA对照品配置1 mg/mL标准液,然后按文献方法[16]进行操作,获得GABA标准曲线,回归曲线方程为Y=0.421 1 X+0.031 5,R2=0.999 1,结果表明GABA在0.78~6.87 μg/mL线性关系良好。
(2)发酵产物中GABA定量测定:精确称取按“2.3.1(3)”项方法制得中药红曲细粉0.5 g,以去离子水定容至25 mL,浸提过夜,取一定量浸提液,沸水浴5 min,冷却后12 000 r/min离心15 min,取上清1 mL于50 mL量瓶中,定容后混匀,取1 mL,按标准曲线测定方法测定发酵液中GABA的量。
2.3.3 熊果酸的测定[17](1)色谱条件:色谱柱为WelchromTM C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水溶液(85:15),体积流量为0.8 mL/min,柱温为室温,检测波长为210 nm,进样量10.0 μL。
(2)线性关系及方法学考察:精确称取熊果酸对照品用色谱甲醇配制为质量浓度465.0 μg/mL溶液。按上述色谱条件分别以2.0、4.0、6.0、8.0、10.0 μL的进样量进样分析。以对照品的进样量为横坐标(X),峰面积值为纵坐标(Y)作图,得到回归方程为Y=478.9 X+8.883,R2=0.999 9,表明熊果酸在3.25~64.92 μg/mL时质量浓度与峰面积线性关系良好。方法学考察表明,在本色谱条件下精密度RSD为0.34%(n=6),重复性RSD为0.26%(n=6),24 h内稳定性RSD为1.23%(n=6),平均回收率为98.76%,RSD为1.38%(n=6)。
(3)发酵产物中熊果酸定量测定:精确称取按“2.3.1(3)”项方法制得中药红曲细粉0.5 g,精确称取0.5 g,甲醇溶液定容到25 mL,超声30 min,8 000 r/min离心5 min,上清即为样品溶液,然后按上述方法测定熊果酸的量。
2.3.4 2,3-乙酰泽泻醇-B的测定[18](1)色谱条件:色谱柱为WelchromTM C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水溶液(85:10),体积流量为0.8 mL/min,柱温为室温,检测波长为210 nm,进样量10.0 μL。
(2)线性关系及方法学考察:用乙腈溶解2,3-乙酰泽泻醇-B对照品配制质量浓度为272.0 μg/mL的对照品溶液,分别以2.0、4.0、6.0、8.0、10.0 μL的进样量进样分析,按色谱条件测定峰面积。以对照品的进样量值为横坐标(X),峰面积为纵坐标(Y)作图,得到2,3-乙酰泽泻醇-B的标准曲线为Y=476.19 X+2.714,R2=0.999 9,2,3-乙酰泽泻醇-B在0.33~3.98 μg/mL时质量浓度与峰面积线性关系良好。方法学考察表明,在本色谱条件下精密度RSD为0.80%(n=6),重复性RSD为0.63%(n=6),36 h内稳定性RSD为1.57%(n=6),平均回收率为98.76%,RSD为1.05%(n=6)。
(3)发酵产物中2,3-乙酰泽泻醇-B定量测定:精确称取按“2.3.1(3)”项方法制得中药红曲细粉0.5 g,置于磨口瓶中,加入乙腈4 mL,超声30 min,室温放冷,8 000 r/min离心5 min,上清液即为样品溶液,然后按上述方法测定2,3-乙酰泽泻醇-B的量。
2.3.5 大黄酚和大黄素甲醚的测定[19](1)色谱条件:色谱柱为WelchromTM C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.1%磷酸水溶液(82:18),体积流量为1.0 mL/min,柱温为30 ℃,检测波长为254 nm,进样量10.0 μL。
(2)线性关系及方法学考察:精密称取大黄酚和大黄素甲醚对照品,用甲醇溶解配制质量浓度分别为72.0 μg/mL的大黄酚对照品溶液和34.0 μg/mL的大黄素甲醚对照品溶液。按上述色谱条件分别以2.0、4.0、6.0、8.0、10.0 μL的进样量进样分析,以进样量为横坐标(X),峰面积值为纵坐标(Y)作图,得到大黄酚、大黄素甲醚的标准曲线回归方程分别为Y=715.00 X+0.123,R2=0.999 9;Y=382.0 X+0.172,R2=0.999 9,分别在7.08~71.50 μg/mL和7.78~79.20 μg/mL时质量浓度与峰面积线性关系良好。方法学考察表明,在本色谱条件下大黄酚、大黄素甲醚精密度RSD分别为0.10%、0.24%(n=6),重复性RSD分别为0.70%、0.48%(n=6),24 h内稳定性RSD分别为0.89%、1.05%(n=6),平均回收率分别为98.83%、98.86%,RSD分别为1.02%、1.13%(n=6)。
(3)发酵产物中大黄酚和大黄素甲醚定量测定:精确称取按“2.3.1(3)”项方法制得中药红曲细粉1 g,加入25 mL甲醇,加热回流0.5 h,滤过,滤液减压蒸干,残渣加15 mL体积分数为8%的盐酸溶液溶解,再加20 mL氯仿,回流1 h,放冷,置分液漏斗中,取氯仿层,酸液再用氯仿提取3次,每次20 mL,合并氯仿液,减压蒸干,加甲醇溶解,转移至25 mL量瓶中,定容,摇匀、滤过,上清即为样品溶液,然后按上述方法测定大黄酚和大黄素甲醚。
2.4 培养基中中药配比的确定按大米与中药的不同比例配制培养基,根据灭菌前后培养基状态,发酵状况和发酵后洛伐他汀的量,确定大米与中药的配比,当确定大米与中药配比后,按不同比例加入山楂、泽泻、决明子制备培养基,根据培养基状态、发酵情况和发酵后洛伐他汀的量确定3种中药在培养基中的比例。
传统中药红曲是以大米为原料通过固态发酵红曲霉菌制得,虽然调血脂中药山楂、泽泻和决明子含有丰富糖类物质,可被红曲霉菌作为有效碳源,但研究结果表明大米与中药(山楂-泽泻-决明子1:1:1)比例为9:1、8:2、7:3、6:4、5:5时洛伐他汀产量分别为2.489、2.447、2.438、2.435、1.772 mg/g),当培养基中大米与中药比例为5:5时,中药粉末不能完全黏附在米饭颗粒上,影响中药发酵,使得产品中洛伐他汀的量显著降低;大米干质量与中药干质量比为6:4时,米饭粒能够充分黏附中药粉末,灭菌后,培养基松散,软硬适中,三角瓶底部没有散落中药粉。大米与中药配比为9~7:1~3发酵产物中洛伐他汀的量相当,为了保证在培养基中尽可能多添加降脂中药山楂、泽泻和决明子,因此本实验选择固态发酵培养基中大米与中药配比为6:4。
在确定培养基中大米与中药比例为6:4之后,进一步对培养基中山楂-泽泻-决明子比例(2:1:1、1:2:1、1:1:2时洛伐他汀分别为2.437、2.018、1.356 mg/g)进行了研究,结果表明当山楂、泽泻、决明子配比为2:1:1时,培养基中菌丝生长较快,且洛伐他汀产量较高,因此在本实验后续研究中,中药固态混合发酵培养基中大米、山楂、泽泻和决明子配比采用6:2:1:1的比例。
2.5 红曲固态发酵工艺优化在确定了培养基中大米、山楂、泽泻和决明子加入量及比例后,以洛伐他汀产量为指标,对中药红曲固态发酵过程中培养基pH值,培养过程中打散时间,红曲菌种子的种龄、接种量,培养基装量,发酵过程中的补水量,变温培养和培养时间等工艺参数进行了研究,以期获得中药红曲固态发酵合适工艺条件。
2.5.1 发酵培养基合适pH值的确定沈平等[14]与王龙等[20]研究红曲霉菌大米固态发酵时发现,酸性环境有利于霉菌菌丝生长和代谢产物洛伐他汀的积累。本实验用乙酸将中药大米固态培养基调配成不同pH值,接种红曲霉菌发酵后测定产物中洛伐他汀的量,结果pH值分别为3.0、3.5、4.0、4.5、pH自然(5.25)时洛伐他汀分别为2.240、2.627、2.820、2.700、2.560 mg/g,表明pH值对中药红曲发酵代谢产物洛伐他汀形成具有显著的影响,其中培养基pH值为4.0时,发酵产物中洛伐他汀产量最高,达到2.820 mg/g,说明中药红曲发酵培养基合适pH值为4.0。
2.5.2 打散时间的影响丝状真菌固态发酵过程中,随着菌丝的不断生长,培养基与菌丝之间会结块,培养基结块后会导致通气不畅,进而影响菌体的生长和代谢产物的形成。在丝状真菌固态发酵的早期,合适的时候将结块的培养基打散,不但能起到使培养基通气畅通,而且更主要的是将菌丝打断更有利于菌体的生长繁殖与后期代谢产物的形成。本实验在考察固态发酵不同时间打散培养基时发现,接种后第1天菌丝生长较少,打散后菌丝生长缓慢;第2天菌丝生长较多,培养基较易打散;随着时间增加,菌丝生长越多,结块的培养基打散越困难,培养5 d以后结块培养基甚至根本不能打散。结果培养基打散时间为1、2、3、4 d时,洛伐他汀的量分别为2.681、3.203、3.000、2.206 mg/g,表明第2天打散结块的发酵培养基,发酵样品中洛伐他汀产量最高,达到3.203 mg/g,过早或过晚打散培养基都将导致洛伐他汀产量下降,与王启军等[21]研究结果过早或过频地翻曲会影响菌体的初期生长,损伤菌丝体相一致。在实验过程中还发现,中药大米固态发酵培养基较大米固态培养基菌丝生长更快,若在发酵早期不及时打散结块的培养基,后期将无法打散而影响发酵产物的形成。
2.5.3 正交试验优化种子的种龄、接种量、培养基装量、补水量按4因素3水平的L9(34)正交表进行正交试验,以发酵产物中洛伐他汀的产量为指标,确定种子的种龄、接种量和培养基的装量及加水量等中药固态发酵的合适条件。种龄、接种量、装量、补水量正交试验设计与结果如表 1所示。极差(R)分析显示,4个因素对洛伐他汀产量的影响大小依次为种龄>补水量>接种量>装量,其中种龄影响最大,其次为补水量,而培养基装量影响最小。正交试验第6号实验条件(48 h的种龄,15%的接种量,80 g的装量和24%的补水量)发酵的红曲发酵产物中洛伐他汀产量为最高,达到3.751 mg/g。由于15%和10%的接种量对洛伐他汀产量影响较小,接种量越大会增加种子生产成本,所以选择10%接种量;正交试验结果培养基装量对洛伐他汀产量影响K2>K3>K1,所以培养基装量选择100 g。综上分析结果获得中药红曲固态发酵合适的菌种种子种龄为48 h,接种量10%,装量100 g,补水量24%。
|
|
表 1 正交试验设计与结果 Table 1 Design and results of orthogonal test |
2.5.4 变温时间对中药红曲发酵的影响
微生物生长繁殖与次生代谢产物的形成过程中所参与的生物酶种类及其所需酶活性往往是不一致的,在发酵工业中通常采用调节培养温度的方法来达到既满足微生物生长繁殖又能提高微生物次生代谢产物产量的目的。中药红曲发酵培养过程中变温时间对洛伐他汀产量的影响结果表明,变温培养时间3、4、5、6、7、8 d时洛伐他汀产量分别为2.367、3.240、4.314、4.054、3.433、3.160 mg/g,中药红曲固态培养基接种后,30 ℃恒温培养不同时间,转到25 ℃继续恒温培养到12 d,发酵产物中洛伐他汀产量存在差异。以接种后30 ℃恒温培养到第5天转到25 ℃继续恒温培养到12 d洛伐他汀产量最高,达到了4.314 mg/g,分别比接种后30 ℃培养到第3天和第8天转到25 ℃继续恒温培养到12 d增加82.26%和36.52%。与文献所报道大米红曲的分阶段变温培养结果一致[22]。
2.5.5 固态发酵培养时间的确定在最优条件下进行固态发酵,自第6天起隔天取样测定发酵产物中洛伐他汀的量,实验结果显示,培养6、8、10、12、14、16、18、20、22 d时洛伐他汀产量分别为1.853、2.867、3.727、4.334、4.674、4.932、5.127、5.118、5.123 mg/g),随着培养时间的增加,发酵产物中有效成分洛伐他汀产量逐渐增加,当培养到18 d时,洛伐他汀产量达到5.127 mg/g,较优化前的2.280 mg/g提高124.8%,继续培养发酵产物中洛伐他汀产量几乎不再增长,因此中药红曲发酵合适培养时间为18 d。
2.6 中药红曲固态发酵产物有效成分分析 2.6.1 中药红曲固态发酵产物成分TLC分析按文献方法[23]稍作修改,分别取大米红曲1.0 g,中药红曲固态发酵产物1.0 g,山楂、泽泻和决明子2:1:1混合物1.0 g,加入甲醇50 mL,超声处理30 min,滤液蒸干,加甲醇1 mL溶解,作为样品溶液,以石油醚-醋酸乙酯-甲酸(15:5:1)为展开剂展开,分别于日光、365 nm波长紫外光和氨气熏蒸后检视薄层板。从图 1所示实验结果可以看到,在紫外光(图 1-A)和日光(图 1-B)下,清晰可见中药红曲(图 1-A-2和图 1-B-2)和大米红曲(图 1-A-3和图 1-B-3)有多个对应点,中药红曲固态发酵产物样品斑点数明显多于大米红曲,说明其中含有更多成分。特别是在薄层板溶剂前沿附近,中药红曲固态发酵产物样品有1个明亮黄色荧光点(图 1-A-2),而在大米红曲(图 1-A-3)和中药混合药材(图 1-A-4)样品中都没有出现,该物质据推测可能是在中药红曲固态发酵过程中,经过红曲菌生物转化产生新的物质,或者是中药中被释放出来的某一成分。为了进一步鉴定中药红曲固态发酵产物中多出的发黄色荧光物质,将大黄酚对照品、大米红曲、中药红曲固态发酵产物、中药混合样品点样在同一硅胶G板上,紫外光365 nm下发现中药红曲固态发酵产物中多出的点与大黄酚对照品的黄色荧光点对应(图 1-A);日光下,观察结果与紫外光365 nm下一致(图 1-B);经氨蒸汽熏蒸,中药红曲固态发酵产物中多出的点同变为粉红色,与大黄酚一致(图 1-C),因此推测在中药红曲固态发酵样品中增加的产物可能是大黄酚,而未发酵中药混合样没有出现对应斑点,可能是因为在该提取条件下该成分没有被提取出来或其量太低,进一步说明中药经红曲霉发酵后中药有效成分的量得到提高。
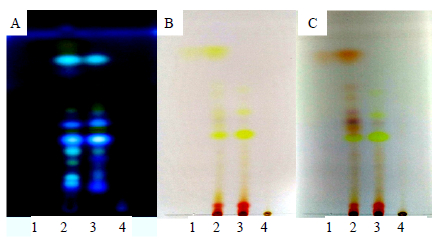
|
图 1 中药红曲TLC图 Fig.1 TLC of monascus |
2.6.2 中药红曲固态发酵产物与大米红曲中洛伐他汀和GABA比较
按照“2.3”项中药红曲固态发酵产物中有效成分测定的方法,对中药红曲固态发酵产物和大米红曲样品中洛伐他汀和GABA的量进行了分析,结果表明分别为洛伐他汀5.127、3.677 mg/g,GABA 34.114、41.548 mg/g,中药红曲固态发酵产物中洛伐他汀产量较大米红曲高42.27%,而大米红曲中GABA产量高于中药红曲固态发酵产物21.79%,说明红曲固态发酵培养基中加入中药有助于红曲霉菌洛伐他汀次生代谢产物的生成,中药红曲固态发酵产物GABA产量较大米红曲低,推测可能是中药中某些成分对红曲霉菌GABA代谢物合成有抑制效果。
2.6.3 中药红曲发酵前后各中药中调血脂成分的量比较已有的研究证实[6, 9, 12],调血脂中药山楂、泽泻和决明子的主要降脂成分分别为熊果酸、2,3-乙酰泽泻醇-B、大黄酚和大黄素甲醚,为了弄清中药红曲发酵是否会影响这些有效成分的量,本实验采用“2.3”项中药红曲固态发酵产物中有效成分测定的方法,对中药红曲发酵前后样品中各有效成分的量进行分析,结果如表 2所示,中药红曲固态发酵产物中各中药的主要成分的量均有较大的升高,熊果酸的量较未发酵培养基升高232.7%,2,3-乙酰泽泻醇-B的量升高173.7%,升高最为明显的是大黄酚和大黄素甲醚,与发酵前相比分别升高767.6%和888.4%。目前利用微生物发酵转化中药活性成分已成为中药现代化研究的热门课题,已有文献报道所涉及的中药主要有效成分包括黄酮类、生物碱、萜类、皂苷类以及多酚类等[24-26]。戴万生等[27]将大黄经酒精酵母、面包酵母发酵后,结合型蒽醌的量降低,游离型蒽醌的量增加6倍,与本实验中大黄酚和大黄素甲醚的量提高7.67倍和8.88倍结果相近。
|
|
表 2 未发酵基质与发酵产物各有效成分的量对比 Table 2 Comparison on contents of active ingredients in unleavened products |
2.7 中药红曲固态发酵工艺中试规模验证试验
在确定按大米-山楂-泽泻-决明子以6:2:1:1比例,培养基pH值为4,500 mL三角瓶装100 g培养基,灭菌后接种48 h种子液10 mL,30 ℃培养2 d后打散培养基,第3天加入24%无菌水,5 d后降温至25 ℃继续培养至18 d的中药红曲固态发酵优化工艺后,在1 000 mL三角瓶规模,对所优化的中药红曲固态发酵工艺进行了4批次的验证试验。4批固态发酵实验获得的发酵产物中各成分的量分析结果如表 3所示,结果显示,中试规模验证试验各批次中洛伐他汀、GABA、熊果酸、2,3-乙酰泽泻醇-B、大黄酚、大黄素甲醚的量均不低于优化试验,说明该工艺重复性较好。
|
|
表 3 1 000 mL三角瓶固态发酵产物中各成分测定结果 Table 3 Contents of each ingredient in fermentation products cultured in 1 000 mL triangular flask |
本实验研究获得的山楂、泽泻、决明子与红曲霉混合发酵制备调血脂中药最优工艺为大米-山楂-泽泻-决明子以6:2:1:1比例,培养基pH值为4,灭菌后按10%的接种量接种48 h种子液,30 ℃培养2 d后打散培养基,第3天加入24%无菌水,5 d后降温至25 ℃继续培养至18 d。该工艺无论是在500 mL三角瓶还是1 000 mL三角瓶规模所获得的发酵产物有效成分的量稳定,因此本实验研究获得的调血脂中药发酵工艺具有一定的实际应用价值。
3 讨论本实验将他汀类降脂药物和传统降脂中药融为一体,结合传统中药和现代发酵技术得以实现。以传统药食两用降血脂中药为固态发酵培养基组分,以实验室分离纯化的紫色红曲霉M2菌株为菌种进行固态发酵,得到1种天然降脂产物。在发酵过程中,红曲霉菌在利用中药中的糖类、蛋白等营养物质进行生长繁殖和产生代谢产物的同时,还可以对中药中的一些成分进行生物转化,并分解中药中某些有毒成分,提高中药活性成分效价,降低中药的某些毒性;另外,中药中的某些成分亦能促进红曲霉菌的生长和活性代谢产物的产生。
在发酵产物中,中药材中各降脂有效成分得以保留,同时也含有红曲代谢产生的具有调血脂、降压功效的洛伐他汀、GABA等次级代谢产物,发酵产物无需经过繁琐的提取过程,可直接使用。本实验使用常见天然原材料,原料易得且价格较低;固态发酵对设备要求低、能耗低、水消耗量少、无污染、无废物产生;发酵产物无需复杂的提取分离过程,可全部利用,进一步降低生产成本,具有实际应用价值。以食用菌对天然中药进行转化,产生安全的降脂产品,可以对未来降脂产品开发和应用具有指导意义。发酵产物中成分复杂,后续研究应对其进行有效成分种类和定量分析,并对其降脂效果进行药效学评价。
| [1] | James S, John J P, Vera B, et al. Effect of intensive lipid lowering with atorvastatin on renal function in patient with coronary heart disease: the treating to new drugs (TNT) study[J]. Clin J Am Soc Nephrol, 2007, 2 (6) :1131–1139 . |
| [2] | Rutishauser J. Statins in clinical medicine[J]. Swiss Med Weekly, 2011 . doi:10.4414/smw.2011.13310 |
| [3] | 赵丽平. 常用降血脂药物及临床应用[J]. 中国民族民间医药, 2008,17 (3) :10–11. |
| [4] | 罗千古. 中药对高脂血症的作用机制[J]. 中国医药导报, 2010,7 (1) :85–86. |
| [5] | 王景文, 孙兰军, 董村, 等. 血脂胶囊治疗高脂血症的临床疗效观察[J]. 现代药物与临床, 2014,29 (7) :804–807. |
| [6] | 兰鸿, 杜士明. 山楂提取物防治高脂症实验研究[J]. 中国现代药物应用, 2009,3 (24) :3–5. |
| [7] | 杨方才. 山楂降脂汤治疗高脂血症疗效观察[J]. 中国中医急症, 2009,18 (5) :692–693. |
| [8] | 吴士杰, 李秋津, 肖学凤, 等. 山楂化学成分及药理作用的研究[J]. 药物评价研究, 2010,33 (4) :316–319. |
| [9] | 师建平. 中医药治疗高血脂症的现状[J]. 内蒙古医学院学报, 2012,34 (5) :828–831. |
| [10] | 程志红, 吴闻哲, 于垂亮, 等. 泽泻提取物对两种高脂血症大鼠模型的降脂作用的比较[J]. 现代中药研究与实践, 2010,24 (1) :40–42. |
| [11] | 刘浩然. 中药降脂活性成分药理作用研究概述[J]. 湖南中医药导报, 2002,8 (12) :742–745. |
| [12] | 李楚华, 李续娥, 郭宝江. 决明子提取物降脂作用的研究[J]. 华南师范大学学报: 自然科学版, 2002 (4) :29–32. |
| [13] | 卓林霞. 红曲的研究概况及其产品的前景展望[J]. 轻工科技, 2012,28 (2) :8–9. |
| [14] | 沈平, 伍军, 李浩然, 等. 红曲固态发酵生产洛伐他汀的实验条件优化[J]. 北京农学院学报, 2005,20 (3) :47–51. |
| [15] | 温中明, 张法, 黄毅, 等. 脂必泰胶囊中红曲含量测定[J]. 药物鉴定, 2011,20 (13) :21–23. |
| [16] | 王芳权, 陈蔚青, 陈红. 比色法快速测定酶转化反应中γ氨基丁酸质量分数[J]. 氨基酸和生物资源, 2006,28 (2) :78–81. |
| [17] | 崔洪泉, 蒋秀芳. 高效液相色谱法测定山楂药材中齐墩果酸和熊果酸的含量[J]. 临床合理用药, 2011,4 (7) :109–110. |
| [18] | 中国药典 [S]. 一部. 2015. |
| [19] | 王宾豪, 杨荣平, 张小梅, 等. 高效液相色谱法测定决明子中蒽醌类成分的含量[J]. 时珍国医国药, 2008,19 (1) :135–137. |
| [20] | 王龙, 朱正军, 饶铖乐, 等. 功能性红曲酒酿造工艺研究[J]. 酿酒科技, 2013,29 (7) :41–45. |
| [21] | 王启军, 孙小燕, 张水华, 等. 发酵瓶及相关工艺条件对红曲固态发酵产Monacolin K的影响[J]. 食品科技, 2008,33 (4) :9–11. |
| [22] | Xu B J, Wang Q J, Jia X Q, et al. Enhanced lovastatin production by solid state fermentation of Monascus ruber[J]. Biotechnol Biop Eng, 2005, 10 (1) :78–84 . |
| [23] | 邢旺兴, 陈士景, 宓鹤鸣, 等. 中药红曲的薄层色谱法鉴别[J]. 药学实践杂志, 2000,18 (2) :93–95. |
| [24] | 王园园, 余伯阳, 李星, 等. 灰色链霉菌对芦丁的生物转化及产物的抗氧化活性[J]. 中国天然药物, 2006,4 (1) :66–69. |
| [25] | 占纪勋, 郭洪祝, 韩健, 等. 华根霉和雅致小克银汉霉对青蒿素的生物转化研究[J]. 中草药, 2002,33 (10) :869–872. |
| [26] | 董阿玲, 崔亚君, 郭洪祝, 等. 人参皂苷Rg1的微生物转化研究[J]. 中国药学, 2001,10 (3) :115–118. |
| [27] | 戴万生, 赵荣华. 发酵法对大黄蒽醌类成分含量的影响[J]. 云南中医中药杂志, 2005,6 (1) :38–39. |
 2016, Vol. 47
2016, Vol. 47


