2. 天津药物研究院, 天津 300193 ;
3. 淮海工学院, 江苏连云港 222005
2. Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China ;
3. Huaihai Institute of Technology, Lianyungang 222005, China
作为疏风解毒胶囊的原料药材之一,黄花败酱最早收载于《神农本草经》,系败酱科败酱属植物黄花败酱Patrina scabiosaefolia Fisch. ex Trev.的全草,为我国传统中药,其性微寒,味苦、辛,归肺、大肠、肝经,具有清热解毒、排脓破瘀之功效[1]。近年来对黄花败酱化学成分的研究也在不断深入,据文献报道其主要成分为三萜皂苷类化合物,其次为环烯醚萜类、香豆素和黄酮类化合物,此外也含有少量挥发油和有机酸等[2-4]。其中三萜皂苷类成分是黄花败酱草中主要活性成分,现代药理学研究表明其具有抗肿瘤、镇静催眠、抗炎、利尿等[5-6]活性。目前只有潘涛等[7]利用正交设计法以总皂苷浸出量和浸膏得率为评价指标考察了黄花败酱总皂苷(TSPS)的提取工艺,且有黄花败酱甲醇提取物治疗溃疡性结肠炎的报道[8],而未见其他关于优化TSPS的提取工艺及其对胃肠道功效的研究报道。因此,本实验以总皂苷的提取率为评价指标,采用响应曲面法优化TSPS的提取工艺;同时也首次探讨了TSPS提取物大鼠离体肠平滑肌的收缩功效,并利用该体外实验模型进一步评价提取工艺,旨在从工艺参数和体外活性两方面综合评价,以便于获得高提取收率和高活性的TSPS提取工艺条件,确定最佳提取工艺参数,为黄花败酱药材的后续开发利用奠定基础。
1 仪器与材料MT5百万分之一电子天平,梅特勒-托利多(中国)公司;KQ5200E型超声波清洗器、KQ-500E型超声波清洗器,昆山市超声仪器有限公司;TU-1901双光束紫外可见分光光度仪,北京普析通用仪器有限责任公司;FA1204B电子天平,上海精密科学仪器有限公司;SZ-93自动双重纯水蒸馏器,上海亚荣生化仪器厂;BL-410生物机能实验系统,四川成都泰盟科技电子有限公司;HW-400S恒温平滑肌浴槽,四川成都泰盟科技电子有限公司;FT-100生物张力传感器,中国北京航天医学工程研究所。
黄花败酱2015年9月采自辽宁省丹东市凤城通远堡镇大黑山村,经辽宁省药品检验所王维宁研究员鉴定为败酱科败酱属植物黄花败酱Patrina scabiosaefolia Fisch. ex Trev.的全草。其标本保存于武警后勤学院生药学教研室。齐墩果酸(KMST-Q016,质量分数≥98%)、芦丁(KMST-L020,质量分数≥98%)对照品,天津科曼思特天然产物研究开发有限公司;香草醛、冰醋酸、高氯酸等试剂均为分析纯,天津百赛斯生物科技有限公司;乙醇、甲醇均为国产AR级试剂,娃哈哈纯净水。氯化乙酰胆碱,批号Lot. No.20150323,质量分数≥98%,天津熙拓精纽化工科技;硫酸阿托品,批号:1509051,质量浓度0.5 mg/mL,天津金耀药业有限公司。
昆明种SD雄鼠63只,体质量为(200±20)g,随机分为21组,每组3只。其中有4组进行TSPS对十二指肠、空肠、回肠、结肠作用的离体实验研究,另外17组进行响应面工艺提取获取的17组不同提取率的TSPS的离体动物实验研究。实验动物由军事医学科学院实验动物中心提供;许可证号:SCXK-2007-004,实验用大鼠于(23±2)℃,湿度(60±5)%条件下适应性饲养1周以后进行实验。
2 方法与结果 2.1 定量测定方法 2.1.1 对照品溶液的制备[9-10]精密称取齐墩果酸对照品116.38 mg,置于50 mL棕色量瓶中,80%乙醇定溶,摇匀,即得2.327 6 mg/mL齐墩果酸对照品溶液。
2.1.2 供试品溶液的制备准确称取100 g干燥粉碎后的黄花败酱药材(过20目筛),置于3 L圆底烧瓶中,加入体积分数为80%乙醇1 200 mL于90℃下回流提取2次,每次2 h,滤过,合并提取液,备用。
2.1.3 显色方法取待测溶液1 mL,置于10 mL容量瓶中,依次加入5%香草醛-冰醋酸溶液0.4 mL,高氯酸溶液1.4 mL,混匀。置60℃水浴25 min,流水冷却后加5 mL冰醋酸,80%乙醇(色谱纯)定溶至10 mL。用1 mL 80%乙醇代替对照品溶液按上述方法配制空白溶液。
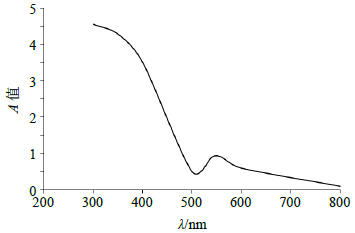
2.1.4 测定波长的选择取对照品溶液1 mL,按“2.1.3”项下方法显色后,紫外分光光度计在200~800 nm进行全波长扫描,结果如图 1所示。反应液在550 nm处有明显特征峰。因此选取可见区域550 nm的特征吸收峰位作为检测波长。
|
图 1 对照品紫外吸收光谱图 Fig.1 UV absorption spectrum of reference substance |
2.1.5 干扰试验
由于黄花败酱中还含有黄酮类成分,为避免其干扰总皂苷的定量测定,使定量测定结果更为准确。因此,进行1组干扰试验。精密称取芦丁对照品14.31 mg,置于50 mL棕色量瓶中,80%乙醇定溶,摇匀,即得286.2μg/mL芦丁对照品溶液。精密移取芦丁对照品溶液1 mL,按“2.1.3”项下方法显色后,在550 nm处平行测定3次,测得吸光度(A)值为0.002,因此,可以确定黄花败酱中黄酮类成分未干扰到三萜类成分的定量测定。
2.1.6 线性范围考察精密吸取齐墩果酸对照品溶液0.03、0.06、0.09、0.12、0.15、0.18 mL置于10 mL量瓶中加入色谱甲醇定容至刻度,摇匀,按“2.1.3”项下方法显色后,在550 nm下测定A值。每个质量浓度平行测定3次,取平均值。以齐墩果酸质量浓度为横坐标(X),A值为纵坐标(Y)绘制标准曲线,计算回归方程。实验结果显示齐墩果酸在6.928 2~41.896 8μg/mL与A值呈现良好的线性关系,所得回归方程为Y=0.022 3 X+0.076 1,R2=0.999 4。
2.1.7 精密度试验精密移取对照品溶液1 mL,置于10 mL量瓶中,按“2.1.3”项下方法显色后,在550 nm处平行测定A值5次,计算RSD值为1.26%,表明在该条件下仪器精密度良好。
2.1.8 稳定性试验取同一供试品溶液,按“2.1.3”项下方法操作,分别于0、2、4、6、8、10、12 h测定其A值,计算RSD值为1.08%,表明供试品溶液在12 h内稳定。
2.1.9 重复性试验取同一份样品5份,按“2.1.2”项下方法制备供试品溶液,按“2.1.3”项下方法显色后,在550 nm处平行测定其A值,计算质量分数的RSD值为0.97%,表明该方法重复性良好。
2.1.10 加样回收率试验称取已知总皂苷量的黄花败酱药材1 g,分别加入相当于样品中总皂苷量80%、100%、120%的对照品溶液。按“2.1.2”项下方法进行制备,按“2.1.3”项下显色,在550 nm处平行测定其A值3次,计算得加样回收率均在95%~105%,平均回收率为98.65%,RSD值为1.58%,回收率良好。
2.2 单因素考察 2.2.1 提取溶剂考察按“2.1.2”项下方法分别考察提取溶剂体积分数为60%、70%、80%、95%乙醇及甲醇对TSPS提取效果的影响,结果TSPS提取率分别为6.03、8.33、8.81、5.86、4.35 mg/g。实验结果显示单因素考察提取溶剂时80%乙醇对总皂苷的提取效果最佳。
2.2.2 料液比考察按照“2.1.2”项下方法分别考察料液比为1:8、1:10、1:12、1:16、1:20对TSPS提取效果的影响,结果TSPS提取率分别为4.47、6.87、10.52、9.32、8.56 mg/g。实验结果显示当料液比低于1:12时,总皂苷的提取效果随着料液比升高而增加,而当提料液比大于1:12时,总皂苷提取效果变化略有下降。因此初步确定1:12为最佳料液比。
2.2.3 提取时间考察按照“2.1.2”项下方法分别考察提取时间为0.5、1.0、1.5、2.0、2.5 h对TSPS提取效果的影响,结果TSPS提取率分别为6.29、8.18、10.84、9.08、6.58 mg/g。实验结果显示当提取时间低于1.5 h时,总皂苷的提取效果随着提取时间升高而增加,而当提取时间长于1.5 h时,总皂苷提取效果随着提取时间的增加而略有降低。故确定1.5 h为最佳提取时间。
2.2.4 提取温度考察按照“2.1.2”项下方法分别考察温度为70、80、90、100℃对TSPS提取效果的影响,结果TSPS提取率分别为8.09、9.54、9.89、8.67 mg/g。实验结果显示当提取温度低于90℃时,总皂苷的提取效果随着提取温度升高而增加,而当提取温度高于90℃时,总皂苷提取效果随着提取温度的增加而降低。故确定90℃为最佳提取温度。
2.2.5 提取次数考察按照“2.1.2”项下方法分别考察提取1、2、3次对TSPS提取效果的影响,结果TSPS提取率分别为8.39、5.32、2.58 mg/g。实验结果显示当提取1次时,总皂苷的提取率相对较多,而当提取第2次时,总皂苷提取已较为完全,故确定提取2次为最佳提取次数。
2.3 动物实验 2.3.1 标本制备大鼠禁食12 h,木槌击鼠头枕部至晕,剖开腹腔,以胃幽门与十二指肠交界处为起点,迅速剪取十二指肠、空肠、回肠、结肠,将其剪成约2 cm的肠段,置于盛有0℃Tyrode’s液(Tyrode’s生理溶液:氯化钠136.9 mmol/L,氯化钾2.7 mmol/L,磷酸二氢纳0.4 mmol/L,碳酸氢钠11.9 mmol/L,氯化镁1.1 mmol/L,氯化钙1.8 mmol/L,葡萄糖5.6 mmol/L)的浴管中,调节基本张力为1.5 g,恒温(37.0±0.5)℃水浴,通气钩以每秒l~2个气泡的速度持续通入混合气体(95% O2和5% CO2)。肠平滑肌收缩活动及变化信号经张力换能器引至BL-420生物机能实验多道生理信号采集处理系统。
2.3.2 样品制备依据“2.2”项下单因素考察获得的最佳提取工艺进行提取,获得的提取液中取1 200 mL,旋转蒸发至干,得TSPS提取物干燥粉末。待实验时,用去离子水配制成TSPS提取物为6.4 mg/mL样品溶液,备用。
2.3.3 TSPS提取物对大鼠不同肠段平滑肌收缩功能的影响标本张力稳定后,在不同肠段的浴槽中依次加入0.04、0.08、0.16、0.32、0.64 mg/mL的TSPS提取物,观察其在不同质量浓度下对4个肠段平滑肌收缩幅度,记录10 min。结果如表 1显示,TSPS提取物对十二指肠、空肠、回肠、结肠都具有显著的促进其收缩的作用,且在0.32 mg/mL时促进离体肠收缩效果最佳;当TSPS质量浓度达到0.64 mg/mL时,因溶解度,出现混悬,各肠段促进率明显下降。TSPS提取物对大鼠离体肠平滑肌的收缩作用强弱表现为结肠>回肠>空肠>十二指肠。TSPS提取物对大鼠结肠收缩作用最显著,其最佳有效质量浓度为0.32 mg/mL。因此,选用大鼠结肠,样品中总皂苷的质量浓度为0.32 mg/mL,考察响应面筛查最佳工艺试验中不同实验方案下获得不同提取率的TSPS的体外促进离体肠收缩作用,进一步评价提取工艺。

|
|
|
表 1 TSPS提取物对大鼠不同肠段收缩功能的影响 Table 1 Contraction effects of TSPS on different isolated intestinal segments |
2.4 响应曲面试验结果与分析 2.4.1 响应曲面试验设计、统计及结果分析
利用Design-Expert软件进行数据分析,该软件具有使用简单、功能完整、统计效率高等优点。通过单因素试验,选择了提取溶剂(以乙醇体积分数表示,A)、料液比(B)、提取时间(C)3个因素,以TSPS提取率(Y)为响应值。采用Design Expert 8.05软件Box-Behnken试验设计的3因素3水平试验方案进行研究。通过Design-Expert 8.05软件进行数据拟合,利用响应面优化Y。同时将不同试验组获取的TSPS提取物配制成0.3 mg/mL水溶物,依据“2.3.3”项下测试其对大鼠离体结肠平滑肌的收缩作用,考察Y的高低与活性之间的关系,以便于综合评价最佳的提取工艺。实验结果显示,Y越高,其对结肠平滑肌收缩率效果越显著,因此通过响应面法优化确定的最佳提取工艺获得的TSPS提取物也具有很好的促进离体肠平滑肌的收缩作用。具体的试验设计方案及结果如表 2所示。
|
|
表 2 Box-Behnken试验设计与结果 Table 2 Box-Behnken design and results |
2.4.2 方差分析
采用ANOVA分析响应面回归参数。由表 3可知,1次项C>A>B,各因素与Y的线性关系显著;2次项C2对Y的曲面效应显著。经Design-Expert 8.05软件对数据进行方差分析,得到回归方程为Y=10.91+0.54 A-0.35 B+0.76 C+0.93 AB+0.32 AC-0.79 BC-3.27 A2-1.51 B2-0.71 C2,该方程相关系数R2=0.996。回归方程中各变量对响应值影响的显著性由F检验来判定,概率P(Prob>F)值越小,则相应变量的显著程度越高。
|
|
表 3 响应面2次模型方差分析 Table 3 Variance analysis for established regression model |
从表 3方差分析结果可知,实验中选用的模型差异极显著(P<0.001),表明该2次方程比较显著;失拟项为0.081 6>0.05,表明失拟不显著;该方程R2=0.996对试验拟合程度良好,试验误差较小,可以用该模型对不同条件下的试验结果进行预测。
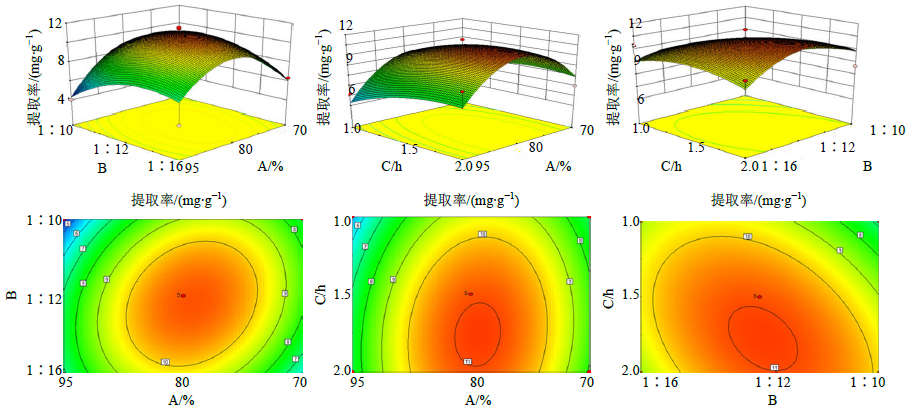
2.4.3 响应面分析利用Design-Expert 8.05软件对表 2的数据进行2次多元回归拟合,通过固定3个变量中的2个为中值,把应变量与另2个因素拟合为三维曲面图,以拟合目标函数为数学模型,绘制因变量曲面图,所得到的2次回归方程的响应面及其等高线图如图 2所示。确定最佳提取工艺条件提取溶剂为体积分散为74.96%的乙醇,料液比1:11.95,提取时间为1.535 h,在此工艺条件下TSPS提取率的预测值为11.122 2 mg/g。
|
图 2 各因素间的交互作用 Fig.2 Interaction among each factor |
2.5 验证试验
通过对实验数据的综合分析,将TSPS的提取工艺确定为提取溶剂为体积浓度为75%的乙醇,料液比1:12,提取时间为1.5 h,提取温度90℃、提取2次。利用确定的最佳工艺进行3次验证试验,TSPS的提取率可达10.96 mg/g,对大鼠离体肠平滑肌的收缩促进率可达48.52%,模型预测值降低了0.58 mg/g,RSD值为0.86%,实验值与理论值偏差较小。说明本实验利用响应曲面法优化得到的数学模型可靠,具有良好的预测性,所得的工艺参数准确可靠,具有实际应用价值。
3 讨论本实验首次采用响应曲面法对TSPS的提取工艺参数进行优化,利用Design-Expert 8.05软件对提取率进行预测分析,并通过验证实验确定了高提取率的TSPS提取工艺。该提取工艺稳定,可靠,为后续TSPS的提取开发奠定了基础。
实验中由于黄花败酱中还含有以芦丁为代表的系列黄酮类成分,为了使三萜总皂苷的定量测定结果更为准确,尽量消除方法学中假阳性结果,因此在方法学考察中测定了黄花败酱中黄酮类成分的干扰实验测定,以芦丁为代表化合物测定了其在三萜总皂苷定量测定方法下的显色情况,结果显示以芦丁为代表的黄酮类成分并未干扰到总皂苷的定量测定,使得三萜总皂苷的测定结果更为可信。
在单因素试验中发现,当料液比超过1:12,提取时间超过1.5 h,提取温度超过90℃时,提取率并没有增加反而降低,证明提取温度过高,提取时间延长,料液比过大并不利于TSPS的提取。因此,筛选适宜的工艺参数对TSPS的提取是非常必要的。由于响应曲面法建立的是复杂的多维空间曲面比较接近实际情况,更为全面地考察了提取工艺的最佳参数,其与单因素考察结果会有一定的差异,但可以通过验证实验进行确认,最终确定最佳提取工艺条件。
| [1] | 卢寅熹. 败酱草的本草考证[J]. 时珍国药研究, 1996,7 (3) :129–130. |
| [2] | 高亮, 张琳, 刘江云, 等. 黄花败酱化学成分研究[J]. 中草药, 2011,42 (8) :1478–1480. |
| [3] | Choi J S, Woo W S. Coumarins and triterpenoid glycosides from the roots of Patrinia scabiosaefolia[J]. Acrh Pharm Res, 1984, 7 (2) :121–126 . |
| [4] | Woo W S, Choi J S, Seligmann O, et al. Sterol and triterpenoid glycosides from the roots of Patrinia scabiosaefolia[J]. Phytochemistry, 1983, 22 (4) :1045–1047 . |
| [5] | 沈德凤, 杨波, 李进京. 黄花败酱总皂苷提取物抗肿瘤作用的实验研究[J]. 黑龙江医药科学, 2007,30 (3) :35. |
| [6] | 徐泽民, 黄朝辉, 朱波, 等. 黄花败酱镇静作用活性部位的研究[J]. 浙江中西医结合杂志, 2007,17 (6) :347–348. |
| [7] | 潘涛, 欧阳波. 正交设计法优选黄花败酱总皂苷提取工艺[J]. 中国医学导报, 2009,6 (33) :49–50. |
| [8] | 叶志雄, 苏俊芳, 黄旭东, 等. 黄花败酱甲醇提取物对小鼠溃疡性结肠炎影响的药效学研究[J]. 新中医, 2013,45 (9) :157–159. |
| [9] | 张启兴, 陈静, 闻雅芝, 等. 黄花败酱中齐墩果酸的含量测定[J]. 中医药信息, 2001,18 (4) :54–55. |
| [10] | 杨波, 徐丽云, 沈德凤. 黄花败酱总皂苷胶囊中齐墩果酸的含量测定[J]. 时珍国医国药, 2008,19 (7) :1618–1619. |
 2016, Vol. 47
2016, Vol. 47


