2. 哈尔滨商业大学, 黑龙江 哈尔滨 150076 ;
3. 安徽济人药业有限公司, 安徽 亳州 236800 ;
4. 中药现代制剂与质量控制技术国家地方联合工程实验室(天津), 天津 300193
2. College of Pharmacy, Harbin University of Commerce, Harbin 150076, China ;
3. Anhui Jiren Pharmaceutical Co., Ltd., Bozhou 236800, China ;
4. National & Local United Engineering Laboratory of Modern Preparation and Quality Control Technology of Traditional Chinese Medicine (Tianjin), Tianjin 300193, China
马鞭草为马鞭草科植物马鞭草Verbena officinalis L.的干燥地上部分。具有活血散瘀、解毒、利水、退黄、截疟的功效。马鞭草的主要成分为环烯醚萜糖苷类、苯丙素糖苷类、三萜类、黄酮类、甾醇类、挥发油类、有机酸类等[1]。现代药理研究表明,其具有抗炎镇痛、神经保护、调节免疫活性、抗肿瘤、抗氧化、抗早孕等作用[2],其中马鞭草环烯醚萜类和黄酮类成分为抗炎镇咳的主要有效成分[3]之一。
马鞭草作为疏风解毒胶囊处方中的主要药材之一,其药材的质量对于产品的质量及稳定性至关重要。马鞭草始载于《名医别录》[1],《中国药典》各版均有收载,其质量标准在逐步改进提高,以《中国药典》2010年版为例,马鞭草项下的薄层鉴别和定量测定均以熊果酸和齐墩果酸为指标[4],但2种成分为脂溶性成分,且广泛存在于多种中药中,不能完全反映其内在的质量。近年来随着马鞭草化学成分研究的深入,马鞭草的定量控制成分逐步增多,《中国药典》2010年版对马鞭草药材中齐墩果酸和熊果酸进行了质量控制,该法以ELSD作为检测器,样品制备繁琐,且专属性差。有文献报道[5-8]采用HPLC法测定马鞭草苷、戟马鞭草苷、毛蕊花糖苷、熊果酸、齐墩果酸、木犀草素、芹菜素和山柰酚等成分,也有采用HPLC指纹图谱评价不同马鞭草药材质量的研究报道[9-10],在疏风解毒胶囊中马鞭草的制备工艺为水提取,极性成分以环烯醚萜苷类、黄酮类、苯丙素糖苷类为主,其中马鞭草苷、戟叶马鞭草苷和毛蕊花糖苷为其主要成分,在药材中质量分数相对较高,具有抗炎、抗菌、增强免疫等作用。如何全面有效检测马鞭草药材中的主要成分对于保证药物的临床疗效具有积极的意义。本实验利用HPLC建立马鞭草指纹图谱以及马鞭草苷、戟叶马鞭草苷和毛蕊花糖苷定量测定方法,以此来反映其药材的整体性和特征性,为马鞭草质量的全面评价提供依据。
1 仪器及材料Agilent1100-高效液相色谱仪,AB204-N电子天平(Mettler Toledo公司),Autoscience AS3120超声仪,电热恒温水浴锅(江苏省医疗器械厂),Mettler Toledo PB303-N电子天平(瑞士Mettler Toledo公司)。
甲醇、乙腈(色谱纯),天津市康科德科技有限公司;乙醇、磷酸(分析纯),天津市天河化学试剂厂;水为纯净水。
对照品马鞭草苷(批号J140314001)、戟叶马鞭草苷(批号J140314001)、毛蕊花糖苷(批号JL130312002),质量分数均达98%以上,购于上海将来实业股份有限公司。
马鞭草药材由安徽济人药业有限公司提供,药材来源及产地见表 1,药材由天津药物研究院张铁军研究员鉴定为马鞭草Verbena officinalis L.的干燥地上部分。
|
|
表 1 14批马鞭草药材来源 Table 1 Sources of 14 batches of Verbenae officinalis |
2 方法与结果 2.1 指纹图谱研究 2.1.1 色谱条件
色谱柱为Orca C18柱(250 mm×4.6 mm,5μm);检测波长230 nm;柱温25℃;流动相为乙腈(A)-0.05%磷酸水溶液(B);梯度洗脱,0~40 min,5%~25% A;40~65 min,25%~35% A;体积流量1 mL/min,进样量10μL。
2.1.2 供试品溶液制备取马鞭草药材粉碎过40目筛,取粉末约1 g,精密称定,准确加入50%甲醇20 mL,置具塞锥形瓶中,称定质量,回流提取45 min,冷却至室温,再称定质量,用50%甲醇补足减失的质量,摇匀滤过,取续滤液,即得。
2.1.3 精密度试验取马鞭草药材粉末约1 g,精密称定,按“2.1.2”项下方法制备供试品溶液,在“2.1.1”项的色谱条件下测定,连续进样6次,记录HPLC色谱图,以马鞭草苷(8号峰)的保留时间和色谱峰面积为参照,计算出各色谱峰的相对保留时间和相对峰面积。各色谱峰的相对保留时间及相对峰面积的RSD值均小于5%,符合指纹图谱的要求。
2.1.4 稳定性试验取马鞭草药材(M1)粉末约1 g,精密称定,按“2.1.2”项下方法制备供试品溶液,密闭,放置于室温,按“2.1.1”项分别在0、3、6、12、24 h检测指纹图谱,以马鞭草苷(8号峰)的保留时间和色谱峰面积为参照,计算出各色谱峰的相对保留时间和相对峰面积。各色谱峰的相对保留时间及相对峰面积的RSD值均小于5%,符合指纹图谱的要求。说明供试品溶液在24 h内稳定。
2.1.5 重复性试验取马鞭草药材粉末(M1)约1 g,精密称定,平行6份,按“2.1.2”项制备供试品溶液,在“2.1.1”项色谱条件测定,记录色谱图,以8号峰马鞭草苷峰的保留时间和色谱峰面积为参照,计算出各色谱峰的相对保留时间和相对峰面积。各色谱峰的相对保留时间及相对峰面积的RSD值均小于5%,符合指纹图谱的要求。
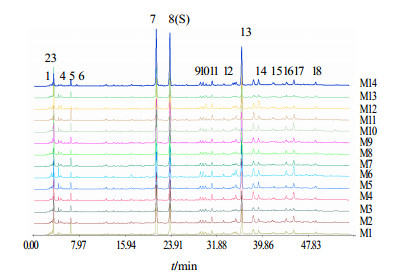
2.1.6 指纹图谱建立取14批马鞭草药材作为样本,按“2.1.1”项条件进行指纹图谱测定,将14批药材的指纹图谱的AIA数据文件导入《中药色谱指纹图谱相似度评价系统》2004A版相似度软件,以表 2中M7号马鞭草药材的指纹图谱为参照图谱,采用多样本平均数矢量综合作为共有模式矢量,时间宽度设定为0.10,多点校正后,确定了5个主要的共有色谱特征峰为3、5、7、8、13号色谱峰。选取峰面积较大、出峰时间适中且稳定的8号峰马鞭草苷峰作为参照峰(S),计算各色谱峰相对峰面积。数据见表 2,叠加色谱图见图 1。
|
|
表 2 14批马鞭草药材指纹图谱相对峰面积 Table 2 Relative peak area data of 14 batches of V. officinalis fingerprint |
|
图 1 14批马鞭草药材的HPLC指纹图谱 Fig.1 HPLC fingerprints of 14 batches of V. officinalis |
2.1.7 聚类分析
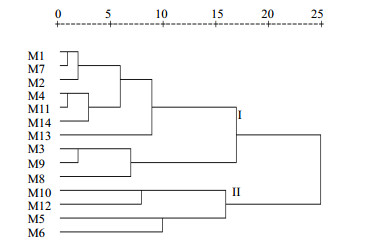
将各色谱峰占总色谱峰的峰面积量化,得到14×5阶原始数据矩阵,运用SPSS软件对其进行聚类分析。聚类分析将14个马鞭草样品分为2大类,可判定马鞭草内在质量具有差异性。聚类分析谱系图见图 2。14批样品分为2类,样品号为M1、M2、M3、M4、M7、M8、M9、M11、M13、M14的样品属于I类,样品号为M5、M6、M10、M12的样品属于II类。
|
图 2 马鞭草药材聚类分析图 Fig.2 Cluster analysis of 14 batches of V.officinalis |
2.1.8 相似度分析
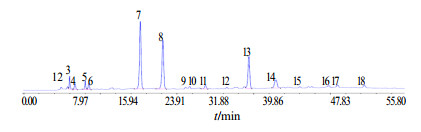
根据对14批马鞭草药材的聚类分析结果,从中选取归属于I类的10批药材的色谱图生成对照指纹图谱,见图 3。
|
图 3 马鞭草对照指纹图谱 Fig.3 Control fingerprint of V. officinalis |
利用2004B版《中药色谱指纹图谱相似度评价系统》计算软件,对上述14批样品与对照指纹图谱进行匹配,进行相似度评价,结果见表 3。结果表明,仅有1个批次的药材与对照指纹图谱间的相似度低于0.9,其余各批次药材与对照指纹图谱间的相似度高于0.9,表明大部分药材之间具有较好的一致性。
|
|
表 3 14批马鞭草药材指纹图谱的相似度评价 Table 3 Similarity of 14 batches of V. officinalis |
2.2 样品成分定量测定 2.2.1 色谱条件
色谱柱为Orca C18柱(250 mm×4.6 mm,5μm);检测波长238 nm;柱温30℃;流动相为乙腈(A)-0.05%磷酸水溶液(B);梯度洗脱:0~30 min,14%~40% A;体积流量1 mL/min;进样量10μL。
2.2.2 混合对照品溶液的制备取戟叶马鞭草苷、马鞭草苷、毛蕊花糖苷对照品适量,精密称定,加甲醇制成含戟叶马鞭草苷0.149 mg/mL、马鞭草苷0.072 mg/mL、毛蕊花糖苷0.057 mg/mL的混合对照品溶液。
2.2.3 供试品溶液制备取马鞭草药材粉碎过40目筛的粉末,约0.5 g,精密称定,精密加入70%甲醇20 mL,置具塞锥形瓶中,称定质量,回流提取40 min,放冷,再称定质量,用70%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.2.4 线性关系考察精密吸取上述混合对照品溶液2、5、10、15、20μL,以所确定的色谱条件进行测定。绘制色谱图,记录相应的峰面积,以峰面积为纵坐标(Y),进样量为横坐标(X),绘制标准曲线并进行回归计算。戟叶马鞭草苷、马鞭草苷、毛蕊花糖苷回归方程分别为Y=1 589 X-14.588,r=0.999 9;Y=2 404.7 X+1.517 1,r=0.999 6;Y=2 063.1 X-21.132,r=0.999 4;结果表明戟叶马鞭草苷进样量在0.298~2.980μg、马鞭草苷进样量在0.144~1.440μg、毛蕊花糖苷进样量在0.114~1.14 0μg,与峰面积呈良好的线性关系。
2.2.5 精密度试验取批号为140401(M1)的马鞭草药材粉末,约0.5 g,精密称定,按“2.2.3”项下制备供试品溶液,在确定的色谱条件下测定,连续进样6次。戟叶马鞭草苷、马鞭草苷和毛蕊花糖苷色谱峰的峰面积RSD值分别为0.51%、0.49%和0.82%。
2.2.6 稳定性试验取批号为140401(M1)的马鞭草药材粉末,约0.5 g,精密称定,按“2.2.3”项下制备制备供试品溶液,密闭,放置于室温,分别在0、2、4、6、8、10、12 h检测,戟叶马鞭草苷、马鞭草苷和毛蕊花糖苷色谱峰的峰面积RSD分别为1.54%、1.57%和1.92%。
2.2.7 重复性试验取批号为140401(M1)的马鞭草药材粉末,约0.5 g,精密称定,按“2.2.3”项下制备供试品溶液,依法操作制备6份,在确定的色谱条件下测定。按外标法计算其质量分数,结果戟马鞭草苷、马鞭草苷和毛蕊花糖苷质量分数的RSD分别为1.53%、1.98%和1.76%。
2.2.8 加样回收率试验取批号为140401(M1)的马鞭草药材粉末约0.25 g,精密称定,分别按已测定的80%、100%、120% 3个水平加入戟叶马鞭草苷、马鞭草苷和毛蕊花糖苷混合对照品溶液,按“2.2.3”项下方法制备供试品溶液,依法测定,计算回收率,戟叶马鞭草苷、马鞭草苷和毛蕊花糖苷的平均加样回收率分别为96.91%、96.97%、96.53%,RSD分别为1.73%、1.82%、1.94%。
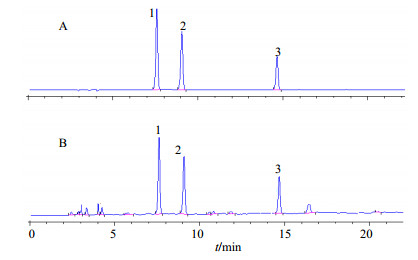
2.2.9 样品的测定取马鞭草药材粉末约0.5 g,精密称定,依照“2.2.3”项下制备供试品溶液,依法测定,按外标法计算样品中各成分的质量分数,色谱图见图 4,结果见表 4。
|
图 4 混合对照品(A)和马鞭草药材(B)的HPLC图 Fig.4 HPLC of reference substances (A) and V. officinalis (B) |
|
|
表 4 马鞭草药材中各成分质量分数测定结果(n=3) Table 4 Determination of content of each component in V. officinalis (n=3) |
3 讨论
采用二极管阵列检测器对样品进行200~400 nm的全波长扫描,分析比较各波长下的色谱图中特征峰。结果在230 nm波长下,色谱峰较多,且各峰分离良好,因此选择230 nm作为指纹图谱的检测波长。
14批次的马鞭草药材虽然来自同一个产地,但马鞭草的3个主要成分戟叶马鞭草苷的量在0.27%~0.52%,马鞭草苷的量在0.15%~0.33%,毛蕊花糖苷的量;在0.14%~0.37%,说明质量分数差异较大,各个批次指纹图谱的相似度值0.89~0.99,跨度较大,可能是采收季节的不同或是不同年限造成各批次间药材中主要成分的量的差异变化较大,因此聚类分析将这14批药材分为2类,同时进一步说明本研究建立的马鞭草指纹图谱用于药材质量控制对于保证药材质量具有积极的意义。
中药质量控制研究是保证中药安全性和有效性的关键环节,多指标定量测定已成为中药质量控制较为常用的方法之一。然而,在多成分测定中,能否选择关键药效成分进行定量分析,直接关系到该方法能否有效控制中药质量。本研究3个定量指标成分为指纹图谱中所占比重较大的主要成分,用于马鞭草药材的质量控制,本研究建立多个指标成分结合指纹图谱来控制药材质量的方法,弥补了过去单一的指标成分控制药材质量不全面的缺陷。同时对于疏风解毒胶囊的质量及疗效控制具有重要意义。
| [1] | 陈兴丽, 孟岩, 张兰桐. 马鞭草化学成分和药理作用的研究进展[J]. 河北医药, 2010,32 (l5) :2089. |
| [2] | 郭琳, 苗明三. 马鞭草化学、药理及临床应用探讨[J]. 中医学报, 2014,29 (9) :1345–1347. |
| [3] | 任非, 段坤峰, 付颖, 等. 马鞭草镇咳有效部位化学成分的研究[J]. 中国医院药学杂志, 2013,33 (6) :445. |
| [4] | 中国药典[S].一部. 2010. |
| [5] | 麻秀萍, 蒋朝晖, 丁宁, 等. HPLC测定马鞭草中熊果酸的含量[J]. 中成药, 2005,27 (1) :88–92. |
| [6] | 徐剑, 张永萍, 杨芳芳. 马鞭草药材中马鞭草苷含量测定方法的研究[J]. 时珍国医国药, 2009,20 (9) :2179–2180. |
| [7] | 舒积成, 侴桂新, 王峥涛. 马鞭草药材的质量标准研究[J]. 中国现代应用药学, 2011,28 (5) :433–438. |
| [8] | 丁家欣, 张秋海, 李先端. 高效液相色谱-蒸发光散射法测定马鞭草中齐墩果酸与熊果酸的含量[J]. 分析仪器, 2011 (5) :27–31. |
| [9] | 王苗苗, 刘真, 迟宗良, 等. 马鞭草高效液相指纹图谱研究[J]. 中华中医药学刊, 2013,31 (8) :1800–1804. |
| [10] | 段坤峰, 袁志芳, 郑旭光, 等. 马鞭草HPLC-PDA指纹图谱研究[J]. 中草药, 2009,40 (12) :1984–1988. |
 2016, Vol. 47
2016, Vol. 47


