2. 天津药物研究院, 天津 300193
2. Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
甘草Glycyrrhizae Radix et Rhizoma是常用的传统中药,也是疏风解毒胶囊的原料药材之一,具有补脾益气、润肺止咳、缓急止痛、清热解毒的功效[1],同时甘草在我国多个传统经典方剂中承担着调和诸药、缓和药性的作用。现代药理学研究显示甘草具有抗溃疡、解痉、抗菌、抗炎、调血脂、镇痛和雌性激素样作用等多种功效[2]。甘草中的化学成分主要有三萜类、黄酮类、香豆素类和多糖类等[2-5],目前从甘草中分离鉴定的三萜类成分有60多种,黄酮类成分有100多种[4]。甘草的化学成分比较复杂,而且由于品种和产地不同,其化学成分差异较大,因此建立一种微量、快速的定性识别方法,对于分析其作用物质基础具有重要的意义。近年来应用液质联用分析甘草中的化学成分取得一定进展[6-9],有学者利用HPLC/ESI-MSn联用方法对东北产甘草的化学成分进行分析,根据多级质谱(ESI-MSn)所得的碎片峰,结合紫外光谱、HPLC的保留时间以及参考文献报道共推测出22个化学成分的可能结构[8]。也有学者利用HPLC-MS的方法分析了炙甘草中的38个化学成分[9]。本实验在大量文献工作的基础上,利用HPLC-Q-TOF-MS方法分析了甘草的化学成分组成,首次在一个液质条件下识别并鉴定了40个主要色谱峰的组成,其中包括28个黄酮类成分、11个三萜皂苷类成分和1个香豆素类成分,为快速确定甘草的药效物质基础、质量控制提供数据支撑。
1 仪器与试剂1200HPLC-TOF/MS(Bruker Daltonics),1200 HPLC(Agilent technology),Milli-Q超纯水系统(法国Millipore公司)。甲醇和乙腈(色谱纯,美国Merck公司),对照品甘草酸(批号731-9001)、甘草苷(批号111610201106)购自中国食品药品检定研究院,异甘草苷(批号J140320011)购自将来试剂公司,甘草素(批号FB-31001)购自上海永恒生物科技有限公司,质量分数均大于98%。甘草药材购于内蒙古亿利能源股份有限公司甘草分公司,由天津药物研究院张铁军研究员鉴定为乌拉尔甘草Glycyrrhiza uralensis Fisch.的干燥根。
2 方法 2.1 对照品溶液配制准确称量甘草酸、甘草苷、甘草素、异甘草苷对照品各2.00 mg,分别置于10 mL量瓶中,加入适量50%甲醇溶解,并以50%甲醇定容,得到质量浓度为200μg/mL对照品贮备液。检测前利用50%甲醇溶液将对照品贮备液稀释10倍,待测。
2.2 供试品溶液配制取甘草粉末1 g,加入50%甲醇20 mL置圆底烧瓶中,称定质量,超声提取30 min,冷却后称定质量,并用50%甲醇补足减失质量,摇匀。经0.45μm微孔滤膜滤过,取续滤液备用。
2.3 色谱-质谱条件 2.3.1 色谱条件色谱柱为Diamonsil II C18柱(250 mm×4. 6 mm,5μm);以0.05%甲酸水溶液(A)-乙腈(B)为流动相,梯度洗脱:0~20 min,5%~25% B;20~30 min,25%~30% B;30~35 min,30%~35% B;35~45 min,35%~60% B;45~60 min,60% B;60~70 min,60%~70% B,体积流量为1.0 mL/min;柱温35℃,进样量5μL;200~600 nm全波长扫描。
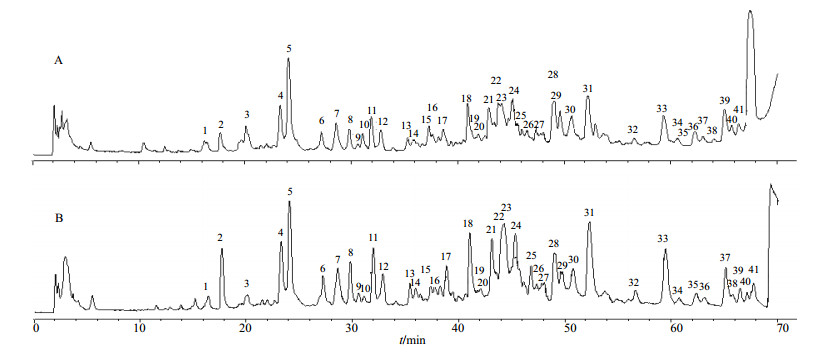
2.3.2 质谱条件分流比设为1∶4,正负离子分别进行全扫描(ESI),扫描质量范围m/z 50~1 200;干燥气体的体积流量6 L/min,干燥气温度180℃,雾化气压80 kPa。正离子模式下,毛细管电压4 500 V,负离子模式下的毛细管电压2 600 V,碎裂电压70 V选择甲酸钠溶液为内标矫正。甘草提取物的HPLC-Q-TOF-MS的总离子流图见图 1。
|
图 1 甘草提取液HPLC-Q-TOF-MS正离子模式(A)和负离子模式(B)总离子流图 Fig.1 Total ion chromatograms of HPLC-Q-TOF-MS by positive mode (A) and negative mode (B) for extraction of Glycyrrhizae Radix et Rhizoma |
3 结果与讨论
如图 1所示,在甘草50%甲醇提取液中通过HPLC-Q-TOF-MS检测,正负离子流数据分析,共识别了41个色谱峰,通过质谱裂解碎片分析并结合文献报道数据对照,鉴定了40种化合物,包括28个黄酮类、11个三萜皂苷类和1个香豆素类化合物,结果如表 1所示。
|
|
表 1 甘草中化学成分解析结果 Table 1 Chemical constituents identified in extracts from Glycyrrhizae Radix et Rhizoma |
3.1 黄酮类化合物的分析鉴定
黄酮类成分是甘草药材中的一类主要成分。本实验通过HPLC-Q-TOF-MS数据分析,结合文献对比共识别了28种黄酮类化合物,其中查耳酮类5个、二氢黄酮类7个、黄酮及黄酮醇类6个、异黄酮类4个、黄烷类6个。
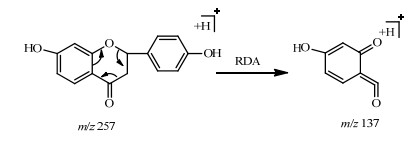
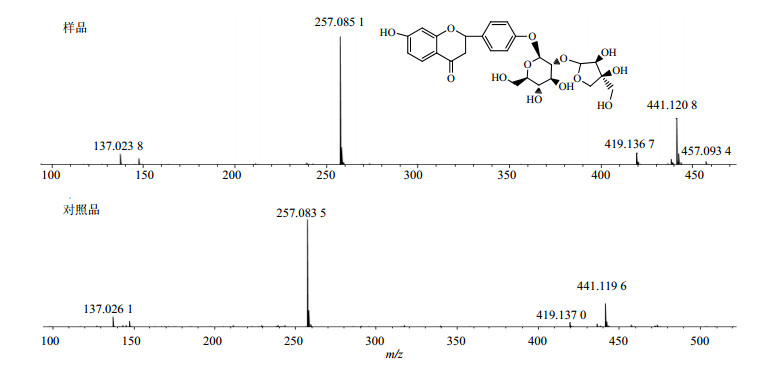
3.1.1 二氢黄酮类化合物5号峰的正离子质谱中可以观察到441.126 8 [M+Na]+,419.136 7 [M+H]+,403 [M+H-Glucose]+,271 [M+H-Glucose-Arabinose]+,负离子质谱中观察到417.127 5 [M-H]−,根据元素分析结果综合分析确定分子式为C21H22O9。根据其裂解规律可以判断结构中存在2个糖取代基。此外苷元部分的裂解规律符合黄酮类化合物的裂解规律(图 2),且与对照品甘草苷的质谱裂解规律[10](图 3)完全一致,因此将5号峰化合物鉴定为甘草苷。而15号峰的正负离子模式下分别给出了257.072 7 [M+H]+和256.070 2 [M-H]−,确定分子式为C15H12O4。根据其极性,并与对照品甘草素的质谱对照,确定15号峰是5号峰的苷元结构,鉴定为甘草素。4号峰的质谱信息正离子中可以观察到573.163 7 [M+Na]+和549.168 0 [M-H]−,分析确定其分子式C26H30O13。根据其裂解碎片可以判断其与5号峰相比较仅多出了一个丢失芹糖基m/z 132的碎片峰,检索文献报道[11]确定峰4化合物为甘草素-4′-芹糖苷。
|
图 2 5号峰的苷元部分裂解过程推断 Fig.2 Partial fragmentation process of aglycon on peak 5 |
|
图 3 5号峰和对照品的质谱比对分析 Fig.3 MS analysis of Peak 5 and comparison with reference substances |
7号峰的质谱给出了正离子505.135 3 [M+H]+,257 [M+H-Glucuronide-acetyl]+,负离子503.127 3 [M-H]−,根据元素分析结果综合分析确定分子式为C24H24O12。参考文献报道[10]确定7号峰苷元与甘草苷的苷元相同,仅是连接的糖为糖醛酸,且2位被乙酰化,在质谱裂解碎片中能够观察到脱去乙酰基的碎片峰。因此确定7号峰的结构可能为5-羟基甘草苷元-6′-乙酰基葡萄糖苷。
8号峰的质谱给出了正离子551.167 7 [M+H]+,负离子549.153 1 [M-H]−,综合分析确定分子式为C26H30O13。质谱裂解规律中还可以观察到419 [M+H-Apiose]+,257 [M+H-Apiose-Glucose]+,这些信息与5号峰非常相近,但是极性降低很多,说明其极性基团减少,2个羟基均被糖苷化,是一个双糖连的结构。结合文献报道[8]确定8号峰化合物为芹糖甘草苷。
11号峰的质谱裂解规律和分子信息与峰5非常接近,相对分子质量和分子式相同,说明其与5号峰互为同分异构体结构。但二者极性相差较大,11号峰出峰时间晚,结合文献提供的化合物信息,将11号峰化合物确定为新甘草苷[8]。
29号峰的正离子质谱给出了m/z 357.167 5 [M+H]+,负离子质谱中观察到m/z 355.153 2 [M-H]−,根据元素分析结果综合分析确定分子式为C20H20O6。结构中有RDA裂解的碎片m/z 153,说明A环中比5号峰多出1个羟基;在其质谱的裂解碎片中有丢失m/z 56的碎片峰m/z 301,说明B环中存在异戊烯基结构,检索文献报道[12-13]对比化合物信息确定29号峰化合物为乌拉尔宁。
3.1.2 查耳酮类化合物6号峰的正负离子质谱结合元素分析确定分子式为C21H22O9。其相对分子质量和分子式与5号峰完全一致,裂解的碎片与峰5也非常接近,但是出峰时间晚,极性低于峰5,裂解峰的比例有差别,说明二者互为同分异构体。6号峰的质谱数据与对照品异甘草苷的质谱数据完全一致,因此判断6号峰为异甘草苷。16号峰的正负离子质谱数据结合元素分析确定分子式为C15H12O4。其与6号峰相比较丢失了1分子的葡萄糖基,检索文献报道[8]确定16号峰化合物为异甘草素。
9号峰与6号峰相比较多1个芹糖基碎片,鉴于在二氢黄酮的分析鉴别中存在甘草苷和芹糖基甘草苷的一组化合物,结合文献分析确定9号峰化合物是异甘草苷的芹糖基化产物,确定为异甘草苷-4′-芹糖基。如表 1所示,12号峰的质谱裂解碎片信息与6号峰非常接近,但是极性降低较多,借鉴二氢黄酮的鉴定过程,确定峰12化合物为新异甘草苷。
峰1的极性最大,其正离子质谱中可以观察到735.2 [M+Na]+,负离子质谱中观察到711.2 [M-H]−,根据元素分析结果综合分析确定其相对分子质量为712,分子式为C32H40O18。而且在质谱的裂解过程中可以确定结构中存在两分子葡萄糖和1分子芹糖碎片。检索文献报道[14]结合化合物极性分析,确定峰1化合物为异甘草苷元-7-O-芹糖-7, 4′-O-二葡萄糖苷。
3.1.3 黄酮和黄酮醇类化合物3号峰的正离子质谱中可以观察到587.135 7 [M+Na]+,565.160 8 [M+H]+,403 [M+H+Glucose]+,271 [M+H-Glucose-Arabinose]+,负离子质谱中观察到563.149 9 [M-H]−,根据元素分析结果综合分析确定分子式为C26H28O14,该化合物的裂解过程说明其为二糖苷类化合物,结合化合物的极性并与文献报道[13]的化合物及其裂解规律相比对将其鉴定为夏佛塔苷。
10号峰的质谱信息给出了431.122 0 [M+H]+和475.112 3 [M+HCOO]−,通过元素分析给出了分子式为C22H22O9,与5号峰相比较,其极性弱于5号峰,且结构中多出一个甲氧基结构,由于4′位连有糖苷键,因此推测甲氧基连接为7位,故将10号峰化合物确定为7-甲氧基甘草苷。
30号峰的正离子质谱中可以观察到355.108 8 [M+H]+,负离子质谱中观察到353.108 6 [M-H]−,确定分子式为C20H18O6。在质谱信息中可以观察到脱去m/z 68的碎片峰和发生RDA裂解的m/z 221的碎片峰,根据连有异戊烯基黄酮类化合物的质谱裂解规律[13]可以确定异戊烯基连接在A环,结合文献信息[15]分析,确定30号峰化合物为甘草黄酮醇。
27号峰的质谱信息与29号峰相比较极性较大,通过对其正负离子中393.108 8 [M+Na]+和369.106 2 [M-H]−的分析确定分子式为C20H18O7,根据其质谱裂解过程确认其与29号峰比较丢失了2个氢原子,但是多出了1个羟基取代,结合文献报道[12]确定峰27为黄酮醇类化合物,结构鉴定为乌拉尔醇。
36号峰极性非常小,通过分析其质谱信息确定分子式为C21H20O4,在质谱信息中可以观察到发生RDA裂解的m/z 221的碎片峰,对比甘草中报道的化合物[16]确定其为异戊烯基与羟基发生环合使极性减小,为5-甲氧基光甘草酮。
3.1.4 异黄酮类成分31号峰、32号峰通过正负离子信息以及元素分析后确定其分子式为C20H18O6,与30号峰互为同分异构体,3组峰的质谱主要裂解信息都是相近的,但31和32号峰出现了异黄酮的特征碎片峰m/z 205,因此和文献对比确定31峰为异甘草黄酮醇,32号峰为甘草宁L [17]。按照相同的解析方法确定了33号峰的分子式为C21H20O5,质谱的裂解碎片中有丢失m/z 56的碎片峰m/z 297,说明结构中存在异戊烯基结构,结合文献报道确定33号峰为甘草宁M [17]。34号峰是33号峰的同分异构体,也是异黄酮类结构,与文献对照鉴定为甘草宁G [18]。28号峰通过元素分析确定其分子式为C21H20O6,其质谱裂解信息与33号峰非常接近,但是极性大于峰33,发现该化合物结构中多出一个羟基,结合文献确定其为甘草宁N [16]。
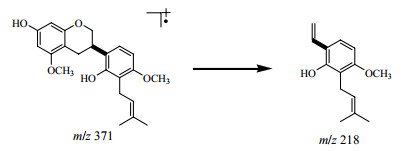
3.1.5 黄烷类成分黄烷类成分是甘草液质分析中极性相对较小的一类成分。35号峰的正离子质谱中给出了393.172 6 [M+Na]+,负离子质谱中给出了369.175 6 [M-H]−,元素分析确定分子式为C22H26O5。在其正离子的质谱裂解中可以观察到218,163的碎片峰,且218的碎片峰信号较强。通过文献检索在甘草中还存在Kanozol系列的黄烷类化合物[19-20]。根据相对分子质量和化合物的极性确定35号峰化合物为kanozol R,如图 4所示,218的碎片峰是C环发生RDA裂解产生的碎片峰。
|
图 4 Kanozol R (35号峰)的主要裂解过程 Fig.4 Main fragmentation process of Kanozol R (Peak 35) |
根据同样的方法,37号峰和39号峰的相对分子质量相同,分子式为C26H32O5,该化合物与35号峰相比多出了一个异戊烯基且与羟基发生环合反应,质谱裂解中主要出现的峰为m/z 221的碎片峰也是其C环发生RDA裂解的产物,与文献报道的化合物Kanozol H的性质相近。因此将37号峰和39号峰鉴定为Kanozol H及其同分异构体。38号峰与37号峰相比较为脱去了一分子羟基的结构,故将38号峰鉴定为Dehydroxy Kanzonol H及其异构体。而40号和41号峰极性更小,分子式为C26H30O5,其在Kanozol H的结构基础上,另一侧的异戊烯基也与羟基发生环合反应,因此确定结构为Kanozol J及其同分异构体。
3.2 三萜皂苷类化合物的分析鉴定三萜皂苷类成分是甘草药材中的另一类重要成分。本文利用HPLC-Q-TOF-MS在指纹图谱体系下共识别了11个三萜皂苷类化合物,均为甘草酸类衍生物。
以22号峰为例阐述三萜皂苷类成分的裂解规律和结构鉴定的解析过程。该化合物的正离子质谱中可以观察到m/z 823.405 7 [M+H]+,负离子质谱中给出了m/z 823.402 1 [M-H]−,综合分析确定了其分子式为C42H62O16。在正离子质谱的碎片峰中可以m/z 647 [M+H-Glucuronide acid]+和471 [M+H-Glucuronide acid×2]+,确定结构中连接2个葡萄糖醛酸的结构。470应该为苷元的相对分子质量。之后又观察到m/z 304、262、206和175的碎片峰。分析结构可能是由于发生了麦氏重排和RDA裂解产生的碎片。详细裂解过程如图 5所示。苷元的结构中由于C-11位羰基的存在,C-1上又具有可转移的γH原子,容易发生麦氏重排,并伴随烯丙键(C7-C8之间)均裂,生成m/z 303碎片离子;麦氏重排伴随C-1上1个H原子转移也引起烯丙键(C7-C8之间)均裂,生成的m/z 304离子也具有相当的丰度,继续丢失CH3及中性分子C9H14O2生成m/z 135(有时为基峰)。由于具有以上特征的裂解碎片峰,并和标准品甘草酸的质谱裂解信息[21]对比,将22号峰化合物鉴定为甘草酸。
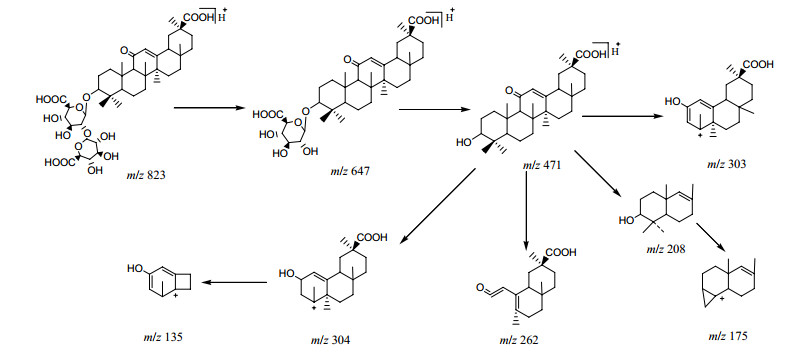
|
图 5 甘草酸(22号峰)的裂解过程 Fig.5 Fragmentation process of glycyrrhizic acid (Peak 22) |
18、19、20号峰的分子离子峰均比23号峰多出m/z 16,且在质谱裂解中脱糖的碎片峰是相同的,都具有脱去2分子糖醛酸的碎片峰,仅比苷元碎片多出1个脱掉1分子水(m/z 18)的碎片峰。因此可以确定苷元在甘草酸苷元的基础上进行了羟基化。因此离子流中18、19、20号峰均为甘草酸的1个羟基化的产物。同理,17号峰在1个羟基化产物的基础上又多出了1个m/z 16,且糖链裂解碎片也是一致的,仅苷元部分又多出了1个脱掉1分子水的碎片峰,因此确定17号峰为甘草酸2个羟基化的产物。
21号峰的正离子质谱中观察到m/z 809.436 8 [M+H]+,633 [M+H-Glucuronide acid]+,457 [M+H-Glucuronide acid×2]+,而负离子质谱中可以观察到m/z 807.429 9的负离子质谱,从而确定该化合物的相对分子质量为808.424 5,且元素分析确定其分子式为C42H64O15。通过质谱分析确定该化合物与峰22相比较,苷元部分缺少一个氧原子,且RDA裂解只获得了289碎片峰,说明三萜皂苷的C环结构发生了变化,通过文献报道比较[20],确定该化合物为的羰基被还原,鉴定为甘草皂苷B。
13号峰的极性在甘草皂苷中相对较大,其正离子中可以观察到m/z 825.424 4 [M+H]+,649 [M+H-Glucuronide acid]+,473 [M+H-Glucuronide acid×2]+,而负离子质谱中可以观察到m/z 823.423 6 [M-H]−,从而确定该化合物的相对分子质量为824.419 4,且元素分析确定其分子式为C42H64O16。通过质谱分析确定其苷元部分的结构发生变化,出现了苷元m/z 473的脱水峰m/z 455,同时也出现了碎片峰m/z 287,这是C环发生变化后得到的,而且与甘草酸的裂解规律相比较,m/z 304的碎片峰改变为m/z 287说明开始的脱水反应发生在C环,说明C环不存在羰基,羰基结构被还原,这样结合文献的化合物信息[12],确定峰13为11位被还原的甘草酸的结构,鉴定为11-羟基甘草酸。26号峰的阴正离子质谱数据分析结果发现其与13号峰的元素组成完全相同,但是极性相差较大。且在质谱的裂解碎片中,26号峰的质谱裂解中存在289的碎片峰,说明其化合物的C环与峰21的C环相近,不存在羰基结构,并根据分析已经获得的甘草皂苷成分,结合文献数据对比,确定26号峰是在24位进行了羟基化,鉴定结构为甘草皂苷J2。
23、24和25号峰的正负离子对比分析,确定其相对分子质量和元素分析与峰22完全相同,均为C42H62O16。但其极性比甘草酸略大一些。结合文献报道的化合物[12, 21]的极性和液相色谱中出峰的先后顺序推测23号峰为乌拉尔甘草皂苷B,24号峰化合物为甘草皂苷H2,25号峰化合物为甘草皂苷K2。
3.3 香豆素类化合物的鉴定15号峰的质谱中给出正离子539.121 0 [2M+H]+,269.082 4 [M+H]+,负离子267.070 7 [M-H]−,根据元素分析确定了分子式为C15H8O5。该化合物主要裂解峰为m/z 146.9,是香豆素类化合物的主要裂解峰[22]。参考甘草中分离化合物的文献报道[12],结合化合物的出峰时间和裂解规律(图 6),确定该化合物为甘草素。
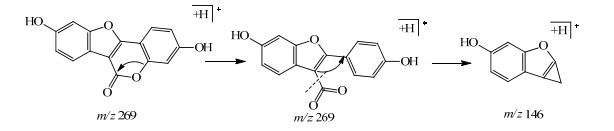
|
图 6 甘草素(15号峰)的裂解过程 Fig.6 Fragmentation process of coumestrol (Peak 15) |
4 讨论
本研究利用液质联用技术,对甘草的化学成分进行了分析鉴定,分析了44个色谱峰,鉴定了40个色谱峰对应的化合物,其中包括28个黄酮类类成分、11个三萜皂苷类成分和1个香豆素类化合物。本研究首次在1个液质条件下识别出了40个色谱峰对应的化合物,为甘草的全面质量控制和其在复方中的配伍规律的研究奠定基础,并为甘草参与组方其他复方制剂的物质基础研究和成分分析鉴定提供了参考。
| [1] | 中国药典[S].一部. 2015. |
| [2] | 胡金锋, 沈凤嘉. 甘草植物化学成分研究概况[J]. 天然产物研究与开发, 1996,8 (3) :77–91. |
| [3] | 刘勤, 刘永隆. 黄甘草化学成分的研究[J]. 药学学报, 1989,24 (7) :525–531. |
| [4] | Hatano T, Takagi M, Ito H, et al. Acylated flavonoid glycosides and accompanying phenolics from licorice[J]. Phytochemistry, 1998, 47 (2) :287–293 . |
| [5] | 王彩兰, 张如意, 韩永生, 等. 乌拉尔甘草中新香豆素的化学研究[J]. 药学学报, 1991,26 (2) :147–151. |
| [6] | 段天玻, 马长华, 王文全, 等. HPLC-MS法鉴定甘草的指纹图谱[J]. 中国药师, 2009,12 (4) :414–417. |
| [7] | 张娟, 刘芬, 李宁, 等. UPLC-TOF-MS法鉴定胀果甘草药渣中黄酮类成分[J]. 现代药物与临床, 2012,27 (6) :558–561. |
| [8] | 张永, 严安定, 高建. 液质联用技术鉴定甘草提取物中的主要化学成分[J]. 中成药, 2012,34 (6) :1111–1116. |
| [9] | 陈佩东, 周习, 丁安伟. 炙甘草水煎液的HPLC-MS分析[J]. 中草药, 2014,45 (10) :2115–2120. |
| [10] | 徐英, 董静, 王弘, 等. 电喷雾-离子阱-飞行时间质谱联用研究黄酮和异黄酮苷元C环的裂解规律[J]. 高等学校化学学报, 2009,30 (1) :46–50. |
| [11] | Zhang Q Y, Ye M. Chemical analysis of the Chinese herbal medicine Gan-cao (licorice)[J]. J Chromatogr A, 2009, 1216 (11) :1954–1969 . |
| [12] | 刘晓帆.液质联用技术应用于小柴胡汤药效物质基础研究[D].上海:第二军医大学, 2009. |
| [13] | 霍文杰, 高英, 李卫民, 等. 甘草中异戊烯基类黄酮的富集及高效液相色谱-质谱联用分析[J]. 北方药学, 2013,10 (11) :1–2. |
| [14] | Yahara S, Nishioka I. Flavonoid glucosides from licorice[J]. Phytochemistry, 1984, 23 (23) :2108–2109 . |
| [15] | Fukai T, Marumo A, Kaitou K, et al. Anti-Helicobacter pylori flavonoids from licorice extract[J]. Life Sci, 2002, 71 (12) :1449–1463 . |
| [16] | Minpei K, Yoshihiro M, Shinichi H, et al. Phenolics from Glycyrrhiza glabra roots and their PPAR-cligand-binding activity[J]. Bioorg Med Chem, 2010, 18 (2) :962–970 . |
| [17] | Fukai T, Wang Q H, Takayama M, et al. Structures of five new prenylated flavonoids, Gancaonin L, M, N, O, and P from aerial parts of Glycyrrhiza uralensis[J]. Heterocycles, 1990, 30 (2) :373–382 . |
| [18] | Nomura T, Fukai T, Wang Q H, et al. Structures of six isoprenoid-substituted flavonoids, Gancaonins F, G, R, I, Glycyrol, and isoglycyrol from Xibei Licorice[J]. Heterocycles, 1989, 29 (2) :1761–1772 . |
| [19] | ShakhnozaS A, ValentinaI V. Natural compounds-flavonoids[M]. New York: Springer, 2013 . |
| [20] | Nomura T, Fukai T. Phenolic constituents of Licorice (Glycyrrhiza species)[J]. Chem Inform, 1998, 29 (13) :1–158 . |
| [21] | 刘运爱, 王彩兰, 黄卫东, 等. 甘草次酸及衍生物的质谱研究[J]. 质谱学报, 1996,17 (1) :27–35. |
| [22] | 李坤平, 高崇凯, 李卫民. UPLC/ESI-TOF-MS/MS分析蛇床子提取物中香豆素类化合物[J]. 中成药, 2009,31 (4) :584–587. |
 2016, Vol. 47
2016, Vol. 47


