2. 天津药物研究院, 天津 300193 ;
3. 中国人民武装警察部队后勤学院, 天津 300309
2. Tianjin Pharmaceutical Research Institute, Tianjin 300193, China ;
3. College of Logistics, University of People's Armed Police Force, Tianjin 300309, China
柴胡Bupleuri Radix为我国常用中药材,始载于《神农本草经》,列为上品,其性味苦凉、微寒,具有解表和里、疏肝解郁、升举阳气之功效[1]。《中国药典》2015年版收录伞形科(Umbelliferae)植物柴胡(又称北柴胡)Bulpeurum chinese DC.和狭叶柴胡(又称南柴胡)Bulpeurum scorzonerifolium Willd.为正品柴胡入药。柴胡在我国应用已有2 000多年的历史,为中医治疗少阳证的首选要药。
现代研究明,柴胡主要含有挥发油、皂苷、有机酸、黄酮及甾醇类[2-6],其中柴胡皂苷为柴胡的主要有效成分[7-8]。孙健等[9]利用LC-MS分析了柴胡中的22种皂苷类成分。蔡华等[10]利用UPLC-MS的方法建立了柴胡的指纹图谱体系。目前,很多学者也利用液质联用技术测定柴胡中皂苷的成分,进行质量控制研究[11-13]。柴胡中除了皂苷类成分,还有黄酮和酚酸类等多种成分。本实验优化色谱条件,采用HPLC-Q-TOF-MS技术对柴胡70%甲醇提取物的化学成分进行鉴别和测定,共检测出24个色谱峰,并根据质谱裂解规律及对照品对照,鉴定了21个化合物,包括黄酮类、酚酸类、三萜皂苷类,其中异绿原酸A(isochlorogenic acid A,5)、异绿原酸B(isochlorogenic acid B,6)、7, 3′-二甲氧基槲皮素(7, 3′-di-O-methylquercetin,8)和5-羟基-7-乙酰氧基黄酮(5-hydroxy-7-acetoxyflavone,24)为该植物中首次发现。
1 仪器与试剂1200 HPLC-TOF/MS(Bruker Daltonics),1200 HPLC(Agilent technology),Milli-Q超纯水系统(法国Millipore公司)。
甲醇和乙腈(色谱纯,美国Merck公司),对照品绿原酸(批号110753-201314)、柴胡皂苷A(批号110777-201309)和柴胡皂苷D(批号110778-201208)购自南京泽朗医药科技有限公司,质量分数均大于98%;对照品芦丁(批号KMST-L020)、柴胡皂苷B2(批号KMST-C015)、异绿原酸A(批号KMST-Y051)和异绿原酸B(批号KMST-Y052)购自天津市科曼思特医药科技发展有限公司,质量分数大于98%。
柴胡药材购于安国药材市场,由天津药物研究院张铁军研究员鉴定为北柴胡Bulpeurum chinese DC.的干燥根。
2 实验方法 2.1 对照品溶液配制精密称取绿原酸、异绿原酸A、异绿原酸B、柴胡皂苷A、柴胡皂苷B2、柴胡皂苷D、芦丁对照品各2.00 mg,分别置于10 mL量瓶中,加入适量50%甲醇溶解,并以50%甲醇定容,得到质量浓度为200μg/mL对照品贮备液。进样前将对照品贮备液用50%甲醇稀释10倍,经0.22μm微孔滤膜滤过,取续滤液备用。
2.2 供试品溶液配制取柴胡粉末1 g,加入70%甲醇20 mL置圆底烧瓶中,称定质量,回流提取30 min,放至冷却,称定质量,再用70%甲醇补足减失质量,摇匀。滤过得滤液,经0.22μm微孔滤膜滤过,备用。
2.3 色谱-质谱条件 2.3.1 色谱条件色谱柱为Diamonsil II C18柱(250 mm×4.6 mm,5μm);流动相为0.05%甲酸水溶液(A)-乙腈(B),梯度洗脱:0~10 min,15% B;10~15 min,20% B;15~40 min,25% B;40~70 min,35% B;70~90 min,60% B;90 min,80% B;体积流量为1.0 mL/min;柱温35℃;200~600 nm全波长扫描;进样量5μL。
2.3.2 质谱条件流动相采用分流方式,分流比设为1∶4。TOF-MS实验条件:ESI离子源,正负离子分别进行全扫描,扫描质量范围m/z 50~1 200;干燥气体积流量6 L/min,干燥气温度180℃,雾化气压80 kPa。毛细管电压:正离子模式4.5 kV、负离子模式2.6 kV,碎裂电压200 V。选择甲酸钠溶液为内标校正。
3 实验结果 3.1 柴胡中化学成分分析采用HPLC-Q-TOF-MS正负离子模式分析柴胡药材70%甲醇提取物的(+) ESI-MS、(−) ESI-MS的质谱总离子流图(TIC)如图 1所示,通过HPLC-Q-TOF-MS技术检测得到24个离子流峰的保留时间和质谱数据信息。通过分析每个离子流峰的质谱裂解规律,并参考相关文献、结合对照品进行对照,共识别出21个化合物。其中包括3个酚酸类成分、4个黄酮类成分和14个三萜皂苷类成分,结果见表 1。
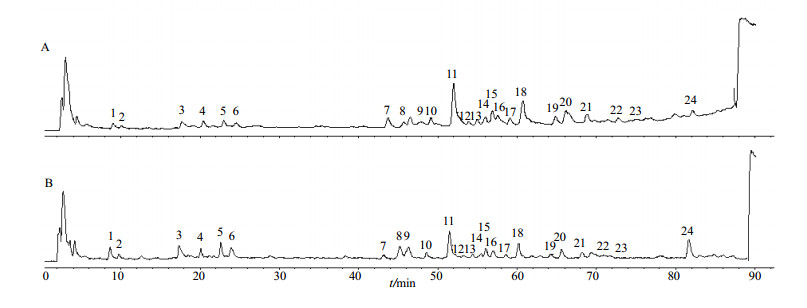
|
图 1 柴胡的HPLC-Q-TOF-MS正离子模式(A)和负离子模式(B)总离子流图 Fig.1 Totalion chromatograms of HPLC-Q-TOF-MS by positive mode (A) and negative mode (B) for Bupleuri Radix |
|
|
表 1 柴胡中黄酮、酚酸、三萜皂苷成分的质谱数据及鉴定结果 Table 1 Flavonoids, phenolic acid, and triterpenoid saponins identified in extracts from roots of B. chinense |
3.2 化合物的质谱裂解规律分析 3.2.1 酚酸类化合物的分析鉴定
柴胡中的酚酸类化合物主要为绿原酸类成分。通过分析化合物在正离子质谱中的[M+Na]+、[M+H]+,在负离子质谱中相应的[M-H]−,比对后确定该化合物的相对分子质量。同时根据获得碎片峰的裂解规律鉴定出化合物的结构(图 2)。绿原酸类化合物在质谱解析中表现出了相似的裂解规律,如丢失奎宁酰基(m/z 192),H2O(m/z 18),咖啡酰基(m/z 162),这类化合物都存在很多相似的裂解碎片峰,如m/z 355.104 2、163.033 5等[14]。
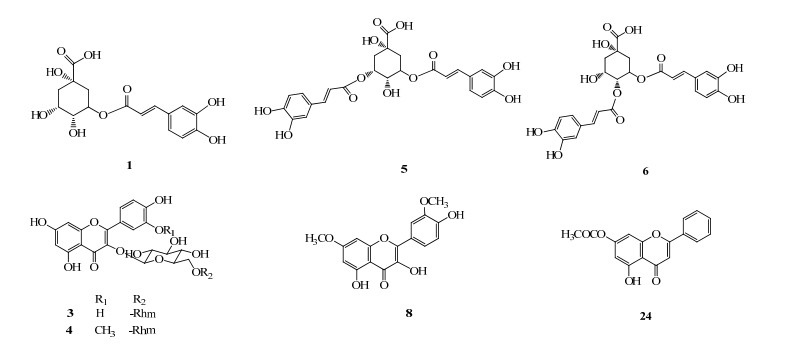
|
图 2 柴胡中黄酮类成分及酚酸成分的结构 Fig.2 Structures of flavonoids and phenolic acid identified in Bupleuri Radix |
5号峰和6号峰通过分析正离子m/z 539 [M+Na]+、m/z 517 [M+H]+和负离子m/z 515 [M-H]−确定这2个化合物的相对分子质量均为516,且具有相类似的裂解规律,说明二者可能为同分异构体结构。如图 3所示,m/z 517 [M+H]+离子首先发生丢失1个咖啡酰基碎片(m/z 163)的裂解反应,产生m/z 355离子,这是由于咖啡酰基位于结构的外侧,易于脱落;在此基础上,结构再次脱落奎宁酸基团部分片段,丢失m/z 192的碎片,剩余1个咖啡酰基的片段碎片,产生m/z 163的离子碎片。因此,结合文献对照确定该类化合物为异绿原酸类化合物。且在相同的质谱条件下与对照品异绿原酸A的裂解规律和出峰时间相一致,该化合物的分子式为C29H36O15,相对分子质量理论值为516.126 8,实测值为539.124 4([M+Na]+),推测该化合物为异绿原酸A。以同样的方式确定了另一个同分异构体即6号峰化合物为异绿原酸B。
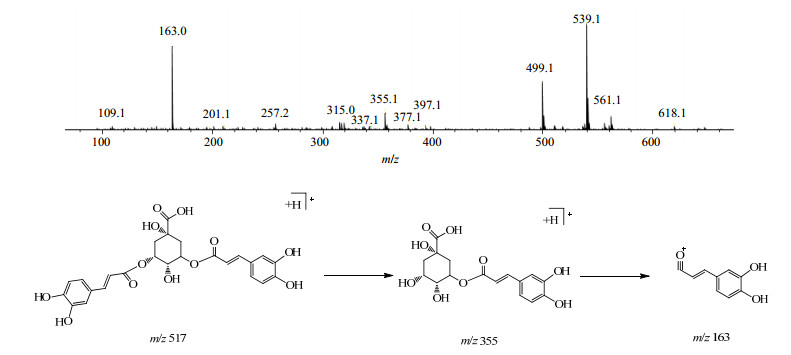
|
图 3 异绿原酸A (峰5)的正离子质谱及其可能的裂解途径 Fig.3 MS fragment pathway of isochlorogenic acid A (Peak 5) under positive mode |
质谱图中1号峰通过正离子m/z 377 [M+Na]+和负离子m/z 353 [M-H]−分析确定该化合物的相对分子质量为354。如图 4所示,1号峰的裂解碎片中只观察到丢失1个奎宁酸片段(m/z 192)而获得1个咖啡酰基碎片峰(m/z 163),结合对照品的裂解规律对比,确定1号峰对应的化合物为绿原酸。
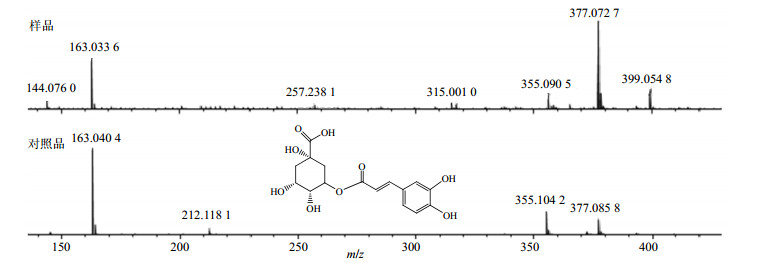
|
图 4 绿原酸(峰1)的质谱裂解和对照品对比 Fig.4 MS fragment of chlorogenic acid (Peak 1) and comparison with reference substances |
3.2.2 黄酮类化合物的分析鉴定
黄酮类成分是柴胡中的另一类主要功效成分。本实验利用HPLC-Q-TOF-MS技术从柴胡药材70%甲醇提取物中共识别了4个黄酮类化合物,其中3个黄酮醇及其苷类成分,1个黄酮苷元类成分。结构见图 2。
3号峰是槲皮素苷元的特征离子峰,通过正离子m/z 611 [M+H]+和负离子m/z 609 [M-H]−分析确定化合物的相对分子质量为610。裂解过程如图 5所示,化合物脱去了1分子鼠李糖基m/z 146产生的离子碎片峰m/z 465 [M+H-146]+和继续脱去1分子葡萄糖基而得到的苷元离子峰m/z 303 [M+H-146-162]+。且如图 5所示3号峰在相同的质谱条件下与对照品芦丁的裂解规律和出峰时间相一致,因此确定3号峰为芦丁。
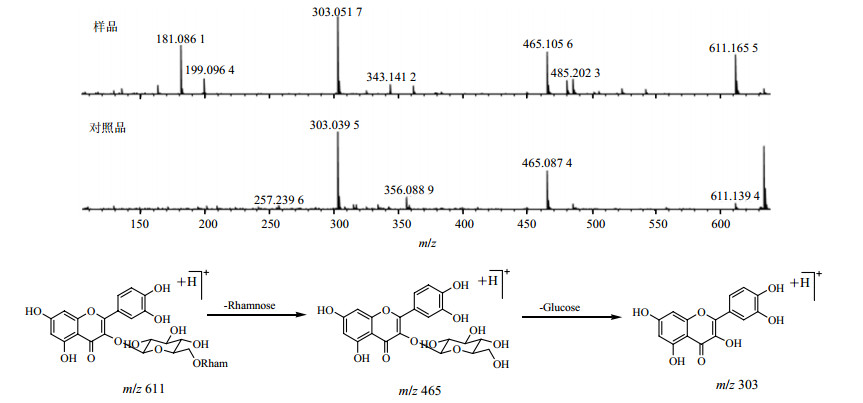
|
图 5 芦丁(峰3)可能的裂解过程及其质谱与对照品的比对图谱 Fig.5 MS fragment pathway of compound 3 and comparison map of its MS with reference substances |
4号峰通过分析正离子m/z 625 [M+H]+和负离子m/z 623 [M-H]−确定化合物的相对分子质量为624。4号峰的极性弱于3号峰,其相对分子质量比3号峰多出m/z 14,且在4号峰的裂解规律中,发现2个碎片峰479 [M+H-Rhamnose]+,317 [M+H-Rhamnose-Glucose]+,因此推测该化合物是在峰3的基础上,苷元中的1个OH被甲基化,结合其裂解过程并比对文献报道[15],确定为水仙苷。
另外2个黄酮类化合物均为苷元。8号峰通过正离子m/z 353 [M+Na]+和负离子m/z 329 [M-H]−分析确定化合物的相对分子质量为330。该化合物的分子式为C29H36O15,相对分子质量理论值为330.074 0,实测值为331.076 0([M+H]+),根据其分子离子峰和裂解的碎片信息结合文献报道鉴定峰8为7, 3′-二甲氧基槲皮素[16]。24号峰极性最小,其通过分析正离子m/z 297 [M+H]+和负离子m/z 295 [M-H]−确定化合物的相对分子质量为296。该化合物的裂解过程中有明显的脱去乙酰基的碎片,化合物的分子式为C29H36O15,相对分子质量理论值为296.068 2,实测值为297.060 6([M+H]+),根据其分子离子峰和裂解碎片信息结合文献报道[17]鉴定其为5-羟基-7-乙酰基黄酮。
3.2.3 三萜皂苷类化合物的分析鉴定柴胡中皂苷类成分是其主要功效成分,根据液质分析结果和对照品比对,并参考相关文献,共识别了14个皂苷类成分。结构见图 6。
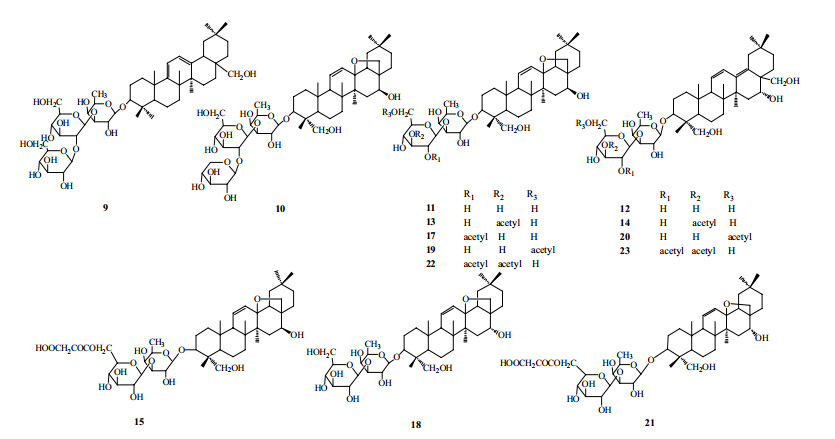
|
图 6 柴胡中三萜皂苷类成分的结构 Fig.6 Structures of triterpenoid saponins identified in Bupleuri Radix |
11号峰通过正离子m/z 781 [M+H]+和负离子m/z 779 [M-H]−分析确定化合物的相对分子质量为780。在11号峰的质谱图中可以观察到准分子离子峰[M+H]+ m/z 781丢失1个葡萄糖基(m/z 162)形成m/z 619 [M+H-Glc]+碎片离子;丢失1一个葡萄糖基(m/z 162)和一个海藻糖基(m/z 146)形成m/z 473 [M+H-Glc-Fuc]+碎片离子。在相同的质谱条件下与对照品柴胡皂苷A的裂解规律和出峰时间相一致,该化合物的分子式为C29H36O15,相对分子质量理论值为780.166 0,实测值为803.168 0 [M+Na]+,因此确定11号峰为柴胡皂苷A。其裂解规律及质谱图见图 7。
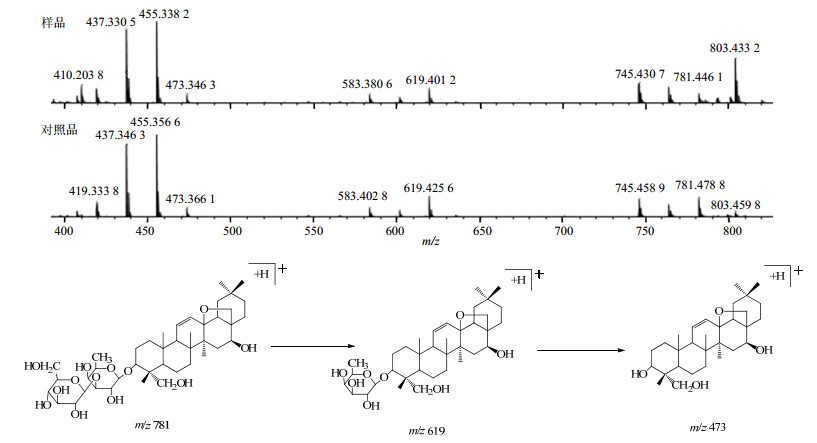
|
图 7 柴胡皂苷A (峰11)的质谱图比对和裂解规律推测 Fig.7 Comparison of MS fragment and speculated fragmentation regularity of saikosaponin A (Peak 11) |
12号峰通过正离子m/z 803 [M+Na]+、m/z 781[M+H]+和负离子m/z 779 [M-H]−分析确定化合物的相对分子质量为780。其裂解规律和11号峰非常接近,说明其为11号峰的同分异构体。该化合物在相同的质谱条件下与对照品柴胡皂苷B2的裂解规律和出峰时间相一致,因此确定12号峰为柴胡皂苷B2。
18号峰通过正离子m/z 803 [M+Na]+、m/z 781 [M+H]+和负离子m/z 779 [M-H]−分析确定其相对
分子质量也是780。其与11号峰具有相同的裂解过程,但是峰高比是不同的,说明该化合物是与11号峰对应化合物的同分异构体,该化合物在相同的质谱条件下与对照品柴胡皂苷D的裂解规律和出峰时间相一致,因此鉴定18号峰为柴胡皂苷D。柴胡皂苷A和D的裂解途径及其质谱图如图 7、8所示。
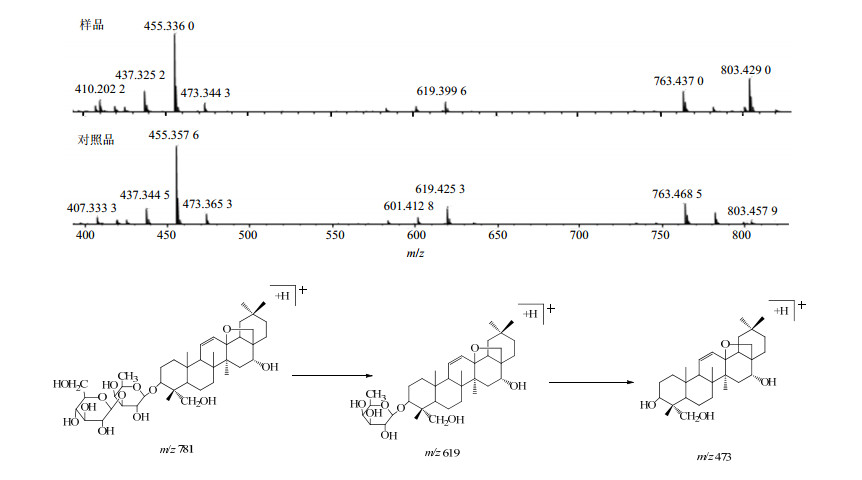
|
图 8 柴胡皂苷D (峰18)的质谱图比对和裂解规律推测 Fig.8 Comparison of MS fragment and speculated fragmentation regularity of saikosaponin D (Peak 18) |
13、14、17、19和20号峰的质谱数据分析,正离子模式中m/z 823 [M+H]+离子和负离子模式中m/z 821 [M-H]−离子分析确定其相对分子质量也是822。这5个峰信号对应的化合物具有相同的相对分子质量,相类似的质谱裂解规律,说明它们是同分异构体的化合物。根据其质谱的裂解过程中都可以首先观察到丢失m/z 42的碎片峰推测这些化合物都是在峰11基础上不同位置进行了乙酰化得到一系列柴胡皂苷产物,这也是文献报到的一类主要的柴胡皂苷化合物。结合文献报道[10]的液质分析结果并综合乙酰化产物的极性,将这5个乙酰化柴胡皂苷的结构进行归属分别为2″-乙酰基柴胡皂苷A(13号峰)、3″-乙酰基柴胡皂苷A(14号峰)、4″-乙酰基柴胡皂苷A(17号峰)、6″-乙酰基柴胡皂苷A(19号峰)和2″-乙酰基柴胡皂苷D(20号峰)。
按照同样的方法22号峰和23号峰利用分析正离子模式中m/z 865 [M+H]+离子和负离子模式中m/z 863 [M-H]−离子分析确定其相对分子质量也是864。在这2个化合物的质谱碎片峰中能够观察到脱去2个m/z 42的碎片峰m/z 619,其他的裂解规律与乙酰化柴胡皂苷相一致,说明这两个化合物也是同分异构体,且为二乙酰化柴胡皂苷,结合分析化合物极性,根据文献对比[18]和丢失乙酰基的数目,确定22号峰和23号峰分别为2″, 3″-二氧-乙酰基柴胡皂苷A和2″, 3″-二氧乙酰基柴胡皂苷B2。
15号峰和21峰利用分析正离子m/z 867 [M+H]+离子和负离子m/z 865 [M-H]−分析确定其相对分子质量也是866。其质谱裂解过程中可以观察到脱落malonyl基团m/z 86的碎片,其他的与11号峰和18号峰裂解过程非常相近,结合文献报道[19]归属了15号峰和21号峰为丙二酰基乙酰基柴胡皂苷A和丙二酰基乙酰基柴胡皂苷D。
4 讨论本研究利用HPLC-Q-TOF-MS技术分析了柴胡药材的70%甲醇提取物中存在的化学成分,根据正负离子模式下准分子离子峰,再结合各个化合物的裂解规律,并与对照品在相同质谱条件下进行比对,从柴胡提取物中共确定了21个化合物,鉴定了3个酚酸类成分,4个黄酮类化合物和14个三萜皂苷类成分,其中4个化合物(异绿原酸A、异绿原酸B、7, 3′-二甲氧基槲皮素、5-羟基-7-乙酰基黄酮)为首次从该植物中鉴定发现。
本实验通过分析正负离子模式下质谱提供的准分子离子[M+Na]+和[M-H]−数据,并结合质谱的高分辨率可得到化合物的可靠相对分子质量;从而快速分析柴胡提取物中的组分结构,这也是目前研究、推测中药成分的有效手段。研究结果为柴胡饮片的质量控制,以及后续阐明柴胡药材的物质作用基础提供了详实的数据支撑。
| [1] | 中国药典[S].一部. 2015. |
| [2] | 潘胜利.中国的药用柴胡及其药理作用的研究[A]//第三届中药研讨会论文摘要集[C].上海:中国药学会, 1996. |
| [3] | 史青, 聂淑琴, 黄璐琦. 柴胡属植物化学成分及药理研究新进展[J]. 中国实验方剂学杂志, 2002,8 (5) :53–56. |
| [4] | 梁鸿, 赵玉英, 崔艳君. 北柴胡中黄酮类化合物的分离鉴定[J]. 北京医科大学学报, 2000,32 (3) :223–225. |
| [5] | 梁鸿, 赵玉英, 李德宇. 柴胡属植物化学成分及药理作用研究进展[J]. 国外药学:植物药分册, 1999,14 (5) :191–195. |
| [6] | 沃源, 姚琳, 孙世伟. 北柴胡化学成分的研究进展[J]. 黑龙江医药, 2011,24 (2) :215–218. |
| [7] | 梁之桃, 秦民坚, 王峥涛. 柴胡属植物皂苷成分研究进展[J]. 天然产物研究与开发, 2001,13 (6) :67–77. |
| [8] | 刘晓帆.液质联用技术应用于小柴胡汤药效物质基础研究[D].上海:第二军医大学, 2009. |
| [9] | 孙健, 张立富, 范斌, 等. 柴胡皂苷类化学成分的LC-MS分析[J]. 中国药物警戒, 2012,9 (12) :725–727. |
| [10] | 蔡华, 叶方, 杨光义, 等. 鄂西北地区竹叶柴胡UPLC-MS指纹图谱研究[J]. 中国药师, 2014,17 (5) :797–800. |
| [11] | 晁志, 梁镇标.基于UPLC-O-TOF-MS的三种柴胡药材的质量分析[A]//代谢组学与中医药现代研究学术论坛、第二届中荷代谢组学国际合作培训班论文集[C].北京:中华人民共和国科学技术部、国家自然科学基金委, 2013. |
| [12] | 张宇霞.三种中草药中皂苷类化合物的液质联用分析[D].上海:东华大学, 2013. |
| [13] | 阿布拉江·克依木.黄酮苷类天然产物的质谱分析方法研究[D].北京:中国协和医科大学, 2003. |
| [14] | 张倩, 张加余, 隋丞琳, 等. HPLC-DAD-ESI-MS/MS研究金银花水提工艺中绿原酸成分的变化规律[J]. 中国中药杂志, 2012,37 (23) :3564–3568. |
| [15] | Azimova S S, Vinogradova V I. Natural Compounds: Flavonoids[M]. New York: Springer New York, 2013 . |
| [16] | Bennett R N, Mellon F A, Rosa E A, et al. Profiling glucosinolates, flavonoids, alkaloids, and other secondary metabolites in tissues of Azima tetracantha L. (Salvadoraceae)[J]. J Agric Food Chem, 2004, 52 (19) :5856–5862 . |
| [17] | Haynes L J, Taylor D R. C-glycosyl compounds. Part V. Mangiferin; the nuclear magnetic resonance spectra of xanthones[J]. J Chem Soc C, 1966 :1685–1687 . |
| [18] | 黄海强.柴胡属植物化学成分和质量控制研究及天目藜芦化学成分研究[D].上海:第二军医大学, 2010. |
| [19] | Ebata N, Nakajima K, Taguchi H, et al. Isolation of new saponins from the root of Bupleurum falcatum L.[J]. Cliem Pharm Bull, 1990, 38 (5) :1432–1434 . |
 2016, Vol. 47
2016, Vol. 47


